龙须菜多糖对D-半乳糖及氯化铝致大鼠学习记忆障碍的影响
陈 茜,李嘉慈,吕应年,吴科锋,叶 华,李 立,*
(1.广东医科大学第一临床医学院,广东湛江 524523;2.韶关医学院,广东韶关 512026;3.广东医科大学广东天然药物研究与开发重点实验室,广东湛江 524523;4.广东医科大学海洋医药研究院,广东湛江 524523)
多糖是一类结构复杂的生物大分子,在微生物、植物、动物等生物体内广泛分布,并参与众多重要生命活动过程[1]。海藻是生长在海洋中的低等隐花植物[2],其多糖是从海藻中提取出的多组分混合物,由多个相同或不同的单糖基通过糖苷键相连而成的高分子碳水化合物。海藻多糖因其凝胶性、稳定性、成膜性等多种特性,以及抗氧化、免疫调节、抗肿瘤、抗病毒、抗凝血等多种生物活性,目前已成为化妆品、食品及保健医药等领域的研究热点[3]。龙须菜(Gracilarialemaneiformis),又名海发菜,系红藻门、杉藻目、江蓠科、江蓠属的一种红藻,为传统药食两用海藻类植物,是继紫菜、海带、裙带菜之后的中国第四大栽培海藻,其多糖含量高达30%左右[4]。研究显示,龙须菜多糖(Gracilarialemaneiformispolysaccharides,GPs)具有抗氧化、抗病毒、修复受损肾上皮细胞、降低糖尿病小鼠血糖以及提高线虫寿命等多种生物活性[5-9]。
阿尔茨海默病(Alzheimer’s disease,AD)是导致记忆损害及认知缺陷的毁灭性神经退行性疾病。在全世界,AD患者已达3560万人,预期到2050年将达到1亿1500万人[10]。AD为最常见的老年人死亡原因,虽然已有众多治疗分子被设计用来克服该疾病所引起的社会、经济及医疗负担,但遗憾的是,人们发现几乎所有的化学物质在临床实践中均仅限于姑息治疗[11]。AD的病理特征为β-淀粉样蛋白(Aamyloidβ,Aβ)斑块及神经纤维缠结,而氧化应激(Oxidative stress)则参与AD的发生、发展全过程。研究表明,Aβ诱导氧化应激,促进活性氧(Reactive oxygen species,ROS)生成,进而导致脂质过氧化、蛋白氧化、tau蛋白过磷酸化,最终对突触和神经元产生毒性作用;反过来,氧化应激也会提高Aβ生成。鉴于此,采用抗氧化剂治疗AD可能不失为一个可行策略[12]。已知最著名的抗氧化剂为维生素C及维生素E。一些研究显示补充抗氧化剂,包括维生素C及E,或富含这些营养素的饮食可防止氧化应激,从而降低AD风险。研究还表明,摄入维生素C具有神经保护作用,可改善AD患者的认知[13]。
研究发现包括海藻多糖在内的一些多糖具有神经保护作用,如羊栖菜多糖可显著改善AD模型动物的认知功能[14],褐藻多糖则通过减少AD线虫的Aβ积聚并降低Aβ诱导的ROS生成,从而缓解AD表型的进程[15]。鉴于此,作者检测了GPs对AD模型大鼠的影响,并探讨了可能机制。
1 材料与方法
1.1 材料与仪器
龙须菜多糖 由本实验室提供,纯度≥95%,通过醇提法制备[16];半乳糖(D-galactose,D-gal)、氯化铝(aluminumchloride,AlCl3) 分析纯,上海国药集团化学试剂有限公司;超氧化物歧化酶(SOD)测试盒、谷胱甘肽过氧化物酶(GSH-PX)测试盒、微量丙二醛(MDA)测试盒 南京建成生物工程研究所;SPF级雌性SD大鼠28只,7周龄,体重(200±20) g,动物及饲料 均购自广东医科大学实验动物中心,实验动物生产许可证号:SCXK(粤)2013-0008,广东医科大学实验动物中心实验动物使用许可证号:SYXK(粤)2015-0147。
OLYMPUS DP73显微镜 日本OLYMPUS公司;ELx800酶标仪 美国BIO-TEK公司;Morris水迷宫系统 淮北正华生物仪器设备有限公司。
1.2 实验方法
1.2.1 模型建立及给药 大鼠室温饲养,自由进食及饮水,自然昼夜节律光照。适应性饲养7 d后,根据先前文献报道方法,注射D-gal及AlCl3建立AD大鼠模型[17]。大鼠随机分为对照组(n=7)及AD组(n=21)。对照组每日腹腔注射生理盐水(0.2 mL/只),AD组每日腹腔注射D-gal(60 mg/kg)及AlCl3(10 mg/kg)。AD组进一步分为3组(n=7),即AD模型组、GPs低剂量组、GPs高剂量组。对照组及模型组每日以生理盐水灌胃,GPs低剂量组及高剂量组则每日以GPs灌胃(300及600 mg/kg)。给药与造模同步,均持续42 d,具体流程及后续实验如图1所示。

图1 处理及行为测试时线
1.2.2 Morris水迷宫实验 Morris水迷宫(Morris water maze,MWM)实验方法参考先前文献[18]报道。MWM实验装置为一圆形水箱(直径120 cm、高80 cm)。水箱内装有温水(23±1 ℃),深40 cm,并以白色无毒染料使其不透明。水箱被分为四个象限(NE、SE、SW和NW),一个不可见的平台(直径12 cm)固定在SW-III象限(目标象限),并淹没在水面下2 cm处。以悬于游池上方的摄像机记录动物行为,并采用视频计算跟踪系统(中国医学科学院医学研究所)进行分析。在给药第44 d,训练大鼠在各种环境的提示下寻找并爬上水下平台。在获得性训练(acquisition trial)阶段(给药第45~48 d),大鼠每日接受4次测试,四个起始位置(NE-Ⅰ、NW-Ⅱ、SW-Ⅲ、SE-Ⅳ)各使用一次,而平台始终位于同一象限(SW-Ⅲ)。大鼠头朝池壁放入水中,并给予60 s寻找隐藏平台,到达平台的时间被记录为逃避潜伏期(escape latency)。如果超过60 s仍找不到平台,则引导大鼠到平台之上,并停留10 s。在给药第49 d进行空间探索实验(spatial exploration test),移除平台,将大鼠置于非平台所在象限,并记录其60 s内穿越原平台位置的次数。
1.2.3 标本采集 MWM实验结束24 h后,采用戊巴比妥(30 mg/kg)麻醉大鼠。取出除小脑外的全脑,生理盐水冲洗。取大鼠左半球脑组织以10%福尔马林浸泡固定、石蜡包埋,用于病理学检查;取大鼠大脑右半球的海马组织,-80 ℃保存,用于氧化应激标志物检测。
1.2.4 苏木精伊红染色 石蜡包埋标本4 μm厚连续切片,脱蜡,再以苏木精伊红(H&E)染色。
1.2.5 大脑海马组织氧化应激分析 采用市售商品化试剂盒,并按照试剂盒所附说明书测定大鼠海马组织SOD、GSH-Px活性及MDA水平。
1.3 数据处理
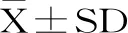
2 结果与分析
2.1 GPs干预对大鼠MWM实验结果的影响
在正常浓度下,D-gal被代谢为半乳糖-1-磷酸;在高浓度下,D-gal则被转化为半乳糖醇,半乳糖醇在细胞中积累,然后破坏渗透应激平衡并产生ROS[19]。在动物模型中长期注射D-gal可致氧化应激、神经元损伤以及认知能力衰退[20]。另一方面,在正常生理条件下,铝(Al)可在大脑不同区域的神经元中积聚,引起神经元凋亡性丢失,长期暴露于Al可引起氧化应激以及海马损伤[21]。过量暴露于Al还会导致β-淀粉样前体蛋白(APP)过表达以及β-淀粉样斑块在脑细胞上沉积,这就使Al成为了一种可行的阿尔茨海默诱导物[22]。因此,在啮齿类动物中联用D-gal及AlCl3是获得AD模型的有效、廉价方法,用于研究AD机制及药物筛选[23-24]。MWM是测试海马功能的有力工具,目前仍被用于评估学习及记忆能力[25],该实验包括两个程序,即获得性训练及空间探索实验,分别用于测量动物的学习能力及记忆巩固能力[17]。
在获得性训练阶段,与对照组相比,AD模型组在4 d的训练中逃避潜伏期显著延长(P<0.05),表明AD模型大鼠学习能力严重受损,提示AD造模成功。与AD模型组相比,从获得性训练第2 d起,无论是GPs低剂量组还是高剂量组,GPs干预均显著地缩短了AD大鼠的逃避潜伏期(低剂量组:相应地,P<0.05、0.05、0.01;高剂量组:相应地,P<0.01、0.01、0.01),提示口服GPs可缓解由于D-gal及AlCl3处理所导致的大鼠学习障碍(图2)。

图2 训练日的平均逃避潜伏期(n=7)
空间探索实验结果与上述获得性训练结果类似,AD模型组大鼠穿越原平台所在位置的次数极显著地(P<0.001)低于对照组,而GPs干预则极显著地提高了AD大鼠穿越原平台所在位置的次数(低剂量组:P<0.01;高剂量组:P<0.01)(图3、图4),提示口服GPs提高了AD大鼠对平台空间位置记忆的保持能力。
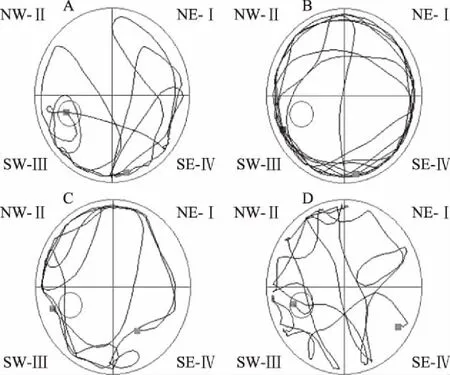
图3 空间探索试验中具有代表性的个体大鼠游泳轨迹
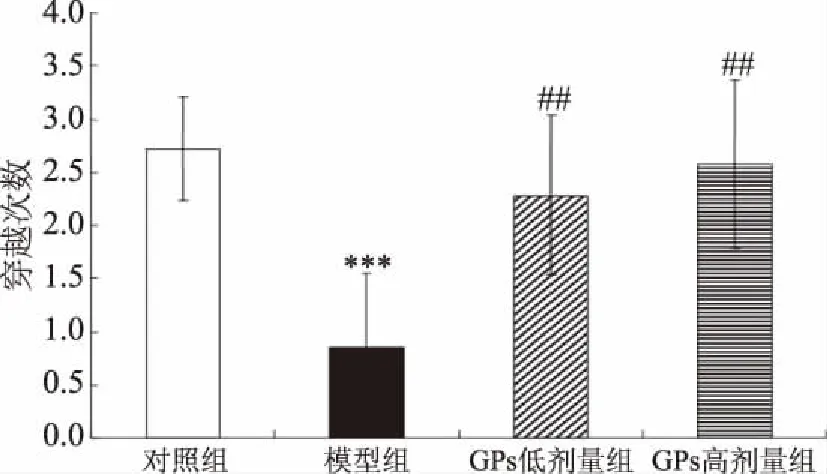
图4 穿越平台位置次数(n=7)
2.2 GPs对D-gal及AlCl3诱导的大鼠海马形态改变的影响
与对照组相比,AD模型组大鼠海马CA1区锥形细胞排列松散、紊乱。GPs的干预则改善了上述AD大鼠CA1区锥形细胞的无规则排列状态(图5)。研究显示,与正常人相比,AD患者大脑海马CA1区常出现萎缩,提示CA1区形态学改变与AD发病关系密切[26-28]。在本研究中,虽然不能确定AD模型大鼠海马CA1区是否发生萎缩,但可以确定D-gal及AlCl3联用可使大鼠海马CA1区锥形细胞排列方式发生改变,而GPs灌胃则可有效地逆转上述该种改变。在本研究中,HE染色检测只是定性,不能定量,即不能确定不同剂量的GPs维持海马正常形态的能力是否不同。与本研究类似,单独HE检测虽然可以发现不同剂量的草药KXS均可提高AD大鼠海马神经细胞的存活并维持这些细胞的有序排列,但同样没有给出明确的剂效关系[29]。

图5 大鼠海马CA1区组织病理学分析(H&E,×200)
2.3 GPs对D-gal及AlCl3诱导的大鼠海马氧化应激的影响
与对照相比,AD模型组大鼠海马SOD及GSH-PX活性均极显著地下降(相应地,P<0.001、0.001)(图6、图7)。与AD模型组相比,GPs干预组SOD及GSH-PX活性则极显著地提高(低剂量组:相应地,P<0.01、0.001;高剂量组:相应地,P<0.01、0.001)。另一方面,与对照相比,AD模型组大鼠海马MDA水平极显著地提高(P<0.001),而GPs灌胃则极显著地阻止了D-gal及AlCl3诱导的MDA水平升高(P<0.001)(图8)。
图6 GPs对大鼠海马SOD活性的影响
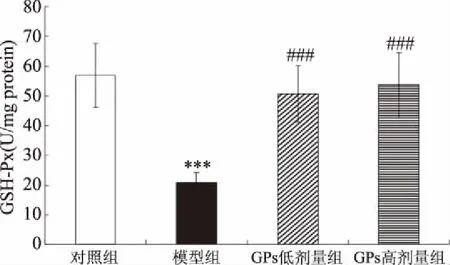
图7 GPs对大鼠海马GSH-Px活性的影响
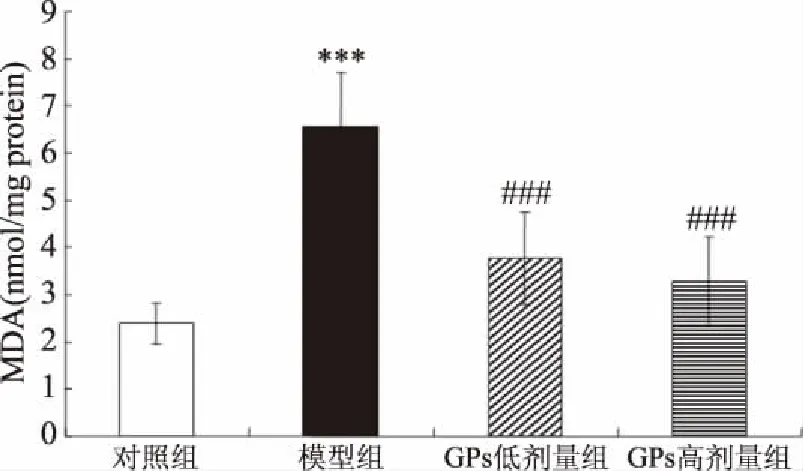
图8 GPs对大鼠海马MDA水平的影响
前期研究显示,GPs降解的单糖主要为半乳糖(38%)、葡萄糖(15%)、氨基葡萄糖(15%)、甘露糖(9.2%)以及少量岩藻糖等还原性糖,而GPs的抗氧化应激活性应与其含有这些大量还原性糖有关。还原性糖主要结构为具有还原性的多羟基以及醛基,在生化反应中羟基及醛基能被氧化成羧基。
目前AD病因尚未完全明了,但最近的假说认为,氧化损伤是AD早期事件,正是氧化损伤启动了AD的其他病理过程[30]。通过阻止氧化损伤,抗氧化剂(SOD及GSH-Px)在抗氧化防御系统中发挥了重要作用,而丙二醛(MDA)作为脂质过氧化的终极产物之一,则成为自由基介导损伤的一个标志物,间接地反映了氧化损伤程度[31]。研究显示,香菇多糖对AD大鼠学习记忆能力具有一定改善作用,其机制可能与增强大鼠大脑抗氧化能力有关[32];而土党参多糖改善脑损伤小鼠学习记忆,也同样伴随着脑中GSH、SOD活性的提高,以及脑中MDA水平的下降[33]。因此,本研究检测了大鼠海马SOD、GSH-Px活性及MDA水平。研究结果显示,AD模型大鼠SOD、GSH-Px活性较正常大鼠明显降低,而MDA水平则显著提高,该结果与另一种常用的AD动物模型建立方法即大脑注射Aβ1-40的方法相类似[34-35]。本研究结果还表明,GPs灌胃可显著地缓解AD大鼠海马的氧化应激状态。鉴于氧化应激与AD的关系,上述氧化应激状态的缓解可能与AD大鼠其他症状的改善存在着一定程度的因果关系。
3 结论
本研究采用腹腔注射D-gal及AlCl3诱导SD大鼠建立AD模型,检测GPs对大鼠认知功能的保护作用并探讨其可能机制。结果显示,GPs可明显改善D-gal及AlCl3诱导的大鼠认知功能障碍及海马CA1区病理改变,而该作用可能与GPs提高抗氧化酶活性、缓解氧化应激状态有关,其具体机制仍有待从相关信号通路的角度深入研究。

