雪松松针乙醇提取物的抗氧化活性及构效关系研究
徐乾达,周志强,何 强,孙 群,曾维才,,*
(1.四川大学食品工程系,四川成都 610065;2.四川大学食品科学与技术四川省高校重点实验室,四川成都 610065;3.四川大学生命科学学院,四川成都 610065)
雪松(Cedrusdeodara)又名喜马拉雅松,是一种松科(Pinaceae)松属(Pinus)的常绿乔木,广泛分布于我国北方地区及长江流域,其叶外形似针,故称“松针”。传统中医认为,雪松松针性温,轻身益气,主风湿疮,生毛发,安五脏[1]。现代科学研究表明,雪松松针中含有丰富的活性多酚、生物黄酮、挥发油等活性成分,具有镇痛、解痉、抗菌、抗炎、抗癌等临床药理作用[2]。随着人们对其食用价值的认识,雪松松针已被陆续开发为茶、饮料和保健酒等产品,在食品加工领域展现出广阔的开发和利用前景。
氧化应激状态下,生物体内会产生和蓄积大量的自由基[3],过量的自由基会引起细胞膜脂质、细胞蛋白及DNA的氧化损伤,从而破坏细胞及组织器官,导致和加速机体衰老并诱发各种慢性疾病[4]。在实际应用中,虽然化学合成的抗氧化剂具有明显的抗氧化作用,但因其对人体潜在的毒性和危害而逐渐在食品中被限制使用[5],而从天然原料中制取安全、高效的天然抗氧化剂则开始成为食品及相关领域的研究热点。
国内外相关工作者研究了雪松松针不同有机溶剂提取物的组成,也对其抗褐变作用等与抗氧化活性有关的生物活性进行了测定[1,6-7],研究发现,萜类、多酚类、苯丙素类、有机酸类和多糖类等化合物是雪松松针的主要成分,其中以多酚类化合物为代表的生物活性物质是雪松松针发挥抗氧化功能的主要成分。上述研究及应用方向主要集中在生物和医药领域,所使用的萃取溶剂也大多为正丁醇和石油醚等毒性较大的有机溶剂,这类溶剂在食品工业中并不允许使用。在少数使用乙醇进行提取的实验中,石晓峰等[8]将雪松松针进行提取(95%乙醇)和纯化,并测定了纯化前后提取物清除ABTS和DPPH自由基的能力。结果发现,自由基清除能力的大小依次为:抗坏血酸>经过纯化的松针提取物>BHT>未经纯化的松针提取物。现有研究并未找到松针乙醇提取物中具有抗氧化活性的物质基础,也未能阐明提取物具有抗氧化能力的内在机理。
本文研究雪松松针乙醇提取物的体外抗氧化活性,并进一步对其主要成分和构效关系进行初步分析,为雪松松针资源在食品加工与贮藏领域的开发与利用提供实验基础与理论指导。
1 材料与方法
1.1 材料与仪器
雪松松针 采集于四川大学校园内,蒸馏水洗净,55 ℃烘干8 h后粉碎为粉末,备用;ABTS(2,2′-azinobis-3-ethylbenzthiazoline-6-sulphonate,2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)、DPPH(1,1-diphenyl-2-picrylhydrazine,1,1-二苯基-2-三硝基苯肼)、Folin-Ciocalteu试剂 上海阿拉丁生化科技股份有限公司;丁基羟基茴香醚(BHA)、无水乙醇、铁氰化钾、三氯乙酸、三氯化铁、硫酸亚铁、过氧化氢、水杨酸等其他化学试剂 均为国产分析纯,购于成都科龙化工试剂厂;实验用水 为蒸馏水;色谱分析用水 为超纯水。
ESJ210-4A型电子天平 沈阳龙腾电子有限公司;UV-2000型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;DHP-9082型电热恒温培养箱 上海一恒科技有限公司;RV 10 型旋转蒸发仪 德国IKA公司;LCJ-30F型冷冻干燥机 北京松源华兴科技发展有限公司;Milli-Q Element超低元素型超纯水系统 上海晶仪科学仪器有限公司;DZ-400/2E型真空包装机 上海祥正机械有限公司;安捷伦1290型高效液相色谱-质谱联用系统 美国安捷伦公司;AV II 600 MHz 核磁共振分析仪 瑞士Bruker公司。
1.2 实验方法
1.2.1 雪松松针乙醇提取物的制备 在预实验的基础上并结合相关参考文献[9]确定了雪松松针乙醇提取物的制备方法。取雪松松针干粉539.2 g,加入4000 mL乙醇溶液(75%,V/V),25 ℃搅拌浸提15 h,减压抽滤得到提取液,将提取液于45 ℃真空浓缩,取浓缩后得到的上清液于-60 ℃冷冻干燥36 h,得松针乙醇提取物83.2 g(该条件下提取率为15.4%),所得提取物于-20 ℃真空干燥保存,备用。
1.2.2 ABTS自由基清除实验 ABTS自由基工作液的配制方法参照文献[10],取0.1 mL不同浓度(0.1~1.6 mg/mL)的松针乙醇提取物溶液与3.9 mL ABTS自由基工作液混合,25 ℃条件下孵育6 min,于波长734 nm处测量反应混合溶液的吸光度,用蒸馏水替代提取物溶液作空白对照,BHA作阳性对照,计算松针乙醇提取物对ABTS自由基的清除能力。
式中:A1为实验组的吸光度;A0为空白组的吸光度。
1.2.3 DPPH自由基清除实验 DPPH自由基工作液的配制方法参照文献[10],取2.0 mL不同浓度(5~80 μg/mL)的松针乙醇提取物溶液与2.0 mL DPPH工作液混合,25 ℃避光孵育30 min,于波长517 nm处测定反应混合溶液的吸光度,用95%乙醇替代提取物溶液作空白对照,BHA作阳性对照,计算松针乙醇提取物对DPPH自由基的清除能力。
式中:A1为实验组的吸光度;A0为空白组的吸光度。
1.2.4 羟自由基清除实验 取1 mL不同浓度的松针乙醇提取物溶液(0.4~2.4 mg/mL),与1 mL硫酸亚铁溶液(3 mmol/L)和1 mL过氧化氢溶液(3 mmol/L)混匀,37 ℃孵育10 min,加入1 mL水杨酸,37 ℃反应30 min,于波长510 nm处测定反应混合溶液的吸光度[10],用蒸馏水替代提取物溶液作空白对照,BHA作阳性对照,计算松针乙醇提取物对羟自由基的清除能力。
式中:A1为实验组的吸光度;A0为空白组的吸光度。
1.2.5 过氧化氢清除实验 取4 mL不同浓度的松针乙醇提取物样品液(20~100 μg/mL)与6 mL过氧化氢溶液(40 mmol/L,用0.1 mol/L、pH7.4的磷酸盐缓冲液配制)混匀,于波长230 nm处快速测定混合溶液的吸光度、提取物样品液的吸光度,用蒸馏水作空白对照[11],BHA作阳性对照。
式中:A2为实验组的吸光度;A1为样品组的吸光度;A0为空白组的吸光度。
1.2.6 脂质过氧化抑制能力测定 以10%(V/V)的鸭蛋黄匀浆作为脂质媒介进行实验。取0.3 mL不同浓度的松针乙醇提取物溶液(1~16 mg/mL)与1.2 mL鸭蛋黄匀浆和50 μL硫酸亚铁溶液(70 mmol/L)充分混匀,37 ℃孵育30 min,加入1.5 mL的乙酸溶液(20%,V/V)和1.5 mL硫代巴比妥酸溶液(0.8%,m/V,用1.1%十二烷基硫酸钠溶液配制),振荡混匀,95 ℃水浴反应60 min,迅速冷却,加入5 mL正丁醇,4000 r/min离心8 min,于波长532 nm处测定上清液的吸光度[10]。用蒸馏水替代提取物溶液作空白对照,BHA作阳性对照,计算松针乙醇提取物对脂质过氧化的抑制率。
式中:A1为实验组的吸光度;A0为空白组的吸光度。
1.2.7 铁离子还原能力测定 取2.5 mL不同浓度的松针乙醇提取物溶液(50~800 μg/mL)与2.5 mL磷酸盐缓冲溶液(pH6.6)和2.5 mL铁氰化钾溶液(1%,w/V)混匀,50 ℃孵育20 min,迅速冷却,加入2.5 mL三氯乙酸溶液(10%,w/V),5000 r/min离心10 min,取2.5 mL上清液,加入2.5 mL蒸馏水和0.5 mL 三氯化铁溶液(0.1%,w/V),测定反应溶液于波长700 nm处的吸光度[10],以溶液吸光度值的大小表征样品的还原能力,吸光度值越大,表示样品的还原能力越强,BHA作阳性对照。
1.2.8 总酚含量的测定 分别吸取0.1 mL不同浓度(0.1、0.2、0.3、0.4、0.5、0.6 mg/mL)的没食子酸标准溶液与8.0 mL碳酸钠溶液(7.5%,w/V)混合,加入0.9 mL用蒸馏水对倍稀释的Folin-ciocalteu试剂,45 ℃反应30 min,于波长760 nm处测定反应混合液的吸光度,绘制总酚含量测定标准曲线,建立总酚含量(x)与吸光度(y)之间的线性回归方程:y=1.7141x+0.0156,R2=0.9987。取浓度为8 mg/mL的松针乙醇提取物溶液0.1 mL替代没食子酸标准溶液,按照上述步骤进行反应,将所测吸光度值代入回归方程,计算得到松针乙醇提取物的总酚含量[12]。
1.2.9 总黄酮含量的测定 分别吸取0.1 mL不同浓度(0.1、0.2、0.4、0.6、0.8、1.0 mg/mL)的芦丁标准溶液与0.1 mL亚硝酸钠溶液(5%,w/V)和2.0 mL 蒸馏水混合,25 ℃孵育6 min,加入0.2 mL三氯化铝溶液(10%,w/V)及0.6 mL蒸馏水,混匀,25 ℃反应5 min,于波长420 nm处测定混合液的吸光度,绘制总黄酮含量测定标准曲线,建立总黄酮含量(x)与吸光度(y)之间的线性回归方程:y=0.5776x-0.0019,R2=0.9996。取浓度为8 mg/mL的松针乙醇提取物溶液0.1 mL 替代芦丁标准溶液,按照上述步骤进行反应,将所测吸光度值代入回归方程,计算得到松针乙醇提取物的总黄酮含量[13]。
1.2.10 高效液相色谱-质谱联用分析 色谱条件:色谱柱:ODS-3反相柱(Inertsil PREP-ODS-3,4.6×250 mm i.d.,5 μm,日本GL-Science公司);流动相:A相为甲醇,B相为含0.1%甲酸的超纯水;洗脱程序:0~20 min,0~50% A;20~25 min,50%~60% A;25~30 min,60%~70% A;30~35 min,70%~80% A;35~40 min,80%~90% A;40~45 min,90%~100% A;45~60 min,100% A;检测波长:320 nm;参比波长:360 nm;柱温:25 ℃;进样量:20 μL;样品浓度:10 mg/mL(超纯水作溶剂,0.45 μm滤膜过滤)。
质谱条件:扫描范围50~1200 m/z;毛细管电压140 V;干燥气流速1 L/min;干燥温度200 ℃;雾化气压力14 psi;离子化方式ESI(-)。
1.2.11 核磁共振分析 取经HPLC分离和制备得到的各主要洗脱峰物质2 mg,经重水(D2O)交换和氘代甲醇(CD3OD)溶解,置于核磁管内用于核磁共振(1H-NMR,400 MHz;13C-NMR,100 MHz)分析。
1.3 数据处理
每组实验重复三次,结果以“平均值±标准差”的形式表示。实验结果用SPSS 20.0(Version 20.0 for Windows,SPSS Inc.,CO,USA)进行统计分析,显著性差异P<0.05。
2 结果与分析
2.1 雪松松针乙醇提取物对ABTS自由基的清除作用
ABTS是一类商业化生产的氮族自由基,能准确测定多成分混合物的抗氧化能力,无需复杂的反应步骤及苛刻的反应条件,被广泛用于天然产物抗氧化活性的测定[14]。雪松松针乙醇提取物对ABTS自由基清除的清除作用如图1所示。
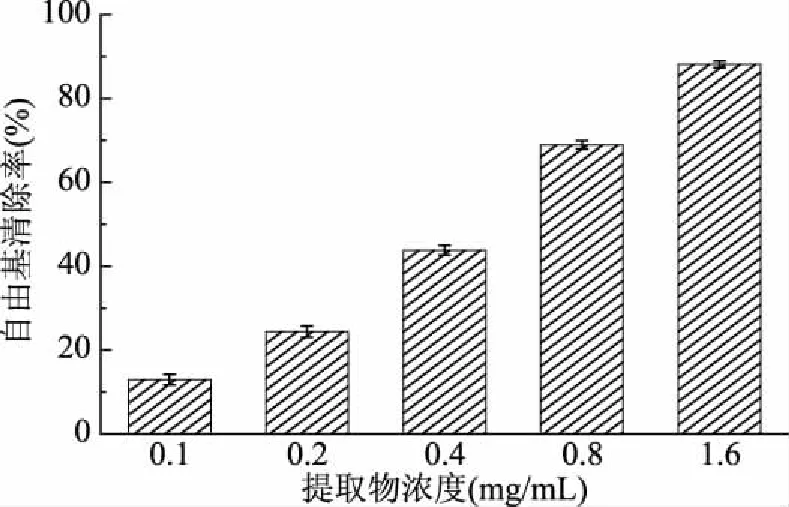
图1 松针乙醇提取物的ABTS自由基清除能力
由图1可知,随着受试浓度的增加(0.1~1.6 mg/mL),提取物对ABTS自由基的清除能力逐渐增大(12.94%~88.18%),展现出良好的剂量-效应关系,其半数有效浓度(Half effective concentration,EC50)值为(0.48±0.01) mg/mL(阳性对照BHA的EC50值为5.31±0.42 mg/mL)。
2.2 雪松松针乙醇提取物对DPPH自由基的清除作用
DPPH也是一种商业化生产的氮族自由基,与其他自由基反应体系相比较,其性质较为稳定,灵敏度高,受环境影响小,实验方法简单且结果重复性好,是评价天然产物抗氧化活性的一种常用方法[14]。雪松松针乙醇提取物对DPPH自由基的清除作用如图2所示。
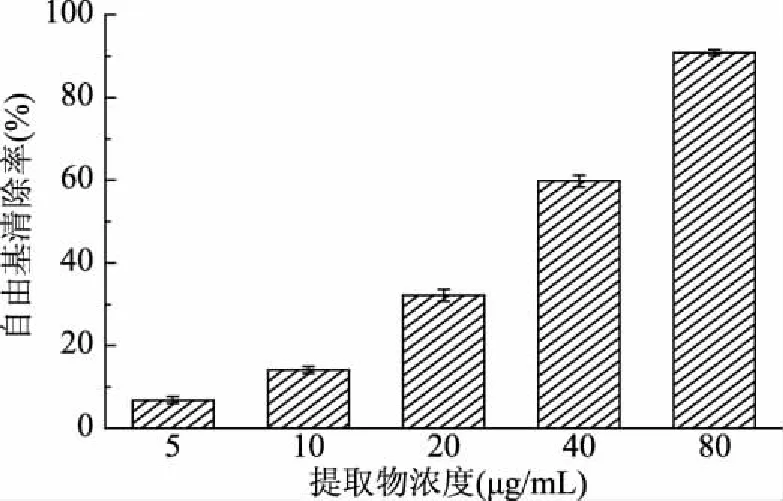
图2 松针乙醇提取物的DPPH自由基清除能力
由图2可知,在受试浓度范围内(5~80 μg/mL),雪松松针乙醇提取物对DPPH自由基具有显著的清除作用,且随提取物浓度的增大而增大(6.86%~90.91%),具有良好的剂量-效应关系。提取物对DPPH自由基清除作用的EC50值为(32.40±0.76) μg/mL,明显低于阳性对照BHA的EC50值(4.86±0.49) mg/mL。
2.3 雪松松针乙醇提取物对羟自由基的清除作用
羟自由基是氧气单质的三电子还原产物,反应活性强,具有很高的电子还原电势(2310 mV),为生物体内最强的氧化剂,能与生物细胞内的大部分物质发生氧化还原反应,造成细胞内生化代谢紊乱,引发组织的氧化损伤,加速器官的病变与机体衰老,对人体健康危害极大[15]。通过Fenton反应产生羟自由基,进而观察雪松松针乙醇提取物对羟自由基的清除作用,结果如图3所示。
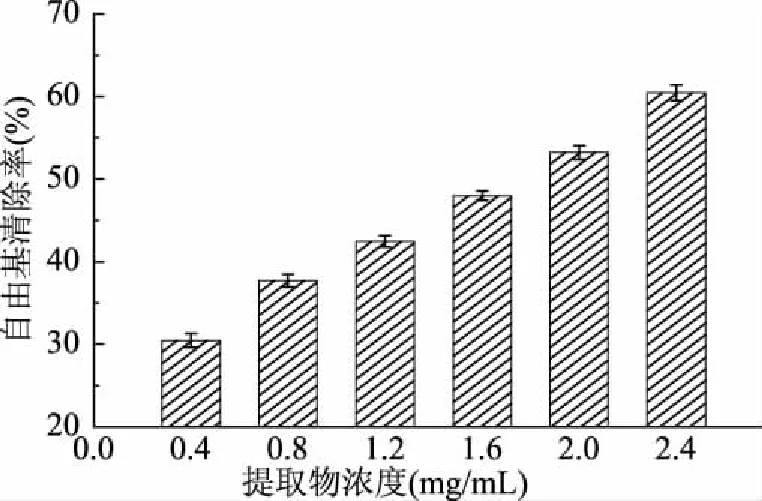
图3 松针乙醇提取物的羟自由基清除能力
由图3可知,在0.4~2.4 mg/mL的受试浓度范围内,雪松松针乙醇提取物对羟自由基展现出良好的清除作用,且符合剂量-效应关系。其对羟自由基清除作用的EC50值为(1.73±0.01) mg/mL,低于阳性对照BHA的EC50值(3.23±0.01) mg/mL。
2.4 雪松松针乙醇提取物对过氧化氢的清除作用
过氧化氢是人体新陈代谢过程中产生的中间产物,当机体处于氧化应激状态时,过量的过氧化氢会蓄积在细胞内造成机体的氧化损伤。同时,其也会进一步在酶的作用下生成羟自由基,加剧对细胞和组织的氧化损伤[16]。松针乙醇提取物的过氧化氢清除能力如图4所示。
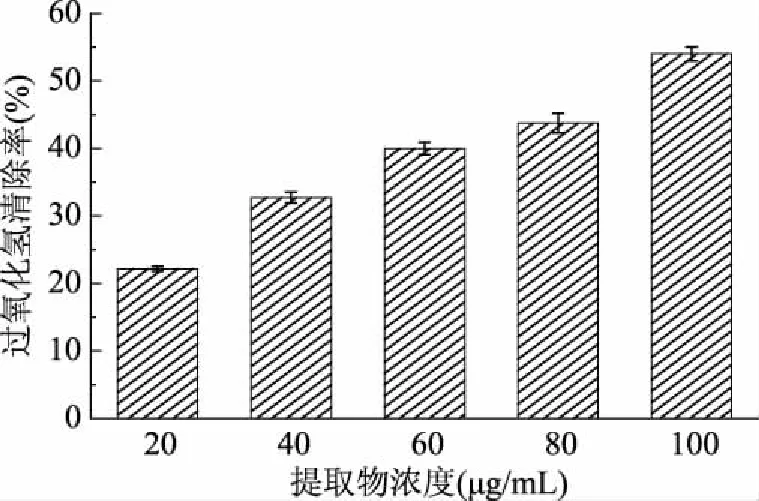
图4 松针乙醇提取物的过氧化氢清除能力
由图4可知,在20~100 μg/mL的受试浓度范围内,雪松松针乙醇提取物能较好地清除实验体系中的过氧化氢,清除率在22.16%~54.00%的范围内,显示出良好的剂量-效应关系。其对过氧化氢清除作用的EC50值为(89.48±0.54) μg/mL,低于阳性对照BHA的EC50值(123.66±0.56 μg/mL)。
2.5 雪松松针乙醇提取物的脂质过氧化抑制能力
脂质过氧化是一类典型的自由基链式反应,为多不饱和脂肪酸在氧气作用下逐步发生的一种氧化变质现象。在生物体内发生的脂质过氧化反应会产生大量的有毒物质,如过氧化物和丙二醛等,引起生物膜的功能缺失,诱发细胞的氧化损伤,导致组织、器官的氧化病变,对人体健康产生负面影响[17]。雪松松针乙醇提取物对脂质过氧化的抑制能力如图5所示。
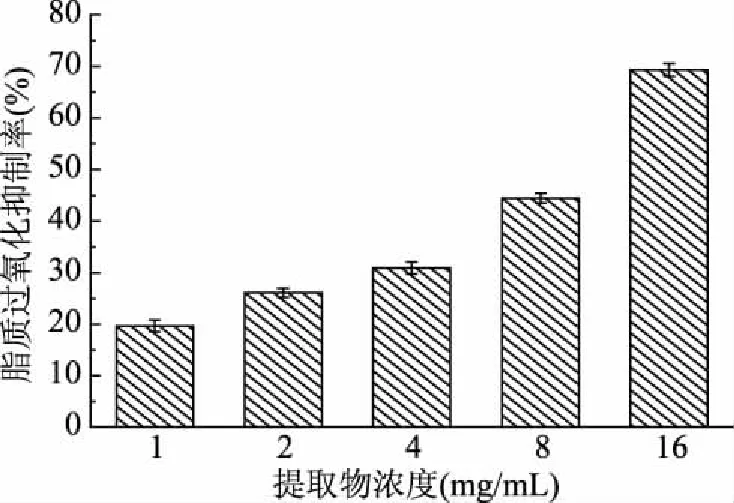
图5 松针乙醇提取物对脂质过氧化的抑制作用
由图5可知,雪松松针乙醇提取物对实验体系中的脂质过氧化反应有明显的抑制作用,随提取物受试浓度的增加(1~16 mg/mL),脂质过氧化的抑制率也逐渐增大(19.66%~69.31%),其EC50值为(9.85±0.14) mg/mL(阳性对照BHA的EC50为7.36±0.51 mg/mL)。
综上,雪松松针乙醇提取物能有效地清除供试反应体系中的自由基和活性氧,并对卵黄磷脂源引发的脂质过氧化有显著的抑制作用,展现出良好的体外抗氧化活性。为了进一步剖析其抗氧化作用机理,实验对提取物的还原能力进行了测定。
2.6 雪松松针乙醇提取物的还原能力
物质还原能力的强弱既是其抗氧化活性的重要表现,也是对其抗氧化作用进行合理分析与解释的重要方面[18]。松针乙醇提取物的还原能力如图6所示。
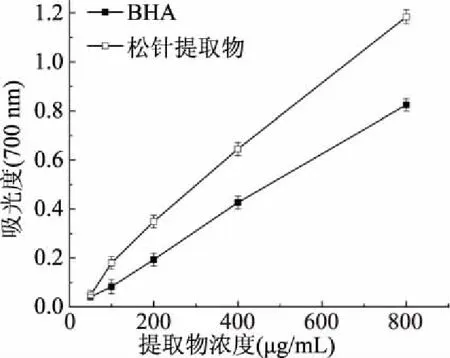
图6 松针乙醇提取物的还原能力
由图6可知,随提取物浓度的增大,反应体系的吸光度逐渐增强,且在相同浓度条件下,实验组的吸光度均高于阳性对照BHA组的吸光度,说明雪松松针乙醇提取物具有比BHA更加优良的还原能力。研究表明,还原能力是指物质在反应中失去电子的能力,物质发挥其抗氧化作用是通过自身的还原作用,在反应中给出电子而清除自由基,故物质的还原能力越强,其抗氧化作用越强。
为了从物质成分的角度探讨和剖析雪松松针乙醇提取物优良的体外抗氧化作用和还原能力,实验进一步测定了提取物中抗氧化成分酚类及黄酮类化合物的总量。
2.7 松针乙醇提取物的总酚和总黄酮含量
多酚类化合物和黄酮类化合物是植物中天然存在的次生代谢物,广泛存在于茶、酒、水果、蔬菜或其他植物性饮食来源中[19],能够通过多种途径清除多种体内外存在的自由基,从而发挥良好的抗氧化能力[20],酚类物质含量的多少决定了提取物抗氧化能力的强弱[21]。
松针乙醇提取物的中总酚含量为(40.30±2.13) mg没食子酸当量/g提取物,总黄酮含量为(56.62±1.53) mg芦丁当量/g提取物。结果表明,松针乙醇提取物的总酚和总黄酮含量较高,可能为其发挥抗氧化活性提供良好的物质基础。
单一植物中往往含有种类繁多的酚类化合物,不同种类的酚类化合物之间存在稳定性和反应活性的差异,且相互作用方式也各不相同,这些因素最终会对提取物的抗氧化活性产生较大的影响[22-23]。为了从活性物质组成方面系统探究和揭示雪松松针乙醇提取物优良的抗氧化活性,实验通过HPLC-MS及NMR技术对提取物中的主要化合物进行了鉴定,并进一步分析和讨论了其发挥抗氧化作用的构效关系,进而对其抗氧化作用机理进行研究。
2.8 雪松松针乙醇提取物主要成分的鉴定及构效关系分析
通过高效液相色谱-质谱联用(HPLC-MS)及核磁共振(1H-NMR、13C-NMR)的分离纯化与结构鉴定,从雪松松针乙醇提取物中鉴定出六种主要的成分,结果如图7所示。
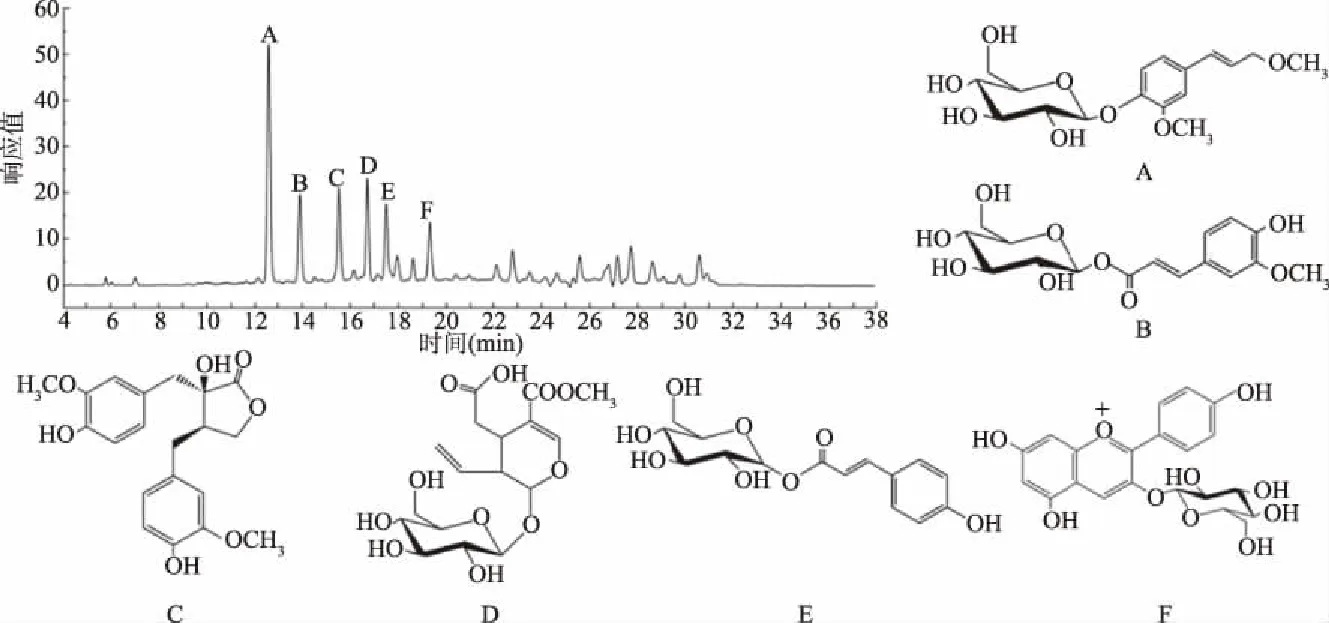
图7 雪松松针乙醇提取物的主要成分的分离及鉴定结果
提取物中六种主要成分的色谱分析数据具体如下:
洗脱峰A对应的化合物:ESI-MS准分子离子峰m/z:355.1[M-H]-。1H-NMR(CD3OD,400 MHz)δ:7.06(1H,d,J=8.4 Hz,H-5),7.02(1H,d,J=1.2 Hz,H-2),6.97(1H,dd,J=8.4,1.2 Hz,H-6),6.56(1H,d,J=14.4 Hz,H-7),6.38(1H,dt,J=14.4 Hz,5.2 Hz,H-8),4.81(1H,d,J=7.2 Hz,H-1′),4.27(2H,d,J=5.2 Hz,H-9),3.81(3H,s,-OCH3),3.48(3H,s,H-11),3.31~3.95(6H,m,H2′-6′);13C-NMR(CD3OD,100 MHz)δ:134.69(C-1),112.83(C-2),151.65(C-3),148.79(C-4),18.67(C-5),122.97(C-6),132.15(C-7),128.47(C-8),66.89(C-9),152.64(C-11),103.71(C-1′),76.86(C-2′),78.37(C-3′),72.59(C-4′),79.31(C-5′),63.24(C-6′),56.78(-OCH3)。由以上波谱分析数据得到化合物的分子式为C17H24O8,与相关文献报道基本一致[24],故鉴定该化合物为甲基松柏苷(Methylconiferin)。
洗脱峰B对应的化合物:ESI-MS准分子离子峰m/z:355.1[M-H]-。1H-NMR(CD3OD,400 MHz)δ:7.71(1H,d,J=15.7 Hz,H-7),7.46(1H,d,J=1.6 Hz,H-2),7.21(1H,dd,J=8.3,1.6 Hz,H-6),7.15(1H,d,J=8.3 Hz,H-5),6.57(1H,d,J=15.6 Hz,H-8),5.18(1H,d,J=7.3 Hz,H-1′),3.89(3H,s,3-OCH3),3.52(1H,dd,J=4.2,3.3 Hz,H-6′),3.44(1H,dd,J=4.1,1.7 Hz,H-6′),3.16~3.39(4H,m,H2′-5′);13C-NMR(CD3OD,100 MHz)δ:131.29(C-1),114.71(C-2),152.28(C-3),151.49(C-4),117.79(C-5),121.36(C-6),145.27(C-7),116.54(C-8),172.61(C-9),103.13(C-1′),76.46(C-2′),79.35(C-3′),73.55(C-4′),77.41(C-5′),64.62(C-6′),56.53(-OCH3)。由以上波谱分析数据得到化合物的分子式为C16H20O9,与相关文献报道基本一致[24],故鉴定该化合物为阿魏酸-β-D-吡喃葡萄糖苷(Ferulic acid-β-D-glucoside)。
洗脱峰C对应的化合物:ESI-MS准分子离子峰m/z:373.1[M-H]-。1H-NMR(CD3OD,400 MHz)δ:8.91(1H,br s,4-OH),8.77(1H,br s,4′-OH),6.81(1H,d,J=1.7 Hz,H-2),6.70(1H,d,J=8.2 Hz,H-5),6.66(1H,d,J=1.9 Hz,H-5′),6.63(1H,d,J=7.86 Hz,H-2′),6.57(1H,dd,J=1.65,8.2 Hz,H-6),6.53(1H,dd,J=1.7,7.89 Hz,H-6′),6.27(1H,s,8′-OH),3.97(1H,d,J=8.81 Hz,H-9),3.92(1H,d,J=8.6 Hz,H-9′),3.75(3H,s,-OCH3),2.97(1H,d,J=13.61 Hz,H-7),2.62(1H,dd,J=2.63,12.05 Hz,H-7′),2.34(1H,m,H-8);13C-NMR(CD3OD,100 MHz)δ:179.1(C-9),146.9(C-4′),147.1(C-4),145.5(C-3′),144.8(C-3),130.6(C-1′),128.3(C-1),123.7(C-6),121.1(C-6′),115.8(C-5′),115.4(C-5),114.7(C-2),113.2(C-2′),76.1(C-8),70.5(C-9),55.8(-OCH3),55.3(-OCH3),43.2(C-8′),40.5(C-7),30.4(C-7′)。由以上波谱分析数据得到化合物的分子式为C20H22O7,与相关文献报道基本一致[25],故鉴定该化合物为荛花酚(Wikstromol)。
洗脱峰D对应的化合物:ESI-MS给出准分子离子峰m/z:403.1[M-H]-。1H-NMR(CD3OD,400 MHz)δ:7.35(1H,s,H-3),5.53(1H,m,H-8),5.35(1H,d,J=4.1 Hz,H-1),5.18(1H,s,H-10a),5.05(1H,m,H-10b),4.57(1H,d,J=8.5 Hz,H-1′),3.55(3H,s,-OCH3),3.11(1H,m,H-5),2.76(1H,dd,J=17.01,5.2 Hz,H-6a),2.71(1H,m,H-9),2.13(1H,dd,J=16.6,9.2 Hz,H-6b);13C-NMR(CD3OD,100 MHz)δ:175.8(C-7),167.5(C-11),154.1(C-3),135.6(C-8),121.2(C-10),110.6(C-4),99.6(C-1′),98.2(C-1),78.4(C-3′),78.2(C-5′),75.1(C-2′),71.5(C-4′),63.1(C-6′),51.4(-OCH3),44.9(C-9),35.7(C-6),28.9(C-5)。由以上波谱分析数据得到化合物的分子式为C17H24O11,与相关文献报道基本一致[26],故鉴定化合物D为断氧化马钱苷(Secoxyloganin)。
洗脱峰E所对应的化合物:ESI-MS给出准分子离子峰m/z:325.1[M-H]-。1H-NMR(CD3OD,400 MHz)δ:7.71(1H,d,J=16.5 Hz,H-3),7.56(2H,d,J=7.7 Hz,H-2′,6′),7.18(2H,d,J=7.9 Hz,H-3′,5′),6.35(1H,d,J=15.8 Hz,H-2),4.95(1H,d,J=4.9 Hz,H-1′),3.86(1H,dd,J=11.7,2.4 Hz,H-6″b),3.71(1H,dd,J=12.2,4.5 Hz,H-6″a),3.32-3.51(4H,m,H-2″,H-3″,H-4″,H-5″);13C-NMR(CD3OD,100 MHz)δ:171.1(C-1),161.1(C-4′),145.6(C-3),130.6(C-2′,6′),130.1(C-1′),117.8(C-3′,5′),117.2(C-2),102.6(C-1″),75.5(C-5″),77.6(C-3″),74.6(C-2″),72.2(C-4″),62.5(C-6″)。由以上波谱分析数据得到化合物的分子式为C15H18O8,与相关文献报道基本一致[27],故鉴定该化合物为(E)-1-O-对香豆酰-α-D-吡喃葡萄糖苷((E)-1-O-p-coumaroyl-α-D-glucopyranoside)。
洗脱峰F对应的化合物:ESI-MS给出准分子离子峰m/z:433.2[M-H]-。1H-NMR(CD3OD,400 MHz)δ:8.92(1H,s,H-4),8.55(2H,d,J=9.5 Hz,H-2′,6′),7.08(2H,d,J=9.8 Hz,H-3′,5′),6.85(1H,d,J=0.9 Hz,H-8),6.65(1H,d,J=1.2 Hz,H-6),5.23(1H,d,J=7.8 Hz,H-1 glc),3.79(1H,dd,J=2.5,12.7 Hz,H-6b glc),3.61(1H,dd,J=6.3,12.2 Hz,H-6a glc),3.58(1H,dd,J=7.9,9.5 Hz,H-2 glc),3.51(1H,ddd,J=2.1,6.3,9.7 Hz,H-5 glc),3.45(1H,dd,J=9.3,9.5 Hz,H-3 glc),3.32(1H,dd,J=9.3,9.6 Hz,H-4 glc);13C-NMR(CD3OD,100 MHz)δ:166.2(C-2),145.5(C-3),138.7(C-4),160.2(C-5),104.3(C-6),171.8(C-7),95.6(C-8),158.6(C-9),114.7(C-10),120.9(C-1′),136.5(C-2′),118.7(C-3′),170.5(C-4′),118.3(C-5′),136.8(C-6′),103.9(C-1 glc),76.2(C-2 glc),78.7(C-3 glc),72.5(C-4 glc),79.1(C-5 glc),63.2(C-6 glc)。由以上波谱分析数据得到化合物的分子式为C21H22O10,与相关文献报道基本一致[28],故鉴定该化合物为天竺葵素-3-O-葡萄糖苷(Pelargonidin-3-O-glucoside)。
根据相关研究可知,提取物主要成分中的荛花酚、(E)-1-O-对香豆酰-α-D-吡喃葡萄糖苷和天竺葵素-3-O-葡萄糖苷等酚类化合物具有较强的自由基清除作用,这可能是提取物展现出明显抗氧化作用的重要原因[25,27-28]。同时,从上述色谱分离与波谱鉴定结果可知,提取物主要成分的结构中均含有大量的酚羟基和甲氧基等酚类化合物的活性官能团,而上述官能团在氧化反应体系中具有良好的给出氢原子进而淬灭活泼自由基或活性氧的作用,为提取物发挥良好的抗氧化能力提供了结构方面的基础。相关研究表明,酚类化合物结构中的酚羟基等活性官能团可通过氢原子转移(Hydrogen atom transfer,HAT)或单电子转移(Single electron transfer,SET)的方式与途径实现酚类化合物在反应体系中对自由基的清除作用,进而发挥其良好的抗氧化活性[29]。同时,研究指出,酚类化合物苯环上的甲氧基对化合物基于HAT机制的抗氧化活性有显著的提高效应,可增强化合物与体系中活性氧的反应,降低整个体系的氧化态势[30]。其次,雪松松针乙醇提取物主要成分的结构中存在大量的苄基,根据前期基于密度泛函理论对不同酚类化合物前线分子轨道、分子静电势和电离势的研究,酚类物质结构中苄基的C-H键解离能低于O-H键的解离能,可使其在反应体系中能给出氢原子参与捕捉自由基,进而显著提升提取物的抗氧化活性[12,31]。再者,相关研究指出,植物提取物中不同多酚类物质在抗氧化反应中可能会出现协同效应,其结构中活性官能团的氢原子和电子转移能力可在相互作用中得到提升,进而增强提取物的抗氧化能力[32]。此外,雪松松针乙醇提取物的主要成分通过糖苷键与糖分子形成糖苷,使其水溶性及稳定性得到提高,也在一定程度上提升了酚类化合物结构中酚羟基与甲氧基的氢原子给予能力,从而对提取物抗氧化作用的发挥产生积极地影响[33]。
3 结论
雪松松针乙醇提取物含有丰富的活性多酚类化合物,具有良好的抗氧化作用;能有效清除自由基,抑制脂质过氧化,并展现出较强的还原能力;甲基松柏苷(A)、阿魏酸-β-D-吡喃葡萄糖苷(B)、荛花酚(C)、断氧化马钱苷(D)、(E)-1-O-对香豆酰-α-D-吡喃葡萄糖苷(E)和天竺葵素-3-O-葡萄糖苷(F)是提取物中主要的成分。化合物B、C、E、F中所含的酚羟基,化合物A、B、C、D所含的甲氧基,化合物A、B、C、E所含的苄基以及其它具有氢原子转移或单电子转移活性的基团,是雪松松针乙醇提取物发挥抗氧化活性的结构基础。研究工作为雪松松针在食品、医药和日化等领域的资源化利用提供了实验基础。

