小麦草叶绿素铜钠盐的制备及稳定性
张培旗,侯佩*,常志娟,纵伟*
郑州轻工业大学食品与生物工程学院(郑州 450002)
叶绿素是一种天然、安全,且具有一定生理功能的天然色素[1]。现代研究发现,叶绿素有重要的生理活性,如抗致突变、降解胆固醇、促进创伤愈合和改善便秘等作用[2]。但是,由于叶绿素的不稳定性,致使其难于在食品工业中应用。研究发现,铜离子取代叶绿素中镁离子制成叶绿素铜钠盐,不但可以增强化合物稳定性,而且仍具有与叶绿素类似的色泽和生理功能[3]。试验以小麦草为原料,探讨了小麦草叶绿素提取及制备叶绿素铜钠盐的生产工艺,为小麦草的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
小麦草由实验室培养。氢氧化钠、浓硫酸、硫酸铜、硫酸锌、硫酸钠、石油醚、丙酮、无水乙醇均为分析纯。
SP-2100可见分光光度计UV(上海光谱仪器有限公司);AL204电子天平(瑞士梅特勒-托利多公司);HH-S4数显恒温水浴锅(金坛市医疗仪器厂);DHG-9145A电热鼓风干燥箱(上海一恒科学仪器有限公司);TDZ5-WS湘仪离心机(长沙湘仪离心机仪器有限公司);SCIENTZ-10ND冷冻干燥机(宁波新芝生物科技股份有限公司)。
1.2 工艺流程
小麦草→预处理→有机溶剂浸提→浓缩皂化→萃取分离→酸化→铜代→过滤→成盐→干燥→成品
1.2.1 小麦草样品前处理
将新鲜小麦草用蒸馏水清洗干净,晾干。然后用剪刀剪碎置于冷冻干燥机内冷冻干燥14 h,用粉碎机粉碎过100目,粉碎后的小麦草放于棕色试剂瓶内避光保存备用。
1.2.2 浓缩皂化
将提取液水浴浓缩至原体积的1/2,浓缩不但可以减少萃取过程所用萃取剂的用量,而且有利于进一步生成叶绿素铜酸。浓缩后加入10%的氢氧化钠溶液调pH至11,然后水浴(60 ℃)加热,搅拌回流60 min,进行皂化反应。皂化情况可采用石油醚进行检验,如果加入2~3滴石油醚摇匀上层不呈现绿色,说明皂化完全;否则,要通过增加碱量并延长皂化时间使其彻底皂化。
1.2.3 萃取分离
将皂化液冷却移入分液漏斗中,加入一定体积石油醚,充分振荡2 min,静置分层。叶绿素盐皂化液主要集中在下层,萃取至醚层呈淡淡的黄色,一般萃取4~5次。
1.2.4 酸化制铜
向叶绿素皂化液中滴加稀硫酸调整pH 2~3,于60℃水浴加热,叶绿素充分酸化后变成黄褐色的脱镁叶绿酸。将酸化后的叶绿素提取液转入烧杯汇总,滴加10%硫酸铜水溶液,当溶液颜色整体由黄绿变为墨绿时,再多加3 mL硫酸铜溶液。在不断搅拌的条件下,使铜离子逐步取代叶绿素酸中的镁离子,然后置于60℃的水浴中回流60 min。所得叶绿素铜酸要用蒸馏水反复洗涤以除去水溶性杂质。
1.2.5 成盐
将上述叶绿素铜酸用丙酮溶解,加入10% NaOH溶液调节pH至12,在室温下搅拌反应60 min,静置,有墨绿色的叶绿素铜钠盐沉淀生成,过滤沉淀于60 ℃烘干,得到墨绿色有金属光泽的叶绿素铜钠盐粉末。
1.3 叶绿素含量的测定与计算
叶绿素a、叶绿素b分别于645和663 nm有两处吸收峰,用分光光度法测定叶绿素含量主要依据Arnon公式[4],其计算方法是:分别以提取溶剂作空白,测定叶绿素提取液吸光度A645和A663,根据式(1)~(3)计算叶绿素总含量。式中:A645和A663分别为样品稀释液在波长为645和663 nm时的吸光度;n为稀释倍数;V为样品溶液体积,mL;m为样品质量,g。
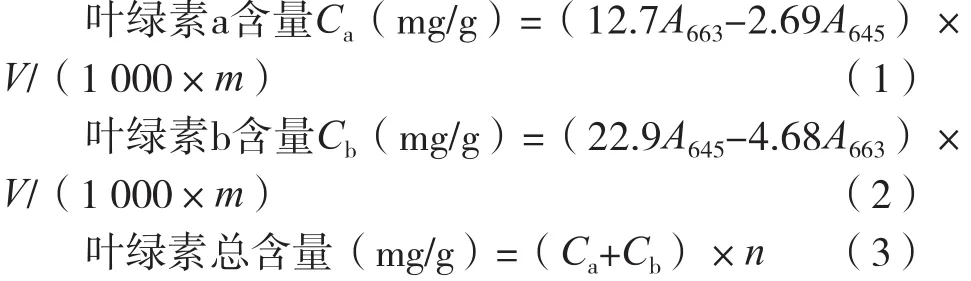
2 结果与讨论
2.1 叶绿素提取剂的选择
采用无水乙醇和丙酮,按体积比混合作为溶剂从小麦草粉中提取叶绿素,通过多次单因素试验和正交试验,对影响提取工艺的因素进行优化,确定叶绿素提取最佳工艺。精确称取5份2.00 g粉碎好的小麦草,分别加入30 mL不同溶剂的锥形瓶中,加盖,避光,室温提取2 h,离心。取1 mL提取液,用无水乙醇稀释定容到25 mL,在λmax=645 nm和λmax=663 nm处测定吸光度A,根据Aron公式计算叶绿素总含量,试验结果如图1所示。采用无水乙醇和丙酮混合溶剂比单一选用无水乙醇或丙酮溶剂有更好的提取效果,当无水乙醇和丙酮体积比2︰1时,提取效果最好,为1.808 1 mg/g。因此选取该混合试剂作为提取剂。
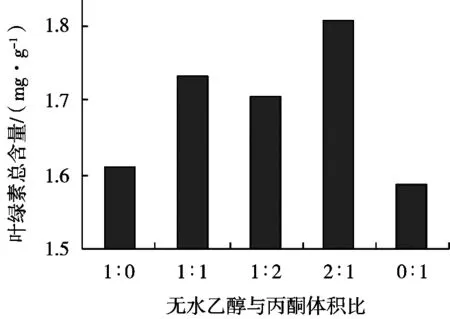
图1 叶绿素提取剂的选择
2.2 小麦草叶绿素提取的优化
2.2.1 料液比对麦草叶绿素提取的影响
料液比与叶绿素总含量的关系曲线如图2所示。随着料液比的增大,提取率逐渐增加,达到7倍的溶剂用量后,提取率趋于稳定。说明当料液比为1︰7(g/mL)时,叶绿素已得到充分提取。
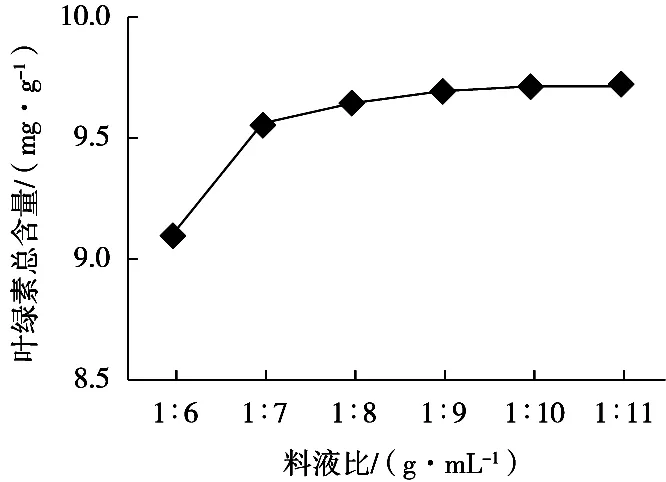
图2 料液比对提取叶绿素含量的影响
2.2.2 提取时间对麦草叶绿素提取的影响
提取时间与叶绿素总含量的关系曲线如图3所示。在3~5 h,随提取时间的延长,叶绿素的提取率逐渐升高;5 h后,叶绿素的提取率随时间延长而开始下降。这说明5 h后,麦草中叶绿素向提取溶剂的扩散已达到平衡;此外,叶绿素对热不稳定,加热一定时间后便开始分解,因此含量不断下降。
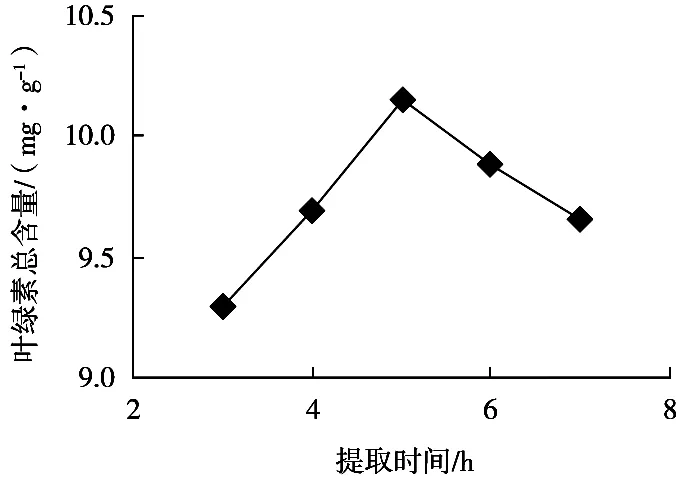
图3 时间对提取叶绿素含量的影响
2.2.3 温度对麦草叶绿素提取的影响
提取温度与叶绿素总含量的关系如图4所示。在20~50 ℃,麦草叶绿素提取率随着浸提温度的升高而升高;随后,随着浸提温度的升高,叶绿素提取率随温度增加呈下降趋势。这说明麦草叶绿素在高温(50℃)开始变得不稳定,容易分解。
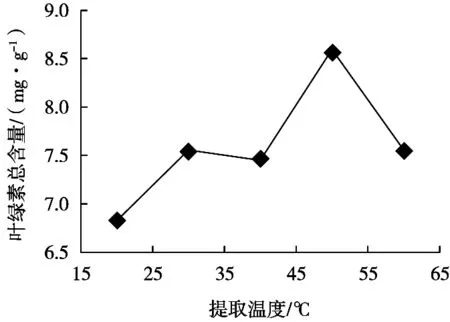
图4 温度对提取小麦草叶绿素含量的影响
2.2.4 叶绿素提取的正交试验结果及分析
提取时间、料液比和提取温度对小麦草叶绿素提取影响的正交试验结果见表1。各因素的主次顺序为C>A>B,各因素的最优水平组合为C3A1B3,即提取温度为60 ℃,提取时间4 h,料液比为1︰8(g/mL),此时提取效果最好。
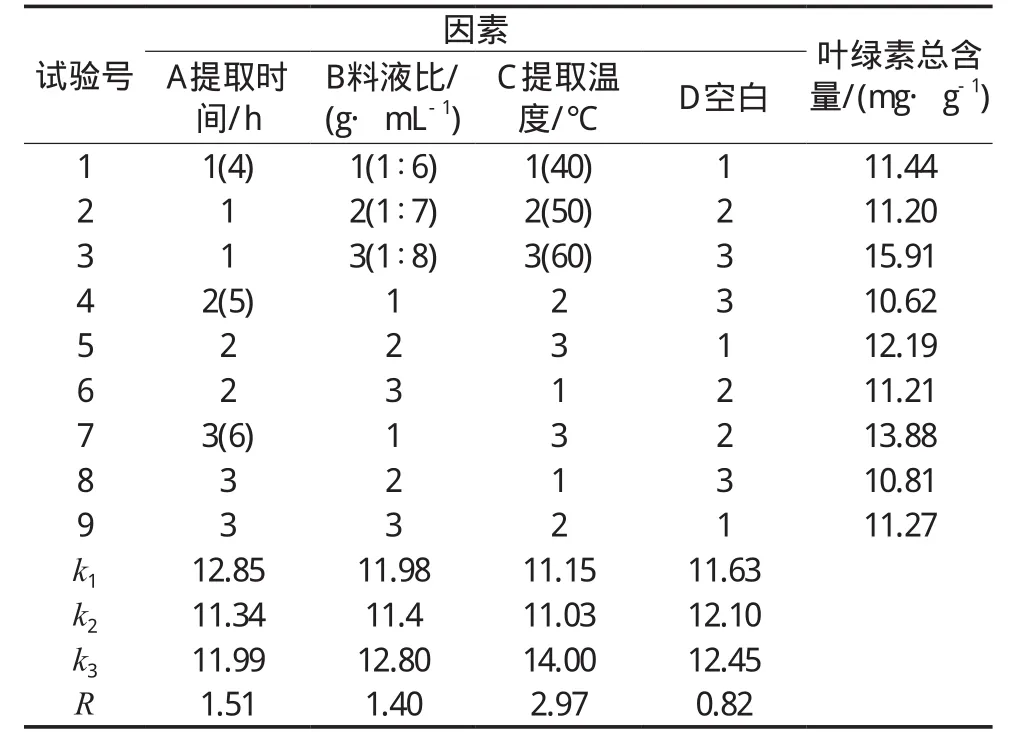
表1 正交设计试验结果和极差分析
2.3 叶绿素铜钠盐的稳定性
2.3.1 小麦草叶绿素铜钠盐吸收光谱曲线
取叶绿素铜钠盐,用150 mL蒸馏水溶解;吸取5 mL,用蒸馏水定容到50 mL容量瓶中。以蒸馏水作为空白对照,测叶绿素铜钠在340~690 nm范围内的吸光度。从图5可以看出,在406和628 nm处有吸收峰,这与向洪平等[5]的试验基本一致。同时可以确定叶绿素铜钠盐的最大吸收峰的波长为406 nm。

图5 叶绿素铜钠盐吸收光度谱图
2.3.2 温度对叶绿素铜钠盐稳定性的影响
叶绿素铜钠盐溶液在不同温度的水浴上保持5 min,吸光度(A406nm)的变化结果见图6。叶绿素铜钠盐溶液在80 ℃以下时,吸光度的变化不大,即稳定性较好;加热至80 ℃以上时,有轻微浑浊,吸光度急剧下降,说明此时叶绿素铜钠盐变得不稳定。
2.3.3 pH对叶绿素铜钠盐稳定性的影响
改变叶绿素铜钠盐水溶液pH后测定其A406nm,结果见图7。当pH 6~8时,吸光度最大,溶液颜色最深,说明叶绿素铜钠盐在中性介质附近是稳定的;当pH<6时,吸光度急剧下降,说明叶绿素铜钠盐在酸性介质中非常不稳定;当pH 8~12时,吸光度下降较少,说明叶绿素铜钠盐在碱性介质中相对稳定。
2.3.4 光线对叶绿素铜钠盐稳定性的影响
将一定浓度的铜钠盐放置于一个光照的地方,每天按时测定溶液的A406nm,结果见图8。随着光照时间的延长,溶液的吸光度逐渐下降。这说明光线可影响叶绿素铜钠盐的稳定性,应避光保存。

图6 温度对叶绿素铜钠盐稳定性的影响
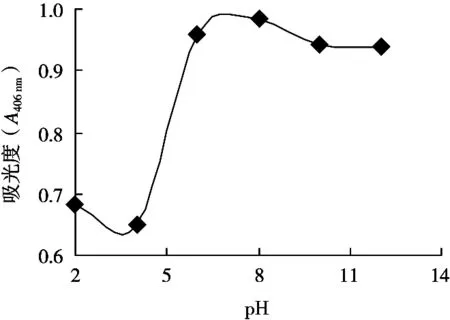
图7 pH对叶绿素铜钠盐稳定性的影响
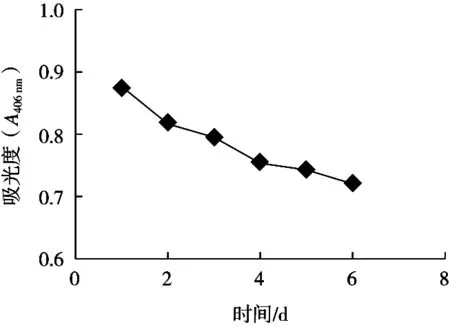
图8 光线对叶绿素铜钠盐稳定性的影响
3 结论与讨论
在无水乙醇与丙酮体积比为2︰1的情况下提取效果最好,单一有机溶剂提取率较低,说明在叶绿素提取过程中无水乙醇和丙酮有协同作用。小麦草叶绿素的最优提取工艺为:温度60 ℃,时间4 h,料液比1︰8(g/mL)。此时叶绿素含量最高,为15.91 mg/g。由试验可知,小麦草叶绿素含量高于苦瓜[6]、仙人掌[3]及绞股蓝[7]中提取的叶绿素含量,因此,小麦草可作为叶绿素提取的理想原料。叶绿素铜钠在温度低于80℃、pH 6~8的条件下是很稳定的,铜钠盐对光线的稳定性较差,应避光保存。

