镉胁迫对蛆症异蚤蝇幼虫体内脂质过氧化物含量及抗氧化酶活性的影响
褚梦颖,刘广纯
辽宁省城市有害生物治理与生态安全重点实验室;沈阳大学生命科学与工程学院,辽宁 沈阳 110044
镉(Cadmium,Cd)是严重危害人类健康的污染物,主要损伤肾脏、骨胳和呼吸系统[1]。具有较高的生物富集指数,并可以通过食物链危及人类健康[2,3]。镉的存在及潜在危害引起人们的广泛关注[4]。
镉进入昆虫体内引起一系列的生理生化反应。镉通过Ca2+通道穿过细胞膜进入机体,诱导产生大量自由基和活性氧(ROS),ROS 与体内脂质、蛋白质和核酸等生物大分子反应,导致脂质过氧化、细胞膜损伤,并影响多种酶活力,对生物体造成威胁[5]。家蚕五龄幼虫随着Cd2+处理浓度的升高,其脂肪体内丙二醛(MDA)含量增加,超氧化物歧化酶(SOD)、过氧化氢酶及谷胱甘肽过氧化物酶活性呈现规律性变化[6]。果蝇随着镉处理浓度的升高,体内MDA 的含量也随之升高,SOD 与CAT活性降低[7]。棕尾别麻蝇在镉的胁迫下,体内的SOD、CAT 酶活力均受到极显著影响[8]。镉的毒性作用与其能够诱导生物体产生氧化损伤密切相关,并且氧化损伤相关指标变化可以作为机体遭受镉等重金属胁迫的生物指示物[9,10]。
蛆症异蚤蝇Megaselia scalaris是世界广泛分布的腐食性蝇类,通过取食在体内聚集各种腐败物质,包括各种污染物,是较理想的检测污染物生物的实验动物[11,12]。我们前期研究表明,Cd2+对蛆症异蚤蝇幼虫生长、寿命、化蛹率及羽化率均有显著抑制。但对其体内生理生化过程的影响还未见报道。本研究通过测定在不同浓度Cd2+胁迫条件下,蛆症异蚤蝇幼虫体内的抗氧化酶活性及MDA 含量,研究其对昆虫生理生化过程的影响。
1 材料与方法
1.1 供试虫源
蛆症异蚤蝇M.scalaris为2008 年采于沈阳,并在沈阳大学城市有害生物综合治理与生态安全辽宁省重点实验室建立的种群。
1.2 试剂
本实验所用试剂,均购于国内试剂公司(表1)。

表1 实验所用试剂Table 1 The reagent used in the experiment
1.3 饲养方法
蛆症异蚤蝇幼虫采用酪蛋白琼脂培养基饲养,具体配比见表2。以空白组培养基饲养的蛆症异蚤蝇幼虫为对照组,以Cd2+浓度为7.5 μg/g,15 μg/g,30 μg/g 和60 μg/g 培养基饲养的蛆症异蚤蝇幼虫为实验组,每组设3 次重复。恒温培养箱温度24±1 ℃,相对湿度75%,光周期12 L:12 D。
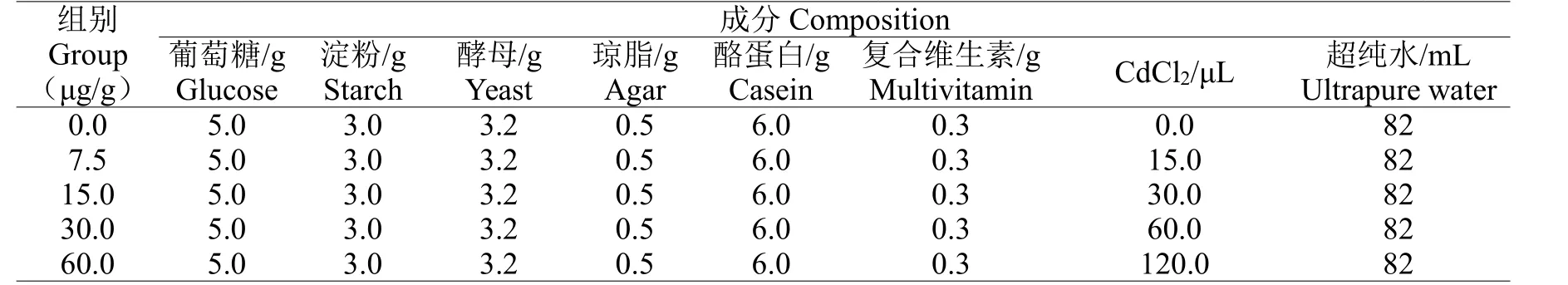
表2 不同实验组蛆症异蚤蝇幼虫培养基成分配比Table 2 The composition of culture medium for the larvae of Megaselia scalaris in different experimental groups
1.4 酶液提取
将供试蛆症异蚤蝇幼虫按照1:9(m/v)比例与预冷生理盐水(0.86%)混合加入到已灭菌的EP管中,冰浴条件下制备成10%的组织匀浆液,将其置于低温离心机中4 ℃、6000 r/min 离心10 min,取上清液置于0 ℃冰浴待测。
1.5 MDA 含量和酶活力测定
蛋白质含量的测定采用考马斯亮蓝比色法;MDA 含量测定采用硫代巴比妥酸(TBA)法:SOD活性的测定采用黄嘌呤氧化酶法;CAT 活性测定采用可见光法;GSH-PX 活性的测定采用5,5’-二硫代硝基苯甲酸(DTNB)显色法。本实验样品中MDA 和蛋白质含量以及SOD、CAT 和GSH-PX 酶活性均采用购自南京建成生物工程研究所的试剂盒测定。具体操作按说明书进行。
SOD 活性单位定义为1 mg 组织蛋白在1 mL 反应液中SOD 抑制率达50%时所对应的SOD 量为1 个活性单位。
CAT 活性单位定义为1 mg 组织蛋白1 s 分解1 μmol H2O2的量为1 个活性单位。
GSH-PX 活性单位定义为1 mg 组织蛋白1 min 扣除非酶促反应的作用,使反应体系中GSH 浓度降低1 μmol/L 为1 个酶活力单位。
1.6 数据处理
所得数据采用SPSS 22.0 软件进行One-way ANOVA 分析,Duncan 多重比较方法进行显著性分析,以P<0.05 作为差异显著性水平,P<0.01 作为差异极显著性水平。
2 结果与分析
2.1 Cd2+胁迫对蛆症异蚤蝇幼虫体内MDA 含量的影响
如图1 所示,在空白组(0 μg/g)下,随着时间的增加,MDA 含量具有一直上升的趋势,蛆症异蚤蝇幼虫体内MDA 含量通常为3.058~3.988 nmol/mg protein。当开始取食Cd2+后,无论是同一时间下,随着处理浓度的升高,还是相同浓度下,随着处理时间的增加,蛆症异蚤蝇幼虫体内的MDA含量均是上升趋势,上升了46.763~112.663%。其中在Cd2+处理浓度为60 μg/g,处理时间为5 d 时,MDA 含量升到最高为8.481 nmol/mg protein。在Cd2+处理浓度为7.5 μg/g,处理前期(1~2 d),幼虫体内MDA 含量与对照组无显著性差异(P>0.05),其余的处理浓度在各个处理时间测得体内的MDA 含量均与对照呈极显著性差异(P<0.01)。
2.2 Cd2+胁迫对蛆症异蚤蝇幼虫体内SOD 酶活性的影响
从图2 中观察发现,较低Cd2+处理浓度下(7.5 μg/g,15 μg/g,30 μg/g),随着处理时间的增加,体内SOD 酶活性的促进作用均呈现先上升后下降趋势,均在处理时间3 d 时活力最强,分别对应的酶活性值为82.555 nmol/mg protein,103.610 nmol/mg protein 和88.552 nmol/mg protein,而在高Cd2+处理浓度(60 μg/g)的处理前期(1~2 d),对蛆症异蚤蝇幼虫体内的SOD 酶活性起促进作用,并且在处理时间1 d 时达到最大,酶活性为81.880 nmol/mg protein,较对照组差异极显著(P<0.01),处理后期(3~5 d)对蛆症异蚤蝇幼虫体内的SOD 酶活性起抑制作用,并且在处理时间5 d 时,降到最低,酶活性为64.239 nmol/mg protein,较对照组差异极显著(P<0.01)。
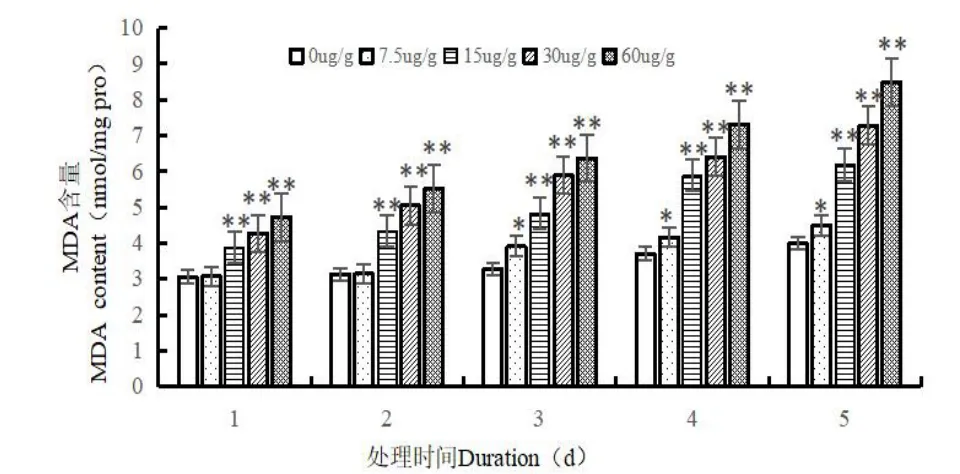
图1 Cd2+对蛆症异蚤蝇幼虫体内MDA 含量的影响Fig.1 Effect of Cd2+on MDA content in the larvare of Megaselia scalaris(Loew)

图2 Cd2+对蛆症异蚤蝇幼虫体内SOD 酶活性的影响Fig.2 Effect of Cd2+on SOD activity in the larvare of Megaselia scalaris(Loew)
2.3 Cd2+胁迫对蛆症异蚤蝇幼虫体内CAT 酶活性的影响
由图3 可以看出,不论同一处理时间下随着Cd2+处理浓度的升高,还是相同的Cd2+处理浓度下随着处理时间的增加,蛆症异蚤蝇幼虫体内的CAT 酶活性均是先升后降的趋势,在较低Cd2+处理浓度(7.5 μg/g,15 μg/g,30 μg/g)下,对蛆症异蚤蝇幼虫体内CAT 酶活性的影响与SOD 酶活性的影响大体相同,即均起到了促进作用,但不同的是在Cd2+处理浓度为60 μg/g,处理时间为5 d 时,对其CAT 酶活性起到了抑制作用,酶活性降至最低为6.561 nmol/mg protein,较对照组差异显著(P<0.05)。在较低Cd2+处理浓度(7.5 μg/g,15 μg/g,30 μg/g)下,蛆症异蚤蝇幼虫体内CAT 酶活性均在处理时间为3 d 时达到最大值,分别对应的CAT 酶活性值为8.933 nmol/mg protein,10.655 nmol/mg protein,9.667 nmol/mg protein,均较对照组差异显著(P<0.05),在高Cd2+处理浓度(60 μg/g)下,则在处理时间为4 d 时,CAT 酶活性达到最高,为8.840 nmol/mg protein,较对照组差异显著(P<0.05)。
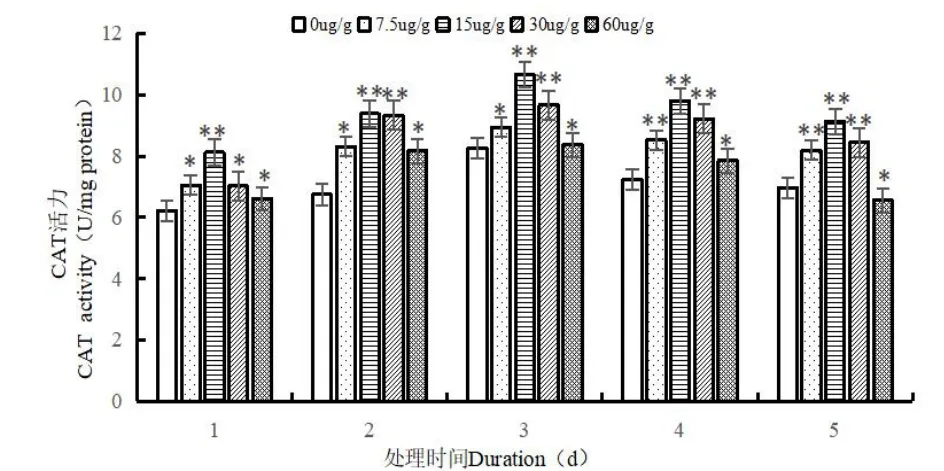
图3 Cd2+对蛆症异蚤蝇幼虫体内CAT 酶活性的影响Fig.3 Effect of Cd2+on CAT activity in the larvare of Megaselia scalaris(Loew)
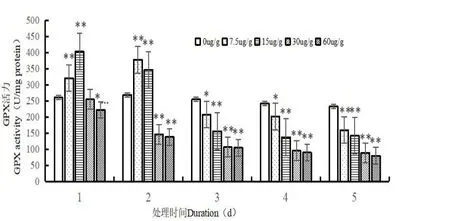
图4 Cd2+对蛆症异蚤蝇幼虫体内GSH-PX 酶活性的影响Fig.4 Effect of Cd2+on GSH-PXactivity in the larvare of Megaselia scalaris(Loew)
2.4 Cd2+胁迫对蛆症异蚤蝇幼虫体内GSH-PX 酶活性的影响
如图4 所示,在处理前期(1~2 d),较低Cd2+处理浓度(7.5 μg/g,15 μg/g)下,对蛆症异蚤蝇幼虫体内GSH-PX 酶活性起到显著促进作用,在处理后期(3~5 d),对幼虫体内GSH-PX 酶活性起到抑制作用,并且观察得到在Cd2+浓度为7.5 μg/g 时,随着处理时间的增加,幼虫体内GSH-PX酶活性呈现先升后降的趋势,在Cd2+处理浓度为15 μg/g,处理时间为1 d 时,幼虫体内GSH-PX 酶活性达到最高,为403.115 nmol/mg protein,较对照组差异极显著(P<0.01),在处理时间为3 d 时,GSH-PX 酶活性呈现极速下降趋势,下降了35.210~61.257%,随着处理时间的增加(4~5 d),幼虫体内GSH-PX 酶活性依旧呈现下降的趋势,但较为缓和。在高Cd2+处理浓度(30 μg/g,60 μg/g)下,不论是同一时间下随着处理浓度的升高,或是相同处理浓度下随着处理时间的增加,对蛆症异蚤蝇幼虫体内GSH-PX 酶活性均起到抑制作用,并且酶活性迅速下降,在Cd2+处理浓度为60 μg/g,处理时间为5 d 时,幼虫体内GSH-PX 酶活性达到最低,为80.803 nmol/mg protein,较对照组差异极显著(P<0.01)。
3 讨论
镉通过食物链可在昆虫体内积累[13-17],并对昆虫的生长发育产生一系列影响[18-20]。其对昆虫的主要毒性作用之一是产生氧化应激,即细胞膜脂质过氧化[21,22]。氧化应激诱导活性氧引起的细胞损伤。另一方面,昆虫体内SOD、CAT、GSH-PX 等酶系可以清除由于氧化应激产生的活性氧[23-26]。这些酶的活性随着活性氧数量的变化而有所差异[21,27-30]。
MDA 是细胞间发生脂质过氧化反应的产物,其含量直接反映产生的自由基[31-34]。本研究显示,随着Cd2+处理浓度的升高和处理时间的增加,蛆症异蚤蝇MDA 含量持续升高(图1),呈现一定的浓度依赖和时间依赖效应关系。表明蛆症异蚤蝇幼虫体内的脂质过氧化程度不断增加,尤其在3 种抗氧化酶受到抑制而活性降低时,体内大量ROS 无法及时清除,导致幼虫体内细胞膜损伤。这与其他的学者研究结果一致[9,35]。
CAT 与GSH-PX 作为过氧化氢清除酶,进一步催化由SOD 歧化反应的产物H2O2为无毒的H2O和,以防止机体受到损伤,其活性受H2O2浓度的直接调控[45]。不同Cd2+处理浓度对蛆症异蚤蝇幼虫体内氧化应激反应的CAT 活性(图3)与GSH-PX 活性(图4)表明,CAT 与SOD 具有相同的变化趋势。在较低Cd2+处理浓度(7.5 μg/g)的处理前期(1~2 d),GSH-PX 活性明显高于CAT,表明GSH-PX 更为灵敏,相对更早发挥消除H2O2作用。随着处理时间的增加及Cd2+处理浓度的升高,GSH-PX 无法及时清除机体内含量升高的H2O2,其活性受到抑制。而CAT 酶活性也有低浓度促进高浓度抑制现象,但变化比较平稳,在一定程度上与GSH-PX 有互补作用。这种呈现低浓度促进,高浓度抑制的变化趋势与Cd2+对背角无齿蚌氧化损伤效应评估的研究结果类似[46]。

