龙眼SPS基因克隆及其表达分析
帅良 殷菲胧 廖玲燕 刘云芬 段振华 宋慕波


摘要:【目的】克隆龙眼蔗糖磷酸合成酶基因(DlSPS)并分析其表达特性,为深入探究SPS基因家族成员在植物生长发育过程中的调控机制提供理论依据。【方法】以石硖龙眼为材料,利用RT-PCR和RACE技术克隆DlSPS基因,对其进行生物信息学分析,并用实时荧光定量PCR检测龙眼不同组织[根、茎、叶、幼果、果皮、花、熟果(果肉和果皮)]的相对表达量;测定分析果实发育过程中蔗糖含量、SPS活性及DlSPS基因表达的相关性。【结果】克隆获得的DlSPS基因(GenBank登录号为KP769779)cDNA全长3504 bp,编码1057个氨基酸残基,其编码蛋白分子量118.38 kD,理论等电点6.09,脂溶指数85.53,不稳定系数43.69,亲/疏水性平均值-0.412,为不稳定的亲水蛋白。DlSPS蛋白与温州蜜桔(BAA23213.1)SPS蛋白同源性最高,聚在同一小分支上,表明二者亲缘关系较近。DlSPS蛋白二级结构中,α-螺旋占35.0%,延伸链占13.8%,无规则卷曲占51.2%,与其三级结构预测结果相符。DlSPS基因在不同组织中均有表达,但表达量存在明显差异,其中在叶中的表达量显著高于其他组织(P<0.05,下同),其次是在幼果和花中的表達量,在根、果肉、果皮和茎中的表达量较低。龙眼果实发育过程中,蔗糖含量和SPS活性均呈先上升后下降的趋势,但蔗糖含量在谢花后101 d达最大值,而SPS活性在谢花后94 d活性达最大值,说明SPS活性与蔗糖积累具有一定的相关性。DlSPS基因的表达量随着果实发育呈略微下降—大幅上升—略微下降的变化趋势,在谢花后101 d表达量达到最大值,此时蔗糖含量也达最大值。【结论】SPS在龙眼不同组织生长发育过程中对蔗糖积累发挥重要作用,尤其是对叶片和果实中蔗糖积累发挥关键作用。
关键词: 龙眼;蔗糖磷酸合成酶(SPS);基因克隆;表达分析;蔗糖含量;酶活性
中图分类号: S667.2 文献标志码: A 文章编号:2095-1191(2020)07-1529-08
Abstract:【Objective】To explore the expression characteristics of sucrose phosphate synthase gene(DlSPS) of longan, which provided a theoretical basis for further exploring the regulatory mechanism of SPS gene family members du-ring longan growth and development. 【Method】Using Shixia longan as experimental material, DlSPS gene was cloned by RT-PCR combined with RACE,and bioinformatics analysis was carried out. The relative expression of different longan tissues[root, stem, leaf, young fruit, pericarp, flower and ripe fruit(pulp and pericarp)] was detected by real-time fluorescence quantitative PCR. The correlation among sucrose content,SPS activity and DlSPS gene expression during fruit development was measured and analyzed. 【Result】The full length cDNA of DlSPS gene(GenBank number:KP769779) was 3504 bp, encoding 1057 amino acids residues, protein molecular weight 118.38 kD, theoretical isoelectric point 6.09, lipophilic index 85.53, instability coefficient 43.69, hydrophilic/hydrophobic average -0.412, which was an unstable hydrophilic protein. The amino acid sequence of DlSPS protein had the highest homology with SPS protein of Citrus unshiu (BAA23213.1), and they were clustered on the same small branch, indicating that they were closely related to each other. In the secondary structure of DlSPS protein, α-helix accounted for 35.0%, extension chain accounted for 13.8%, and irregular curl accounted for 51.2%, which was consistent with the predicted results of the tertiary structure. DlSPS gene was expressed in different tissues, but the expression level was different, in which the expression in leaves was significantly higher than that in other tissues(P<0.05, the same below), followed by the expression in young fruit and flower, and lower in root, pulp, pericarp and stem. During longan fruit development, sucrose content and SPS activity increased at first and then decreased, but sucrose content reached the maximum at 101 d after flowering, while SPS activity reached the maximum at 94 d after flowering, indicating that there was a certain correlation between SPS activity and sucrose accu-mulation. The expression of DlSPS gene decreased slightly,increased sharply then decreased slightly with the development of fruit, and reached the highest value at 101 d after flowering, and the sucrose content also reached the maximum value. 【Conclusion】SPS plays a key role in sucrose accumulation during longan fruit development, especially in leaves and fruits.
Key words: longan; sucrose phosphate synthase(SPS); gene cloning; expression analysis; sucrose content; enzyme activity
Foundation item: National Natural Science Foundation of China(31860457); Guangxi Natural Science Foundation of China(2018GXNSFBA281118,2017GXNSFAA198082)
0 引言
【研究意义】龙眼(Dimocarpus longan Lour.)为无患子科(Sapindaceae)龙眼属(Dimocarpus)植物,是我国南方名特优水果之一,属于糖直接积累型果实,发育过程中果实假种皮仅有极少数的淀粉积累,成熟时以可溶性糖(包括蔗糖、葡萄糖和果糖)的形式贮藏于液泡中(刘丽琴等,2015;帅良等,2015,2016a)。蔗糖不仅是植物体内光合作用的主要产物,也是果实糖类的主要组分,其合成代谢过程中最关键的限速酶是蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)(黄堂伟等,2016;叶红霞等,2019),该酶在果实发育和采后均控制蔗糖合成(王丽娟等,2013)。果实糖含量变化不仅影响其品质还会影响贮藏寿命(张明方,2003)。因此,克隆龙眼SPS基因(DlSPS)并分析其表达特性,以期深入探究SPS在龙眼蔗糖代谢中的作用机制,对提高其果实品质和贮藏寿命具有重要意义。【前人研究进展】SPS广泛存在于高等植物的叶片、果实、贮藏块根、块茎等组织中,是一种可溶性酶,属低丰度蛋白(刘凌霄等,2005;王旭明等,2018),其催化6-磷酸果糖(Fructose-6-P)和尿苷二磷酸葡萄糖(UDPG)生成6-磷酸蔗糖(Sucrose-6-P)和鸟嘌呤核糖核苷酸(UDP),进而控制植物体内的蔗糖合成和转化(胡瑞芳等,2012;赵令敏等,2019)。Langenk?mper等(2002)对不同物种SPS基因全长序列和保守序列进行分析,结果发现SPS基因可分为A、B和C 3个家族。Castleden等(2004)研究发现,单子叶植物SPS基因可分为A、B、C、DIII和DIV 5个家族,而双子叶植物至少有A、B和C 3个家族。目前已从玉米(Worrell et al.,1991)、柑橘(Komatsu et al.,1996)、水稻(Valdez-Alarcón et al.,1996)、甜瓜(于喜艳等,2007)、甘蔗(黄东亮等,2013)、枸杞(王丽娟等,2013)和木薯(黄堂伟等,2016)等多个物种中克隆得到SPS基因。研究发现,SPS与果实中蔗糖的积累、果实品质形成及成熟衰老密切相关,且转SPS基因的植物蔗糖含量均明显提高,果实风味品质也有所提升(张明方和李志凌,2002;李雯等,2005)。【本研究切入点】目前,有关龙眼SPS基因克隆及表达分析的研究鲜见报道。【拟解决的关键问题】以石硖龙眼为材料,利用RT-PCR和RACE技术克隆DlSPS基因,对其进行生物信息学分析,并用实时荧光定量PCR检测其在龙眼不同组织中的相对表达量,测定分析果实发育过程中蔗糖含量、SPS活性和DlSPS基因表达的相关性,为深入探究SPS基因家族成员在植物生长发育过程中的调控机制提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 植物材料 以石硖龙眼为试料,自谢花59 d后每隔14 d摘取不同发育阶段龙眼果实,每次取20个果实,用于研究不同发育阶段龙眼果实DlSPS基因表达变化、SPS活性与蔗糖含量间的关系。同时,采集龙眼谢花后30 d根、茎、叶、幼果、花及熟果(谢花后110 d成熟龙眼果实),立即运回实验室,从中选取发育正常、外观良好的样品作为试验材料,其中,熟果的果肉和果皮分开。各材料分别取样20个,用于组织差异表达分析。上述采集的样品于液氮中速冻,置于-80 ℃超低温冰箱中冻存。
1. 1. 2 主要试剂 RNA提取试剂盒购自北京华越洋生物科技有限公司;大肠杆菌DH5α感受态细胞、PCR Amplification Kit、pMD20-T Vector Kit、3'-Full RACE Core Set Ver.2.0、Gel DNA Purification Kit Ver2.0购自宝生物工程(大连)有限公司;M-MLV逆转录酶购自美国Life公司;实时荧光定量PCR试剂SYBR Green Master购自德国Roche公司。
1. 1. 3 主要仪器设备 5810D型台式高速离心机(德国Eppendorf公司)、BS224S型电子分析天平(德国Sartorious公司)、PTC-200型PCR仪(美国MJ Research公司)、罗氏LightCycler 480荧光定量PCR仪(德国Roche公司)和Agilent 1200LC型高效液相色谱仪(美国Agilent公司)。
1. 2 试验方法
1. 2. 1 总RNA提取与cDNA第一链合成 使用RNA提取试剂盒提取龙眼果实总RNA,并用1%琼脂糖凝胶电泳进行检测。以总RNA为模板,按M-MLV反转录合成试剂盒说明合成cDNA第一链,于-40 ℃保存备用。
1. 2. 2 基因克隆 根据GenBank上已发表的其他物种中性转化酶基因序列,利用Primer Premier 5.0设计PCR引物DlSPS-For和DlSPS-Rev(表1)。以cDNA為模板,PCR扩增DlSPS基因的中间片段,用1%琼脂糖凝胶电泳检测扩增片段,切胶回收目的片段,连接至pMD20-T载体上,转化大肠杆菌DH5α感受态细胞,通过PCR鉴定出阳性克隆,将其送至生工生物工程(上海)股份有限公司测序。根据扩增获得的片段序列,利用Primer Premier 5.0,按照3'-Full RACE Core Set Ver.2.0试剂盒要求设计3'-RACE引物(DlSPS-3'RACE Outer和DlSPS-3'RACE Inner)(表1),按照Clontech SMARTTM RACE cDNA Amplification Kit试剂盒要求设计5'-RACE引物(DlSPS-5'RACE)(表1),严格按照上述两种试剂盒说明进行PCR扩增,切胶回收目的片段,后续连接、转化、鉴定和测序同上。
利用ContigExpress将上述PCR扩增获得的DlSPS基因中间片段、5'末端和3'末端cDNA序列进行拼接获得DlSPS基因cDNA全长序列,使用NCBI数据库的ORF Finder查找其开放阅读柜(ORF),设计简并引物DlSPS-ORF-For和DlSPS-ORF-Rev(表1)进行PCR扩增,以确定所拼接的序列是否为目的基因序列(帅良等,2017)。
1. 2. 3 生物信息学分析 参照帅良等(2017)的方法进行生物信息学分析。使用NCBI数据库的ORF Finder查找基因的ORF,并使用SIB的Translate tool进行氨基酸序列翻译。蛋白的理化性质采用ProtParam tool进行预测;使用NCBI数据库的BLASTn和BLASTx对氨基酸序列进行比对分析;使用Clustal X 1.83进行蛋白氨基酸序列同源性及序列多重比较分析;使用PredictProtein对蛋白二级结构进行预测;使用SWISS-MODEL Workspace预测蛋白三级结构;运用MEGA 5.0中的Neighbor-joining(NJ)法构建系统发育进化树。
1. 2. 4 实时荧光定量PCR检测 参照Shuai等(2016)和Luo等(2019)的方法,以DlGAPDH基因作为内参,实时荧光定量PCR检测DlSPS基因的表达情况。相对表达量计算采用2-△△Ct法,由Roche Lightcycler? 480系统自动分析得出结果。
1. 2. 5 果实蔗糖含量测定 使用高效液相色谱法测定龙眼果实蔗糖含量(帅良等,2016b)。设3个重复,取平均值。
1. 2. 6 SPS活性测定 参照帅良等(2015)的方法提取新鲜果实中SPS,并参照赵智中等(2001)的方法测定SPS活性。
1. 3 数据处理与作图
使用Excel 2013进行数据处理及分析,使用Origin 8.5作图,并使用Adobe Illustrator CS6进行图形美化及编辑。
2 結果与分析
2. 1 DlSPS基因克隆结果
如图1-A所示,DlSPS基因中间片段的PCR扩增产物长度约850 bp,与预期结果基本相符。测序结果显示,该片段长度为870 bp,经比对发现,确定为目的片段,即DlSPS基因的中间片段。利用3'-RACE引物扩增获得长度为2492 bp的片段(图1-B);利用5'-RACE引物扩增获得长度为800 bp的片段(图1-C)。将上述所获得的中间片段、5'末端和3'末端cDNA序列进行拼接,获得DlSPS基因cDNA全长序列,经ORF Finder分析发现,该序列包含SPS基因的完整ORF序列。根据其设计ORF序列引物,PCR扩增获得一条长度约3100 bp的片段(图1-D)。将其测序结果进行BLAST比对,结果发现,该片段的ORF序列正确,表明成功获得DlSPS基因cDNA全长序列。
2. 2 DlSPS基因的核苷酸序列分析结果及基因家族鉴定
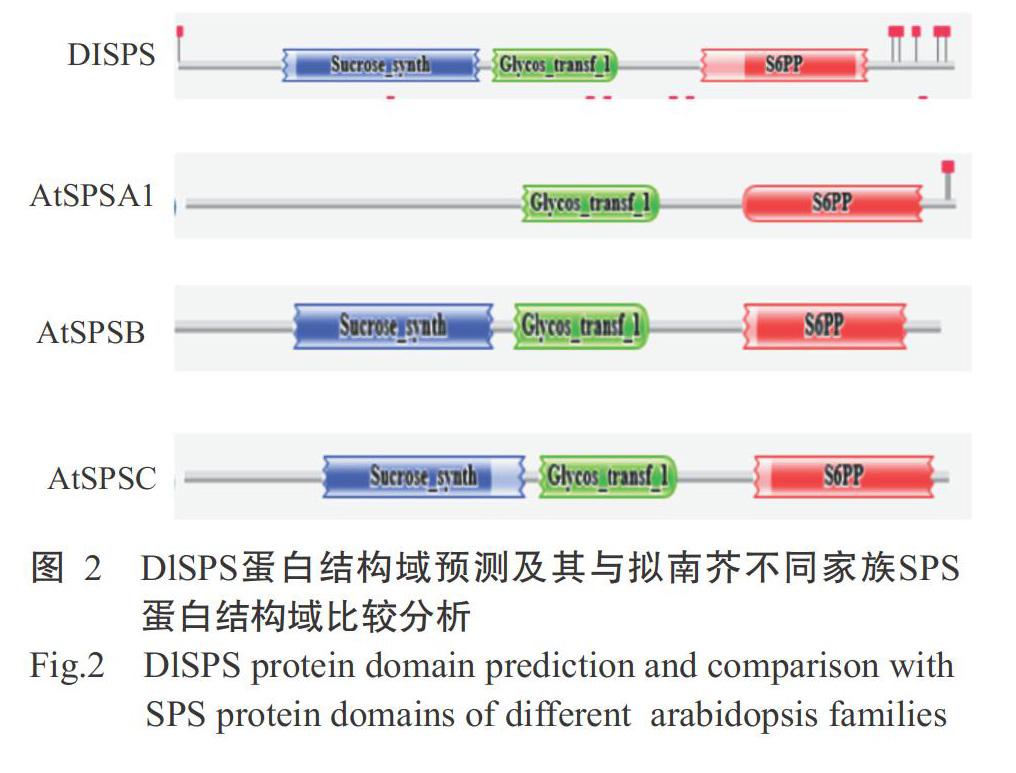
DlSPS基因的GenBank登录号为KP769779,cDNA序列全长3504 bp,编码1057个氨基酸残基,其中,5'端非翻译区59 bp,3'端非翻译区271 bp,Ploy A尾巴为10 bp。通过不同物种的SPS基因核苷酸序列多重比对发现,DlSPS基因与温州蜜桔SPS基因(AB005023.1)同源性最高,为86%。运用Pfam对DlSPS蛋白和拟南芥A、B和C 3个家族成员AtSPSA1(At5g20280)、AtSPSB(At1g04920)和AtSPSC(At4g10120)蛋白的氨基酸序列进行结构域预测分析,结果(图2)显示,DlSPS、AtSPSB和AtSPSC蛋白均具有Glycos_transf_1(糖基转移酶组1)、S6PP(蔗糖-6F-磷酸磷酸水解酶)和Sucrose_synth(蔗糖合酶)3个结构域,而AtSPSA1蛋白只含有S6PP和Glycos-transt-1 2个结构域;DlSPS与AtSPSA1蛋白的S6PP结构域均具有较长尾链的氨基酸序列,而AtSPSC蛋白S6PP结构域未含有较长尾链的氨基酸序列,故推测DlSPS基因属于B家族基因。
2. 3 DlSPS蛋白理化性质预测分析结果
2. 3. 1 DlSPS蛋白亲/疏水性预测预测结果 使用ProtScale预测DlSPS蛋白的亲/疏水性,结果(图3)显示,DlSPS蛋白分子量118.38 kD,理论等电点6.09,脂溶指数85.53,不稳定系数43.69,为不稳定蛋白,最大亲水性为-2.542、最大疏水性为1.432,亲/疏水性平均值为-0.412,说明亲水性氨基酸数量明显高于疏水性氨基酸数量,故为亲水蛋白。
2. 3. 2 系统发育进化树分析结果 从NCBI数据库搜索获得19种作物的SPS蛋白氨基酸序列,并与DlSPS蛋白进行系统发育进化树分析,结果(图4)显示,DlSPS蛋白与温州蜜桔(Citrus unshiu,BAA23213.1)SPS蛋白同源性最高,聚在同一小分支上,表明二者亲缘关系较近。
2. 3. 3 DlSPS蛋白质二级和三级结构预测 DlSPS蛋白二级结构预测结果显示,α-螺旋占35.0%,延伸链占13.8%,无规则卷曲占51.2%。使用SWISS-MODEL Workspace预测DlSPS蛋白三级结构,结果(图5)显示,DlSPS蛋白三级结构蛋白与二级结构预测结果相符。
2. 4 DlSPS基因组织表达特性分析结果
由图6可知,DlSPS基因在不同组织中均有表达,但表达量存在明显差异,其中在叶中的表达量最高,显著高于其他组织(P<0.05,下同),其次在幼果和花中的表达量,二者也存在显著差异,在根、果肉和果皮的表达量无显著差异(P>0.05,下同),但显著高于茎中的表达量,推测DlSPS基因参与龙眼不同组织的生长发育和代谢过程,但在叶和幼果中对蔗糖积累发挥的重要作用更加明显,其原因是叶片为光合作用下蔗糖合成代谢最旺盛的部位,而果实作为库器官,是贮藏蔗糖的主要场所,因此,叶片和幼果中SPS基因的表达量相对较高。
2. 5 龙眼果实蔗糖含量与SPS的相关性分析结果
由图7可知,龙眼果实发育过程中蔗糖含量和SPS活性均呈先上升后下降的趋势,但蔗糖含量在谢花后101 d达最大值,为82.76 mg/g,而SPS活性在谢花后94 d活性达最大值,为49.51 μmol/(g·h),说明SPS活性与蔗糖的积累具有一定的相关性,推测SPS可调控龙眼果实中蔗糖含量(图7)。DlSPS基因的表达量随着果实发育呈略微下降—大幅上升—略微下降的变化趋势,在谢花后101 d表达量达最大值,此时蔗糖含量也达最大值(图8),表明DlSPS基因可调控龙眼果实蔗糖合成。综上所述,在龙眼果实发育过程中,SPS对蔗糖的积累发挥重要作用。
3 讨论
蔗糖是植物体内光合作用的主要产物和果实糖分的主要成分,主要以碳水化合物的形式运输(帅良等,2016a)。SPS是蔗糖代谢过程中最重要的限速酶,近年来从分子水平探究其在蔗糖代谢中的调控机制已成为研究热点。Im(2004)研究表明,植物SPS基因主要在叶片中表达,在其他非光合组织中也有表达,但表达量较低。陈忠良等(2019)研究表明,甘蔗的高、低糖基因型与叶片蔗糖代谢相关酶活性密切相关,并影响糖分积累;与低糖品种相比,高糖品种甘蔗叶片的叶绿素含量、SPS基因表达量、糖分含量及蔗糖代谢相关酶活性相对较高,表明高糖品种甘蔗叶片蔗糖代谢水平更活跃。本研究结果(即DlSPS基因在龙眼叶中表达量显著高于其他组织)与上述前人研究结果相似,推测其原因是叶片是蔗糖合成代谢最旺盛的部位。Gnansounou等(2005)研究表明,甜高粱茎秆蔗糖含量与叶片SPS蛋白表达的相关系数为0.895,与茎秆SPS蛋白的表达相关系数为0.781。本研究也发现,DlSPS基因在不同组织中均有表达,其中在叶、幼果和花中表达较高。可见,SPS在植物生长发育过程中对蔗糖积累发挥重要作用。此外,杨明等(2009)研究发现,随着高粱的生长发育,SPS-A基因在茎秆中的表达不断升高,与蔗糖含量变化趋势一致;在生长后期,甜高粱茎秆中SPS基因表达量明显高于普通高粱,说明SPS基因高效表达能明显提高蔗糖含量,这与甜高粱蔗糖高效积累密切相关。本研究也发现,龙眼果实发育过程中蔗糖含量和SPS活性均呈先上升后下降的趋势,说明SPS活性与蔗糖积累具有一定的相关性;DlSPS基因的表达量随着果实发育呈略微下降—大幅上升—略微下降的变化趋势,在谢花后101 d表达量达最大值,此时蔗糖含量也达最大值,表明在龙眼果实发育过程中SPS对蔗糖的积累发挥重要作用。今后通过蛋白质免疫印迹和酵母双杂交等技术手段,寻找龙眼果实中SPS蛋白的上、下游蛋白,可进一步了解DlSPS基因的调控机制,并寻找可调控其表达的方法进行人为调控龙眼果实的糖代谢,以便于龙眼采摘、贮藏及加工。
4 结论
SPS在龙眼不同组织生长发育过程中对蔗糖积累发挥重要作用,尤其是对叶片和果实中蔗糖积累发挥关键作用。
参考文献:
陈忠良,秦翠鲜,桂意云,廖芬,汪淼,王震,龙明华,黄东亮. 2020. 生长前期甘蔗叶片糖分含量及蔗糖磷酸合成酶基因表达分析[J]. 分子植物育种,18(13):4229-4235. [Chen Z L,Qin C X,Gui Y Y,Liao F,Wang M,Wang Z,Long M H,Huang D L. 2020. Characterization of sugar content and SPS expression parttern in leaves at the early growth stage of sugarcane[J]. Molecular Plant Breeding,18(13):4229-4235.]
胡瑞芳,姜慧,李玥莹. 2012. 蔗糖代谢相关酶的研究进展[J]. 北方园艺,(1):167-170. [Hu R F,Jiang H,Li Y Y. 2012. Research progress of enzymes related to sucrose metabolism[J]. Northern Horticulture,(1):167-170.]
黄东亮,秦翠鲜,陈忠良,桂意云,李双喜,汪淼,廖青,李杨瑞. 2013. 甘蔗B家族蔗糖磷酸合成酶基因SofSPSB的克隆及原核表達[J]. 南方农业学报,44(4):545-551. [Huang D L,Qin C X,Chen Z L,Gui Y Y,Li S X,Wang M,Liao Q,Li Y R. 2013. Cloning and prokaryotic expression of sucrose phosphate synthase gene(SofSPSB) in sugarcane[J]. Journal of Southern Agriculture,44(4):545-551.]
黄堂伟,罗兴录,单忠英,朱艳梅. 2016. 木薯蔗糖磷酸合成酶基因克隆及组织表达分析[J]. 福建农业学报,31(12):1273-1279. [Huang T W,Luo X L,Shan Z Y,Zhu Y M. 2016. Cloning and tissue expressions of sucrose phosphate synthase gene in cassava[J]. Fujian Journal of Agricultural Sciences,31(12):1273-1279.]
李雯,邵远志,陈维信. 2005. 蔗糖磷酸合成酶(SPS)与果实品质及成熟衰老的研究进展[J]. 西北植物学报,(11):202-206. [Li W,Shao Y Z,Chen W X. 2005. Research advances in the relationships of sucrose phosphate synthase(SPS) with fruit quality and maturity and senescence[J]. Acta Botanica Boreali-Occidentalia Sinica,(11):202-206.]
刘丽琴,李伟才,舒波,魏永赞,武红霞,石胜友. 2015. 蔗糖代谢相关酶在‘石硖龙眼假种皮糖积累中的作用[J]. 果树学报,32(4):653-657. [Liu L Q,Li W C,Shu B,Wei Y Z,Wu H X,Shi S Y. 2015. Role of sucrose metabolism related enzymes in accumulation of sugar in‘Shixiaof Dimocarpus longan Lour.[J]. Journal of Fruit Science,32(4):653-657.]
刘凌霄,沈法富,卢合全,韩庆点,刘云国. 2005. 蔗糖代谢中蔗糖磷酸合成酶(SPS)的研究进展[J]. 分子植物育种,(2):275-281. [Liu L X,Shen F F,Lu H Q,Han Q D,Liu Y G. 2005. Research advance on sucrose phosphate synthase in sucrose metabolism[J]. Molecular Plant Bree-ding,(2):275-281.]
帅良,谷李桃,刘文浩,韩冬梅,吴振先. 2016a. 不同龙眼品种果实退糖特性分析[J]. 热带作物学报,37(10):1900-1907. [Shuai L,Gu L T,Liu W H,Han D M,Wu Z X. 2016a. Characteristic analysis of sugar returning in the fruit of different longan cultivars[J]. Chinese Journal of Tropical Crops,37(10):1900-1907.]
帅良,钱盼红,刘文浩,韩冬梅,吴振先. 2016b. 不同龙眼品种果实成熟时糖含量及其特征研究[J]. 热带作物学报,37(5):915-921.[Shuai L,Qian P H,Liu W H,Han D M,Wu Z X. 2016b. Sugar contents and composition in the mature fruit of different longan cultivars[J]. Chinese Journal of Tropical Crops,37(5):915-921.]
帅良,廖玲燕,韩冬梅,吴振先. 2017. 龙眼中性转化酶基因(DlNI)的克隆及分析[J]. 西南农业学报,30(10):2202-2209. [Shuai L,Liao L Y,Han D M,Wu Z X. 2017. Cloning and sequence analysis of neutral invertase gene(DlNI) from longan fruit[J]. Southwest China Journal of Agricultural Sciences,30(10):2202-2209.]
帅良,薛晓清,牛佳佳,顾渝娟,韩冬梅,吴振先. 2015. 龙眼果实发育过程中果糖激酶活性及其基因表达分析[J]. 华南农业大学学报,36(5):99-104. [Shuai L,Xue X Q,Niu J J,Gu Y J,Han D M,Wu Z X. 2015. Analyses of the fructokinase activity and its gene expression during the development of longan fruits[J]. Journal of South China Agricultural University,36(5):99-104.]
王丽娟,丁向真,王彦才,李翔. 2013. 枸杞蔗糖磷酸合成酶基因的克隆及组织表达分析[J]. 西北植物学报,33(8):1516-1520.[Wang L J,Ding X Z,Wang Y C,Li X. 2013. Cloning and tissue expression analysis of sucrose phosphate synthase gene from Lycium barbarum L.[J]. Acta Botanica Boreali-Occidentalia Sinica,33(8):1516-1520.]
王旭明,趙夏夏,陈景阳,龚茂健,杨善,谢平,莫俊杰,黄永相,叶昌辉,周鸿凯. 2018. 盐胁迫下水稻孕穗期SS和SPS活性与糖积累的响应及其相关性分析[J]. 江苏农业学报,34(3):481-486. [Wang X M,Zhao X X,Chen J Y,Gong M J,Yang S,Xie P,Mo J J,Huang Y X,Ye C H,Zhou H K. 2018. The response and correlations between carbohydrate accumulation and activities of SPS,SS at booting stage of rice under salt stress[J]. Jiangsu Journal of Agricultural Sciences,34(3):481-486.]
杨明,刘丽娟,李莉云,王博,常金华,刘国振. 2009. 甜高粱蔗糖积累与茎秆中SPS表达的相关性研究[J]. 中国农业科学,42(1):85-92. [Yang M,Liu L J,Li L Y,Wang B,Chang J H,Liu G Z. 2009. Correlation analysis of sugar accumulation and SPS expression in sweet sorghum(Sorghum bicolor L. Moench) stems[J]. Scientia Agricultura Sinica,42(1):85-92.]
叶红霞,吕律,王同林,海睿,汪炳良. 2019. 不同变种甜瓜糖分积累及蔗糖代谢酶活性动态变化[J]. 核农学报,33(10):1959-1966. [Ye H X,Lü L,Wang T L,Hai R,Wang B L. 2019. Dynamic changes of sugar accumulation and sucrose metabolic enzymes activity during fruit growth and maturation in different varieties of melon(Cucumis melo L.)[J]. Journal of Nuclear Agricultural Sciences,33(10):1959-1966.]
于喜艳,樊继德,何启伟. 2007. 甜瓜果实蔗糖磷酸合成酶基因cDNA片段的克隆及表达分析[J]. 园艺学报,34(1):205-208. [Yu X Y,Fan J D,He Q W. 2007. Cloning and expression analysis of a sucrose phosphate synthase cDNA fragment in melon fruit[J]. Acta Horticulturae Sinica,34(1):205-208.]
张明方,李志凌,陈昆松,钱琼秋,张上隆. 2003. 网纹甜瓜发育果实糖分积累与蔗糖代谢参与酶的关系[J]. 植物生理与分子生物学学报,29(5):455-462. [Zhang M F,Li Z L,Chen K S,Qian Q Q,Zhang S L. 2003. The relationship between sugar accumulation and enzymes rela-ted to sucrose metabolism in developing fruits of muskmelon[J]. Acta Photophysiologica Sinica,29(5):455-462.]
张明方,李志凌. 2002. 高等植物中与蔗糖代谢相关的酶[J]. 植物生理学报,38(3):289-295. [Zhang M F,Li Z L. 2002. Sucrose-metabolizing enzymes in higher plants[J]. Plant Physiology Communications,38(3):289-295.]
赵令敏,邵盈,张艳芳,敖兰吉亚,季祥,苏彩霞,霍秀文. 2019. 山药块茎膨大期淀粉合成关键酶活性及调控基因的表达分析[J]. 河南农业大学学报,53(6):847-854. [Zhao L M,Shao Y,Zhang Y F,Aolan J Y,Ji X,Su C X,Huo X W. 2019. Analysis of key enzyme activity and gene expression in starch synthesis during tuber expansion of yam[J]. Journal of Henan Agricultural University,53(6):847-854.]
趙智中,张上隆,徐昌杰,陈昆松,刘拴桃. 2001. 蔗糖代谢相关酶在温州蜜柑果实糖积累中的作用[J]. 园艺学报,28(2):112-118. [Zhao Z Z,Zhang S L,Xu C J,Chen K S,Liu S T. 2001. Role of enzymes related to sucrose meta-bolism in sugar accumulation of Wenzhou tangerine fruit [J]. Acta Horticulturae Sinica,28(2):112-118.]
Castleden K C,Naohiro A,Gillespie V J,MacRae E A,Quick P W,Buchner P,Foyer C H,Furbank R T,Lunn J E. 2004. Evolution and function of the sucrose-phosphate synthase gene families in wheat and other grasses[J]. Plant Physiology,135(3):1753-1764.
Gnansounou E,Dauriat A,Wyman C E. 2005. Refining sweet sorghum to ethanol and sugar:Economic trade-offs in the context of North China[J]. Bioresource Technology,96(9):985-1002.
Im K H. 2004. Expression of sucrose-phosphate synthase(SPS) in non-photosynthetic tissues of maize[J]. Molecules and Cells,17(3):404-409.
Komatsu A,Takanokura Y,Omura M,Akihama T. 1996. Cloning and molecular analysis of cDNAs encoding three sucrose phosphate synthase isoforms from a citrus fruit(Citrus unshiu Marc.)[J]. Molecular & General Genetics,252(3):346-351.
Langenk?mper G,Fung R W M,Newcomb R D,Atkinson R G,Gardner R C,MacRae E A. 2002. Sucrose phosphate synthase genes in plants belong to three different families[J]. Journal of Molecular Evolution,54(3):322-332.
Luo T,Shuai L,Liao L Y,Li J,Duan Z H,Guo X M,Han D,Wu Z X. 2019. Soluble acid invertases act as key factors influencing the sucrose/hexose ratio and sugar receding in longan(Dimocarpus longan Lour.) Pulp[J]. Journal of Agricultural and Food Chemistry,67(1):352-363.
Shuai L,Li J,Niu J J,Qian P H,Liu W H,Xue X Q,Han D M,Wu Z X. 2016. Sucrose-metabolizing enzymes and their genes in the arils of two Dimocarpus longan cultivars[J]. Biologia Plantarum,60(4):741-748.
Valdez-Alarcón J J,Ferrando M,Salerno G,Jimenez-Moraila B,Herrera-Estrella L. 1996. Characterization of a rice sucrose-phosphate synthase-encoding gene[J]. Gene,170(2):217-222.
Worrell A C,Bruneau J M,Summerfelt K,Boersig M,Voelker T A. 1991. Expression of a maize sucrose phosphate synthase in tomato alters leaf carbohydrate partitioning[J]. The Plant Cell,3(10):1121-1130.
(責任编辑 陈 燕)

