蛋白S缺乏症合并脑静脉窦血栓形成两例
徐杰文
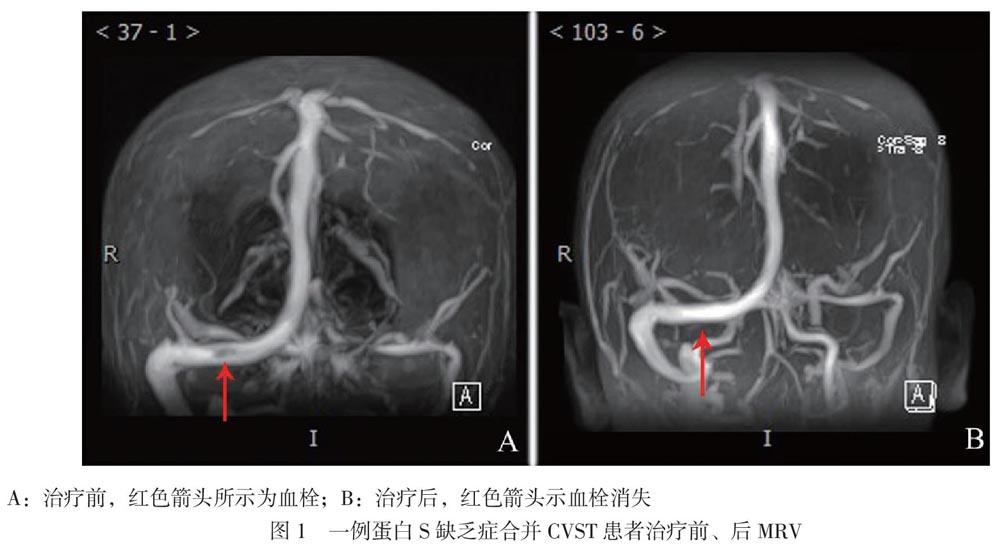
【摘要】脑静脉窦血栓形成(CVST)是神经内科少见疾病,临床表现不典型,起病隐匿,如同时伴有蛋白S缺乏症则更罕见。该文报道2例家族性病例,其中例1女性患者为家族中的女儿、17岁;例2男性患者为例1的父亲、45岁,例2 CVST发病年龄为30岁。2例临床表现均为头痛伴恶心、呕吐,影像学检查均提示CVST,检测例1的蛋白S为21.3%、例2小于16%,给予抗凝药物联合营养神经等对症支持治疗后临床症状得到缓解,均诊断为蛋白S缺乏癥合并CVST。临床上发现无明显诱因出现CVST的年轻患者,应考虑有无高凝血状态,有无先天遗传因素,同时需考虑易栓症可能,及时检测抗凝血酶Ⅲ、蛋白S和蛋白C活性、血小板聚集功能等,这对不明原因CVST的诊治有重要意义。
【关键词】蛋白S缺乏症;脑静脉及脑静脉窦血栓形成;抗凝治疗
Protein S deficiency complicated with cerebral venous sinus thrombosis: report of two cases and literature review Xu Jiewen. Department of Stroke Center, Panyu District Central Hospital, Guangzhou 515041, China
Corresponding author, Xu Jiewen, E-mail: 175609137@ qq. com
【Abstract】Cerebral venous sinus thrombosis (CVST) is not a common disease in Department of Neurology, which has atypical clinical manifestations and insidious onset. CVST complicated with protein S deficiency is even more rarely seen. In this article, two family cases of CVST complicated with protein S deficiency were reported. One 17-year-old female patient was the daughter and the other case of 45-year-old male patient was her father. The age of onset of the father was 30 years old. Both two patients presented with headache, nausea and vomitting. Imaging examination prompted the diagnosis of CVST. The protein S in the daughter was 21.3%, and that of the father was less than 16%. Clinical symptoms were relieved after symptomatic and supportive treatment, such as subcutaneous injection and oral anticoagulant drugs combined with nerve nutrition. Both two cases were diagnosed with protein S deficiency complicated with CVST. In clinical practice, it is necessary to consider the possibility of hypercoagulable state, genetic factors and thrombophilia for young CVST patients without known causes.Anti-thrombinⅢ, activities of protein S and protein C and platelet aggregation function should be detected in a timely manner, which is of significance for the diagnosis and treatment of CVST with unknown causes.
【Key words】Protein S deficiency;Cerebral venous sinus thrombosis;Anti-coagulant therapy
脑静脉系统血栓形成在临床上的发病率约为1.5/1000 000 ~ 2.5/1000 000[1]。临床上常常漏诊及误诊该病,但随着影像学特别是颅脑磁共振静脉血管成像(MRV)及计算机断层造影的普及,脑静脉窦血栓形成(CVST)的确诊率不断提高。引发CVST的常见原因为高凝血状态,包括使用避孕药物、围产期相关因素诱发、自身免疫性疾病,女性发病率比男性高。蛋白S缺乏症为一
种遗传性易栓症,表现为蛋白S含量或活性降低,从而引起凝血功能异常,导致各种血栓形成[2-3]。近期我院收治2例蛋白S缺乏症合并CVST患者,现笔者将其报道如下,并结合文献进行分析。
病例资料
例1 患者女,17岁,高三在读学生。因头痛、头晕、呕吐4 d于2020年4月16日入我院。2020年4月12日患者于上课时突发头痛、头晕,伴恶心及呕吐,当时未予重视,其后症状逐渐加重,于4月16日至我院行头部CT平扫,结果提示:①左侧丘脑局部密度可疑降低,建议行MRI检查;②直窦及窦汇内高密度影,未排除血栓形成,建议进一步检查。当日立即完善头颅MRI、磁共振血管造影(MRA)和MRV,结果提示:①考虑双侧放射冠、丘脑、胼胝体压部静脉性梗死(亚急性期);②颅脑MRA检查未见明显异常;③直窦及窦汇血栓形成(图1)。收入我院神经科后体格检查示:神清语晰,对答切题,记忆力、定向力、计算力正常,查体合作。双侧瞳孔等圆等大,直径约3 mm,对光反射灵敏,双眼球活动自如,未见眼震。双侧额纹对称,双侧鼻唇沟对称,伸舌居中。四肢肌力与肌张力正常,指鼻试验、跟膝胫试验、闭目难立征均(-),四肢感觉对称存在。双侧腱反射对称存在,双侧巴宾斯基征未引出。颈稍硬,双侧克氏征、布氏征(-)。凝血四项(血浆):D-二聚体1840 μg/L
(升高),凝血酶原时间12.3 s,凝血酶原活动度89.7%,凝血酶原比值1.05;凝血酶原国际标准化比值1.06;纤维蛋白原含量3.36 g/L;凝血酶时间16.5 s,活化部分凝血活酶时间24.4 s。甲状腺素、T3、TSH、FT3、FT4均无异常。尿妊娠实验、病毒感染检查(HBV、丙型肝炎病毒、HIV、梅毒螺旋体)均(-)。风湿性相关检查指标抗磷脂抗体三项(血清):抗β2糖蛋白1抗体80.96 RU/ml
(升高),抗心磷脂抗体IgM 0.03 U/ml,抗心磷脂抗體IgG 0.09 U/ml。心电图,心脏彩色多普勒超声检查(彩超),肝、胆、胰、脾超声检查均无异常。入院后追问病史,患者诉其父亲有类似CVST病史,遂考虑是否存在遗传性相关疾病可能,遂将患者血液样本送外公司进行易栓症的相关检查:抗凝血酶Ⅲ(AT-Ⅲ)93.0%,蛋白C测定 119.3%,蛋白S测定21.3%(女性参考值59.0% ~ 118.0%),未检测到狼疮样抗凝物。考虑患者父亲有类似病史,遂对患者与父母行遗传病全外显子组家系检测(Trio),检测到该患者携带PROS1基因一个杂合变异,区带为PROS1 3q11.1,参考序列为NM_000313.3,位置为Exon14,cDNA水平为c.1680T > A,蛋白水平p.(Tyr560*),该变异为无义突变(预计会使所编码蛋白质第560位氨基酸由Tyr变为终止密码子),预计会产生截短表达的蛋白质而丧失其正常功能,有文献报道在蛋白S缺乏症患者中检测到该变异,ESP6500siv2_ALL和 千人基因组(1000g2015aug_ALL)数据库未见收录,dbSNP147数据库有收录(rs199469503)。综合考虑,认为该变异为致病变异[4-5]。考虑蛋白S缺乏症合并CVST诊断明确,当日给予患者依诺肝素钠6000 IU ,每12 h皮下注射1次,共11 d,4月19日复查凝血指标:D-二聚体1080 μg/L,凝血酶原时间11.2 s,凝血酶原活动度113.9%,凝血酶原比值0.96;凝血酶原国际标准化比值0.95,纤维蛋白原含量3.24 g/L;凝血酶时间17.9 s,活化部分凝血活酶时间27.0 s。考虑D-二聚体较前降低,于4月22日重叠口服华法林3 mg/d。4月24日复查凝血指标:D-二聚体450 μg/L,凝血酶原时间11.1 s,凝血酶原活动度117.5%,凝血酶原比值0.95;凝血酶原国际标准化比值0.94,纤维蛋白原含量2.87 g/L;凝血酶时间18.6 s,活化部分凝血活酶时间27.0 s。4月25日复查MRV提示:①原双侧放射冠、丘脑、胼胝体压部静脉性栓塞情况较前改善;②直窦及窦汇血栓较前稍有减少。因凝血酶原国际标准化比值未达标,于4月26日将华法林调整为3.375 mg/d,5月8日复查凝血酶原国际标准化比值为2.04。5月8日后继续维持口服华法林3.375 mg/d治疗,维持凝血酶原国际标准化比值于2 ~ 3,治疗期间患者一般情况稳定,每日有诉头晕,出院时候头晕好转,可上学,现定期随访。
例2 患者男,45岁,为例1父亲。询问例1家族史时其父亲诉既往曾有CVST,追问病史,其于30岁时突发头痛,伴恶心、呕吐,当时到我院诊断为CVST,因年代久远,未能获得书面影像学检查结果,当时未进一步详细查找病因,仅给予抗凝治疗,其后症状缓解出院,但2个月后出现肝脏门静脉血栓,遂住院继续予抗凝治疗,复查肝脏门静脉血栓消失后出院。目前患者生活能自理,但自上述30岁CVST发病后出现癫痫后遗症,表现为癫痫大发作形式,每年发作约1 ~ 2次。30岁CVST发病后长期服用华法林,长期监测凝血功能,保持凝血酶原国际标准化比值在2 ~ 3之间,近1年除偶有癫痫发作,未有其他不适,遂自行停服华法林。由于患者及其女儿均于年轻时出现无诱因CVST,遂动员其抽血进行易栓症相关检查,结果显示:抗凝血酶Ⅲ(AT-Ⅲ)97.6%,蛋白C测定104%,蛋白S测定小于16%(男性参考值75% ~ 130%),未检测到狼疮样抗凝物,Trio结果显示与例1相同的PROS1基因杂合变异,变异位置与例1相同,其妻子未有检测到基因变异,遂考虑本例也为蛋白S缺乏症合并CVST,动员该患者重新口服华法林治疗,使用华法林1周后凝血酶原国际标准化比值为2.1,现继续动态监测凝血功能并随访。
讨论
CVST的发病原因有多种,常见的包括感染性、性别相关性、肿瘤及自身免疫性、遗传性等原因[6]。一项多中心对照研究显示,CVST与怀孕期关联较小,而产后CVST发生风险增加,尤其是产后6周风险达到最高[7]。有研究证实肿瘤是引起CVST发病的重要因素,尤其是血液性相关肿瘤[8]。笔者报道的2例病例基本表现为头晕头痛、恶心呕吐,临床表现为非特异性,极易漏诊。影像学检查常常作为诊断该病的金标准,常常采取抗凝治疗,如能早期确诊,患者往往恢复良好。
易栓症主要是由遗传性缺陷或者后天获得性因素引起血栓形成的一类疾病。本文中的2例病例均为遗传性,与遗传有关的血栓形成常考虑以下因素:①凝血因子V Leiden突变,这是最常见的遗传性血栓形成症,常见于高加索人群,亚洲人群相对少见,据统计有3% ~ 8%的欧洲人至少有一个拷贝数的Leiden突变。既往的研究显示凝血因子V Leiden突变与白种人青年缺血性卒中相关[9]。②凝血酶原G20210A 突变,凝血酶原是一种糖蛋白,由肝脏合成,其突变是血栓性疾病的遗传危险因素之一,有研究显示G20210A突变的杂合子在有症状携带者中比无症状携带者更为普遍(10.8% vs. 2.7%,P < 0.001)[10]。有研究者测试了222例有产科并发症妇女,包括重度子痫前期、轻度子痫前期、宫内生长迟缓、严重胎盘早剥、原因不明的死胎等情况,其中28例(13%)患者是凝血酶原 G20210A突变的杂合携带者,其基因突变会增加血栓发生的风险[11]。③蛋白C或蛋白S缺乏,蛋白C和蛋白S是体内重要的抗凝血、抗血栓物质,两者缺乏会导致血栓性疾病反复发生。检索文献,蛋白S缺乏症病例报道中常见的血栓部位为脑静脉窦、心房、心室、门静脉系统、下肢静脉、肠系膜静脉、肺动脉等,有研究提示蛋白C和蛋白S缺乏引起的深静脉及肺动脉血栓的发生率逐渐升高[12]。在蛋白C缺乏症患者中,反复发作的静脉血栓是其常见临床表现,血栓可以发生在任何部位。有研究提示蛋白C缺乏症可使静脉血栓发生风险增加11.3倍[13]。我国蛋白C缺乏症患病率约为1.06%,高于西方国家的0.30%[14]。④抗凝血酶缺乏症,抗凝血酶是一种天然的抗凝剂,通过抑制凝血酶及其他凝血因子的活性维持体内凝血功能。抗凝血酶缺乏症是由抗凝血酶基因(SERPINC1)突变引起的常染色体不完全显性遗传性血栓病,会导致静脉血栓[15]。有研究者测定了202 例血栓患者抗凝血酶水平,其中21例的抗凝血酶水平降低,其基因突变例数约为1.9%[16]。本文中的父女均有CVST病史,父亲还曾出现门静脉血栓,提示血栓可发生于全身多处血管,且会反复发作。本文中的2例均给予抗凝治疗,目前恢复情况良好。CVST的治疗以抗凝为首选方案,近年来也有根据患者病情采用溶栓、血管再通、取栓手术等治疗方案,可根据患者不同病情进行选择[17]。
综上所述,CVST易漏诊,结合影像学检查等手段可提高诊断率,对于年轻患者出现不明原因的反复发作的血栓形成,或具有家族遗传倾向的患者,可以进行易栓症相关检测,如抗凝血酶Ⅲ、蛋白S和蛋白C活性、血小板聚集功能等,必要时应完善家系相关基因检测,对于诊断各种血栓形成的原因、 优化治疗方案、判断预后具有重要意义。
参 考 文 献
[1] 冯子凌. 颅内静脉系统血栓形成的临床诊疗分析. 中国药物与临床,2018, 18(11): 1966-1968.
[2] Hong J, Lee JH, Lee JY, Lee JO, Choi WI, Ahn S, Lim YH, Bang SM, Oh D. Prominent seasonal variation in pulmonary embolism than deep vein thrombosis incidence: a Korean venous thrombosis epidemiology study. Korean J Intern Med,2020, 35(3): 682-691.
[3] Andrade-Machado R, Gutierrez-Ronquillo JH, Espinosa-Gonzalez R, Crespo-Rodriguez L. Non-infectious thrombosis of the cerebral venous sinuses and veins in adults. A report of five cases. Rev Neurol,2001, 32(6): 538-540.
[4] Li L, Wu X, Wu W, Ding Q, Cai X, Wang X. Clinical manifestation and mutation spectrum of 53 unrelated pedigrees with protein s deficiency in China. Thromb Haemost,2019, 119(3): 449-460.
[5] Ding Q, Shen W, Ye X, Wu Y, Wang X, Wang H. Clinical and genetic features of protein C deficiency in 23 unrelated Chinese patients. Blood Cells Mol Dis,2013, 50(1): 53-58.
[6] 沈靜, 南光贤. 颅内静脉窦血栓的病因及治疗策略的研究进展. 中风与神经疾病杂志,2019, 36(10): 958-960.
[7] Silvis SM, Lindgren E, Hiltunen S, Devasagayam S, Scheres LJ, Jood K, Zuurbier SM, Kleinig TJ, Silver FL, Mandell DM, Middeldorp S, Putaala J, Cannegieter SC, Tatlisumak T, Coutinho JM. Postpartum period is a risk factor for cerebral venous thrombosis. Stroke,2019, 50(2): 501-503.
[8] Silvis SM, Hiltunen S, Lindgren E, Jood K, Zuurbier SM, Middeldorp S, Putaala J, Cannegieter SC, Tatlisumak T, Coutinho JM. Cancer and risk of cerebral venous thrombosis: a case-control study. J Thromb Haemost,2018, 16(1): 90-95.
[9] Li X, Cui L, Li Y, Zhu L, Wang C, Liu J, Fang S. Prevalence and geographical variation of Factor V Leiden in patients with cerebral venous thrombosis: a meta-analysis. PLoS One,2018, 13(8): e203309.
[10] Tosetto A, Rodeghiero F, Martinelli I, De Stefano V, Missiaglia E, Chiusolo P, Mannucci PM. Additional genetic risk factors for venous thromboembolism in carriers of the Factor V Leiden mutation. Br J Haematol,1998, 103(3): 871-876.
[11] Kupferminc MJ, Peri H, Zwang E, Yaron Y, Wolman I, Eldor A. High prevalence of the prothrombin gene mutation in women with intrauterine growth retardation, abruptio placentae and second trimester loss. Acta Obstet Gynecol Scand,2000, 79(11): 963-967.
[12] Zuurbier SM, Coutinho JM, Stam J, Canhao P, Barina-garrementeria F, Bousser MG, Ferro JM. Clinical outcome of anticoagulant treatment in head or neck infection-associated cerebral venous thrombosis. Stroke,2016, 47(5): 1271-1277.
[13] Heraudeau A, Delluc A, Le Henaff M, Lacut K, Leroyer C, Desrues B, Couturaud F, Tromeur C. Risk of venous thromboembolism in association with Factor V Leiden in cancer patients - the EDITH case-control study. PLoS One, 2018, 13(5): e194973.
[14] 王增智, 赵秀清, 李杰, 高杨, 张向峰, 刘双. 汉族无诱因肺血栓栓塞症患者天然抗凝蛋白缺陷的发生率及临床特点分析. 中国医药,2018, 13(8): 1156-1159.
[15] Sokol J, Timp JF, le Cessie S, van Hylckama-Vlieg A, Rosendaal FR, Kubisz P, Cannegieter SC, Lijfering WM. Mild antithrombin deficiency and risk of recurrent venous thromboembolism: results from the MEGA follow-up study. J Thromb Haemost, 2018, 16(4): 680-688.
[16] Gu Y, Shen W, Zhang L, Zhang J, Ying C. Deficiency of antithrombin and protein C gene in 202 Chinese venous thromboembolism patients. Int J Lab Hematol ,2014, 36(2): 151-155.
[17] 胡子旋, 曾勉. 遗传性易栓症致静脉血栓栓塞症的口服抗凝药物治疗现状. 新医学, 2020, 51(8): 569-575.
(收稿日期:2020-05-26)
(本文编辑:洪悦民)

