有关“金属与盐溶液反应后滤液、滤渣的判断”解题技巧
段庆华
摘 要:近几年云南省的中考试题中都有一个有关“金属与盐溶液反应后滤液、滤渣成分的判断”的题目,此类型的题目属于难题,学生的得分率很低。每个老师在教学中都有自己独特的方法传授于学生。在此文中我主要介绍我在教学中教给学生的一种解题技巧。
关键词:金属与盐溶液反应;滤液、滤渣成分的判断;解题技巧;应用示例
一、理论支撑
第一次遇到这类题目是在九年级化学下册第八单元课题2金属的化学性质一节中,首先从“一种金属放入到一种盐溶液中,充分反应后对其进行过滤,对过滤后滤液和滤渣的成分”分析入手。
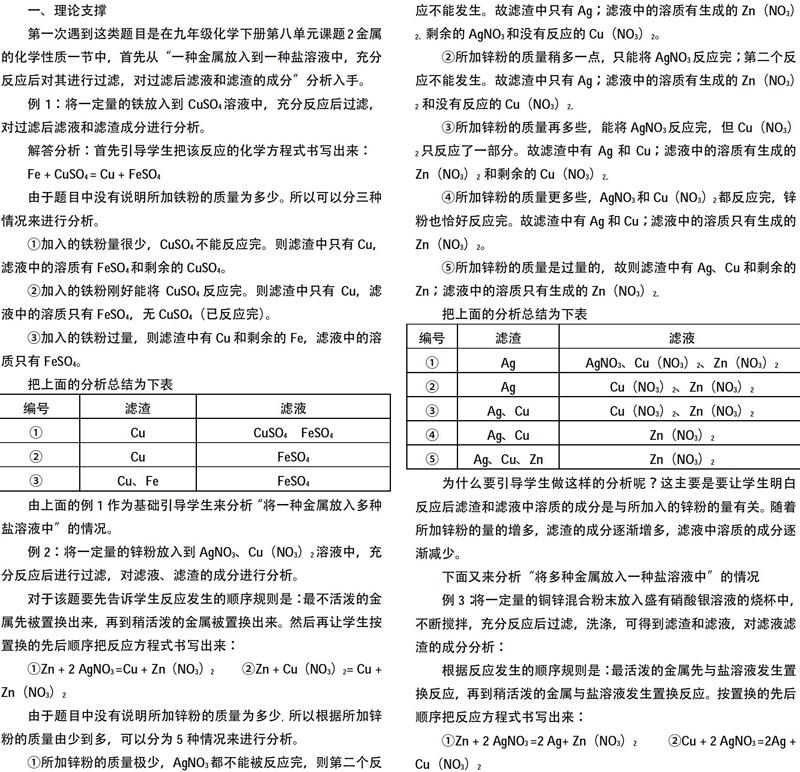
例1:将一定量的铁放入到CuSO4溶液中,充分反应后过滤,对过滤后滤液和滤渣成分进行分析。
解答分析:首先引导学生把该反应的化学方程式书写出来:
Fe + CuSO4 = Cu + FeSO4
由于题目中没有说明所加铁粉的质量为多少。所以可以分三种情况来进行分析。
①加入的铁粉量很少,CuSO4不能反应完。则滤渣中只有Cu,滤液中的溶质有FeSO4和剩余的CuSO4。
②加入的铁粉刚好能将CuSO4反应完。则滤渣中只有Cu,滤液中的溶质只有FeSO4,无CuSO4(已反应完)。
③加入的铁粉过量,则滤渣中有Cu和剩余的Fe,滤液中的溶质只有FeSO4。
把上面的分析总结为下表
由上面的例1作为基础引导学生来分析“将一种金属放入多种盐溶液中”的情况。
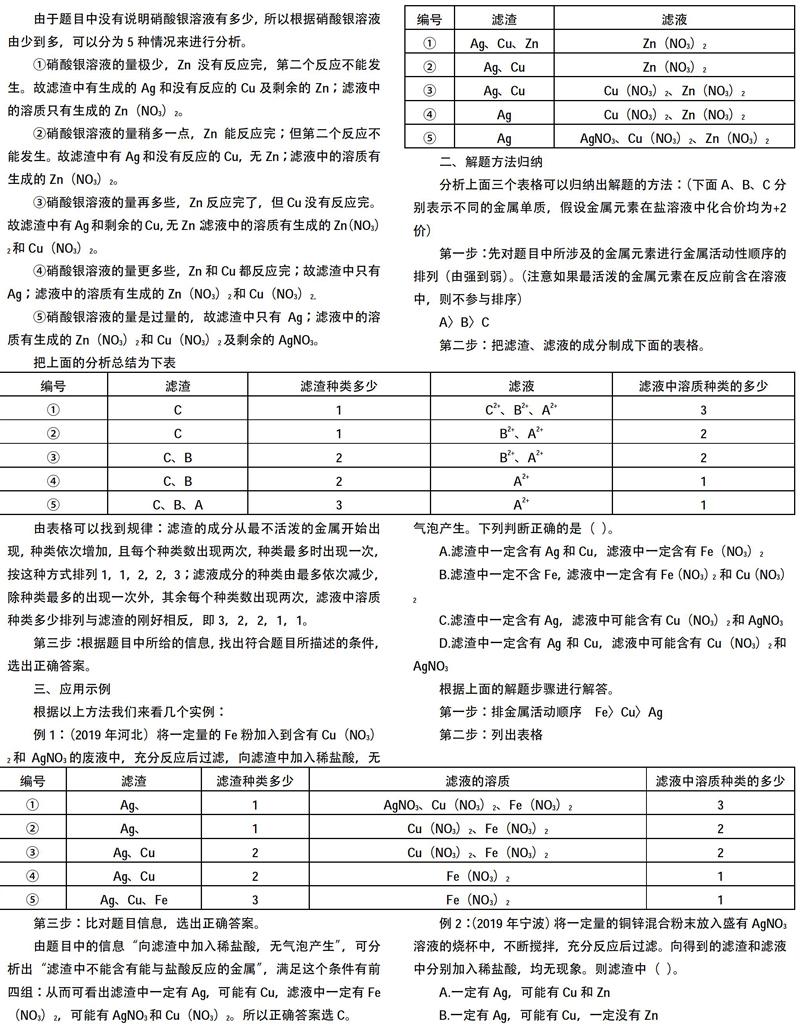
例2:将一定量的锌粉放入到AgNO3、Cu(NO3)2溶液中,充分反应后进行过滤,对滤液、滤渣的成分进行分析。
对于该题要先告诉学生反应发生的顺序规则是:最不活泼的金属先被置换出来,再到稍活泼的金属被置换出来。然后再让学生按置换的先后顺序把反应方程式书写出来:
①Zn + 2 AgNO3 =Cu + Zn(NO3)2 ②Zn + Cu(NO3)2= Cu + Zn(NO3)2
由于题目中没有说明所加锌粉的质量为多少,所以根据所加锌粉的质量由少到多,可以分为5种情况来进行分析。
①所加锌粉的质量极少,AgNO3都不能被反应完,则第二个反应不能发生。故滤渣中只有Ag;滤液中的溶质有生成的Zn(NO3)2、剩余的AgNO3和没有反应的Cu(NO3)2。
②所加锌粉的质量稍多一点,只能将AgNO3反应完;第二个反应不能发生。故滤渣中只有Ag;滤液中的溶质有生成的Zn(NO3)2 和没有反应的Cu(NO3)2。
③所加锌粉的质量再多些,能将AgNO3反应完,但Cu(NO3)2只反应了一部分。故滤渣中有Ag和Cu;滤液中的溶质有生成的Zn(NO3)2 和剩余的Cu(NO3)2。
④所加锌粉的质量更多些,AgNO3和Cu(NO3)2都反应完,锌粉也恰好反应完。故滤渣中有Ag和Cu;滤液中的溶质只有生成的Zn(NO3)2。
⑤所加锌粉的质量是过量的,故则滤渣中有Ag、Cu和剩余的Zn;滤液中的溶质只有生成的Zn(NO3)2。
把上面的分析总结为下表
为什么要引导学生做这样的分析呢?这主要是要让学生明白反应后滤渣和滤液中溶质的成分是与所加入的锌粉的量有关。随着所加锌粉的量的增多,滤渣的成分逐渐增多,滤液中溶质的成分逐渐减少。
下面又来分析“将多种金属放入一种盐溶液中”的情况
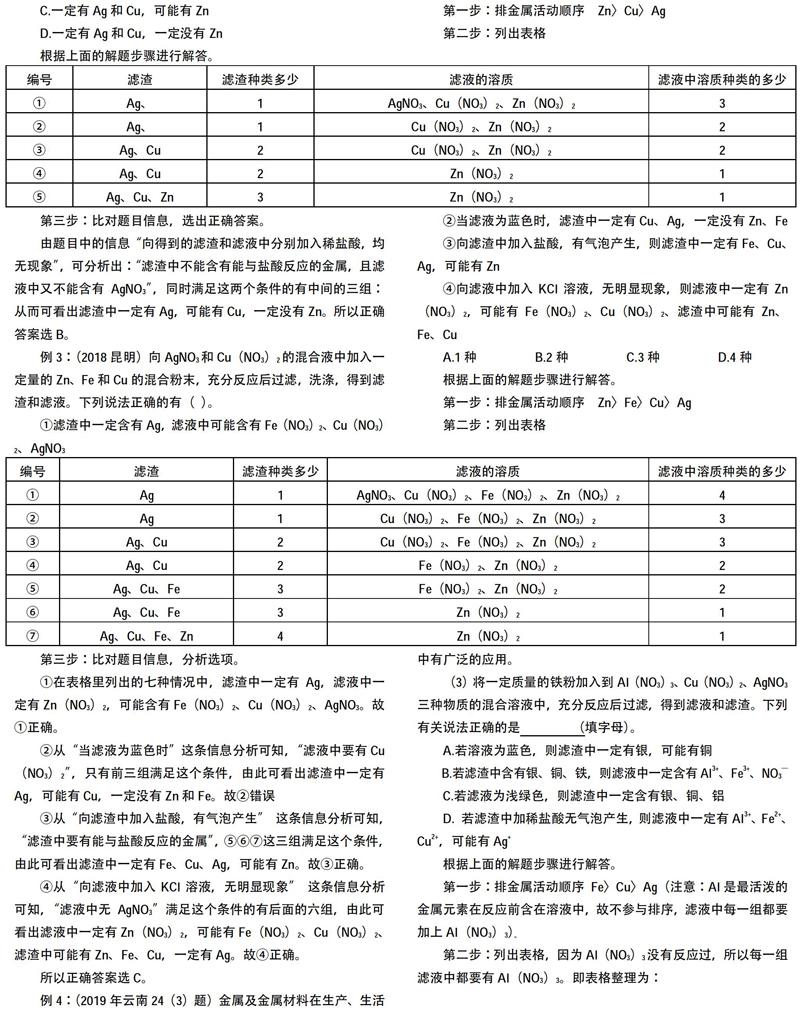
例3:将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤,洗涤,可得到滤渣和滤液,对滤液滤渣的成分分析:
根据反应发生的顺序规则是:最活泼的金属先与盐溶液发生置换反应,再到稍活泼的金属与盐溶液发生置换反应。按置换的先后顺序把反应方程式书写出来:
①Zn + 2 AgNO3 =2 Ag+ Zn(NO3)2 ②Cu + 2 AgNO3 =2Ag + Cu(NO3)2
由于题目中没有说明硝酸银溶液有多少,所以根据硝酸银溶液由少到多,可以分为5种情况来进行分析。
①硝酸银溶液的量极少,Zn没有反应完,第二个反应不能发生。故滤渣中有生成的Ag和没有反应的Cu及剩余的Zn;滤液中的溶质只有生成的Zn(NO3)2。
②硝酸银溶液的量稍多一点,Zn能反应完;但第二个反应不能发生。故滤渣中有Ag和没有反应的Cu,无Zn;滤液中的溶质有生成的Zn(NO3)2。
③硝酸银溶液的量再多些,Zn反应完了,但Cu没有反应完。故滤渣中有Ag和剩余的Cu,无Zn;滤液中的溶质有生成的Zn(NO3)2和Cu(NO3)2。
④硝酸银溶液的量更多些,Zn和Cu都反应完;故滤渣中只有Ag;滤液中的溶质有生成的Zn(NO3)2和Cu(NO3)2。
⑤硝酸银溶液的量是过量的,故滤渣中只有Ag;滤液中的溶质有生成的Zn(NO3)2和Cu(NO3)2及剩余的 AgNO3。
把上面的分析总结为下表
二、解题方法归纳
分析上面三个表格可以归纳出解题的方法:(下面A、B、C分别表示不同的金属单质,假设金属元素在盐溶液中化合价均为+2价)
第一步:先对题目中所涉及的金属元素进行金属活动性顺序的排列(由强到弱)。(注意如果最活泼的金属元素在反应前含在溶液中,則不参与排序)
A〉B〉C
第二步:把滤渣、滤液的成分制成下面的表格。
由表格可以找到规律:滤渣的成分从最不活泼的金属开始出现,种类依次增加,且每个种类数出现两次,种类最多时出现一次,按这种方式排列1,1,2,2,3;滤液成分的种类由最多依次减少,除种类最多的出现一次外,其余每个种类数出现两次,滤液中溶质种类多少排列与滤渣的刚好相反,即3,2,2,1,1。
第三步:根据题目中所给的信息,找出符合题目所描述的条件,选出正确答案。
三、应用示例
根据以上方法我们来看几个实例:
例1:(2019年河北)将一定量的Fe粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是( )。
A.滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2
B.滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2 和Cu(NO3)2
C.滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3
D.滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO3
根据上面的解题步骤进行解答。
第一步:排金属活动顺序 Fe〉Cu〉Ag
第二步:列出表格
第三步:比对题目信息,选出正确答案。
由题目中的信息“向滤渣中加入稀盐酸,无气泡产生”,可分析出“滤渣中不能含有能与盐酸反应的金属”,满足这个条件有前四组:从而可看出滤渣中一定有Ag,可能有Cu,滤液中一定有Fe(NO3)2,可能有AgNO3和Cu(NO3)2。所以正确答案选C。
例2:(2019年宁波)将一定量的铜锌混合粉末放入盛有AgNO3溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入稀盐酸,均无现象。则滤渣中( )。
A.一定有Ag,可能有Cu和Zn
B.一定有Ag,可能有Cu,一定没有Zn
C.一定有Ag和Cu,可能有Zn
D.一定有Ag和Cu,一定没有Zn
根据上面的解题步骤进行解答。
第一步:排金属活动顺序 Zn〉Cu〉Ag
第二步:列出表格
第三步:比对题目信息,选出正确答案。
由题目中的信息“向得到的滤渣和滤液中分别加入稀盐酸,均无现象”,可分析出:“滤渣中不能含有能與盐酸反应的金属,且滤液中又不能含有AgNO3”,同时满足这两个条件的有中间的三组:从而可看出滤渣中一定有Ag,可能有Cu,一定没有Zn。所以正确答案选B。
例3:(2018昆明)向AgNO3和Cu(NO3)2的混合液中加入一定量的Zn、Fe和Cu的混合粉末,充分反应后过滤,洗涤,得到滤渣和滤液。下列说法正确的有( )。
①滤渣中一定含有Ag,滤液中可能含有Fe(NO3)2、Cu(NO3)2、AgNO3
②当滤液为蓝色时,滤渣中一定有Cu、Ag,一定没有Zn、Fe
③向滤渣中加入盐酸,有气泡产生,则滤渣中一定有Fe、Cu、Ag,可能有Zn
④向滤液中加入KCl溶液,无明显现象,则滤液中一定有Zn(NO3)2,可能有Fe(NO3)2、Cu(NO3)2、滤渣中可能有Zn、Fe、Cu
A.1种 B.2种 C.3种 D.4种
根据上面的解题步骤进行解答。
第一步:排金属活动顺序 Zn〉Fe〉Cu〉Ag
第二步:列出表格
第三步:比对题目信息,分析选项。
①在表格里列出的七种情况中,滤渣中一定有Ag,滤液中一定有Zn(NO3)2,可能含有Fe(NO3)2、Cu(NO3)2、AgNO3。故①正确。
②从“当滤液为蓝色时”这条信息分析可知,“滤液中要有Cu(NO3)2”,只有前三组满足这个条件,由此可看出滤渣中一定有Ag,可能有Cu,一定没有Zn和Fe。故②错误
③从“向滤渣中加入盐酸,有气泡产生” 这条信息分析可知,“滤渣中要有能与盐酸反应的金属”,⑤⑥⑦这三组满足这个条件,由此可看出滤渣中一定有Fe、Cu、Ag,可能有Zn。故③正确。
④从“向滤液中加入KCl溶液,无明显现象” 这条信息分析可知,“滤液中无AgNO3”满足这个条件的有后面的六组,由此可看出滤液中一定有Zn(NO3)2,可能有Fe(NO3)2、Cu(NO3)2、滤渣中可能有Zn、Fe、Cu,一定有Ag。故④正确。
所以正确答案选C。
例4:(2019年云南24(3)题)金属及金属材料在生产、生活中有广泛的应用。
(3)将一定质量的铁粉加入到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是 (填字母)。
A.若溶液为蓝色,则滤渣中一定有银,可能有铜
B.若滤渣中含有银、铜、铁,则滤液中一定含有Al3+、Fe3+、NO3—
C.若滤液为浅绿色,则滤渣中一定含有银、铜、铝
D. 若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+、Cu2+,可能有Ag+
根据上面的解题步骤进行解答。
第一步:排金属活动顺序 Fe〉Cu〉Ag(注意:Al是最活泼的金属元素在反应前含在溶液中,故不参与排序,滤液中每一组都要加上Al(NO3)3)。
第二步:列出表格,因为Al(NO3)3没有反应过,所以每一组滤液中都要有Al(NO3)3。即表格整理为:
第三步:比对题目信息,分析选项。
A.从“若滤液为蓝色”这条信息分析可知,“滤液中要有Cu(NO3)2”,只有前三组满足这个条件,由此可看出滤渣中一定有Ag,可能有Cu,Fe。故A 正确。
B.从“若滤渣中含有银、铜、铁,”这条信息分析可知,符合此条件的只有第⑤组,由此可看出滤液中一定含有Al3+、Fe2+、NO3—。故B不正确。
C.从“若滤液为浅绿色” 这条信息分析可知,“滤液中要有Fe(NO3)2,但当Cu(NO3)2和Fe(NO3)2同时存在时,浅绿色表现不出来”故符合此条件的只有④和⑤两组。由此可看出滤渣中一定有Ag和Cu,可能有Fe。故C不正确。
D.从“向滤渣中加入盐酸,无气泡产生” 这条信息分析可知,“滤渣中不能
含有能与盐酸反应的金属”,①②③④这四组满足这个条件,由此可看出滤液中一定含有Al3+、Fe2+、NO3—,可能含有Cu2+,一定没有Ag+。故D不正确。
四、此方法优劣分析:
此方法使用起来正确性比较高,但不利于培养学生的分析能力和逻辑思维能力。
参考文献:
[1].各地近年《中考试题》
[2].九年级化学《教师用书》
[3].云南省中考考试说明》

