二维液相色谱法测定脑脊液中替加环素浓度及其临床应用
程彩奕,邓冬梅,王显凤,杨 征,幸海燕 (陆军军医大学大坪医院药剂科,重庆 400042)
颅内感染尤其是多重耐药菌感染具有进展快、反应重、治疗难度大、病死率高的特点,故提高颅内感染治愈率受到患者及临床的广泛关注。替加环素(TGC)作为首个甘氨酰四环素类抗菌药物,具有抗菌谱广、抗耐药活性强的特点,对临床上常见耐药菌(如鲍曼不动杆菌、产碳青霉烯酶肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌等)均有较好的疗效[1]。在耐药菌治疗药物不足的情况下,临床医生将TGC 用于颅内感染的治疗,此外,越来越多的案例报道称,TGC 可有效清除致病菌[2-3]。
TGC 成功治疗颅内感染与脑脊液中有效药物浓度密切相关,TGC 浓度监测对于提高颅内感染治愈率、精准指导临床合理用药具有重要意义[4]。本研究将利用二维液相色谱高效的自动化在线样品处理能力,建立脑脊液中TGC 浓度测定方法。该方法与已报道的质谱法相比,具有操作简便、成本低、抗干扰能力强、基质效应小等优势,脑脊液样品无需复杂的前处理,高速离心后直接进样,短时间内即可完成萃取、转移及分析,更易于临床推广应用。
1 仪器与试药
1.1 仪器
二维高效液相色谱由FLC-2 701 全自动二维液相色谱耦合仪(湖南德米特仪器有限公司)和LC-20A 色谱模块(日本岛津公司)构成;-80 ℃冰箱(美国赛默飞科技公司);十万分之一电子天平(德国赛多利斯仪器公司);涡旋混匀器(美国SI 仪器公司);低温高速离心机(美国贝克曼仪器公司)。
1.2 药品与试剂
TGC 对照品(北京百灵威科技公司,批号: 10-MWV-62-1);乙腈、甲醇、磷酸为色谱纯;高氯酸、氨水为分析纯;超纯水自制。
1.3 空白脑脊液
入住神经外科且未使用TGC 的患者,住院期间需开展脑脊液生化检查时留取或从留置腰大池/脑室引流管中适量抽取。
2 方法与结果
2.1 标准溶液的配制
精密称取TGC 对照品1.29 mg,用20 mg/ml 精氨酸水溶液定容至100 ml 容量瓶中,即得12.90 μg/ml的TGC 标准溶液。
2.2 样品前处理
预处理方法考察时,取脑脊液样品500 μl,直接离心、分别加入3 倍体积甲醇、乙腈、10%高氯酸沉淀蛋白,涡旋混匀5 min,13 000 r/min 离心10 min,取上清液进样分析。最终确定预处理方法为: 脑脊液样品13 000 r/min 离心10 min 后直接进样,采用外标法定量分析。
2.3 色谱条件
第一维色谱柱LC1 为Aston SNX5 苯基色谱柱(50 mm×4.6 mm,5 μm),流动相为磷酸铵(氨水调 pH7.5)-甲醇 (45∶55,V/V),第二维色谱柱 LC2为 Aston SC5 C18色谱柱(275 mm×4.6 mm,5 μm),流动相为磷酸铵(氨水调pH7.4)-磷酸铵(氨水调pH3.0)-乙腈(30∶50∶20,V/V/V),辅助流动相为纯化水。检测波长340 nm,色谱柱温40 ℃,进样量:200 μl,工作原理图见图 1,时间程序见表 1。
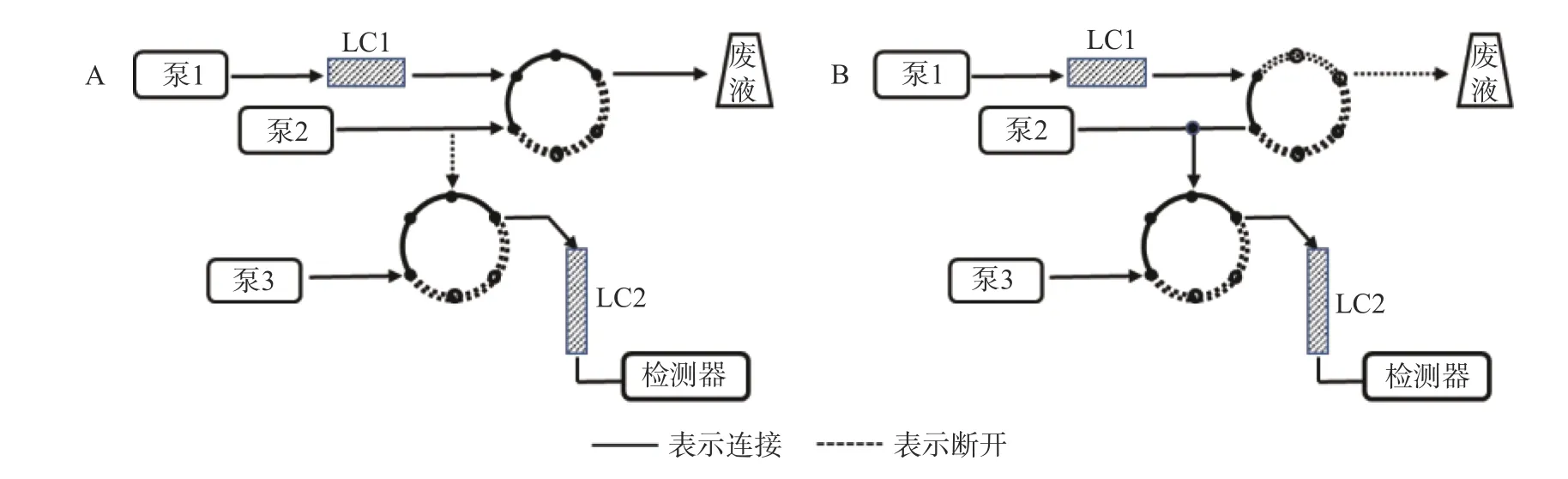
图1 二维液相工作原理示意图

表1 TGC 检测时间程序
2.4 方法学考察
2.4.1 专属性
分别制备空白脑脊液样品、含TGC 的标准脑脊液样品、患者用药后的脑脊液样品,进行二维液相分析,得到色图谱,观察有无内源性干扰,如图2所示。结果表明,TGC 的出峰时间9.38 min,脑脊液的内源性成分对TGC 的测定无干扰。
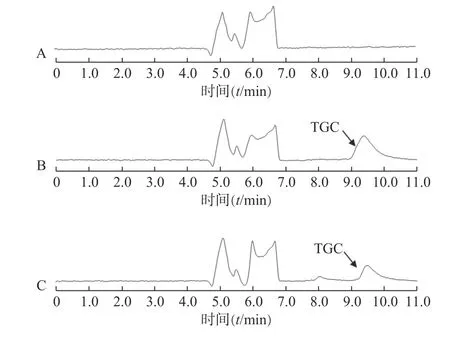
图2 脑脊液中 TGC 色谱图
2.4.2 线性关系
取不同体积TGC 标准溶液,加入空白脑脊液定容,配制成浓度为64.5、129.0、387.0、645.0、1 290.0 ng/ml 的系列对照溶液,按“2.2”项下操作后进样分析。以TGC 浓度为自变量(X),脑脊液中TGC 的峰面积为因变量(Y)进行线性回归,得回归方程为:Y=116.32X-3 223.6(r=0.999 8)。结果表明TGC 浓度在64.5~1 290.0 ng/ml 范围内线性关系良好,最低定量限为64.5 ng/ml。
2.4.3 精密度与准确度
分别配制含TGC 低、中、高及定量下限(225.0、450.0、900.0、64.5 ng/ml)4 个浓度的质控(QC)脑脊液样本,按“2.2”项下操作后进样分析。1 d 内每个浓度平行测定5 份QC 样品,连续测定3 d。将测得的峰面积代入“2.4.2”项下,计算各质控样品的浓度,并根据样本实际浓度计算本法的精密度与准确度。结果如表2 所示,日内、日间RSD 均小于5%,准确度均在98.80%~106.51%之间。可见本实验所建立的二维液相色谱法测定脑脊液中TGC 的精密度和准确度符合《中国药典》(2015 年版)检测要求[5]。

表2 脑脊液中测定 TGC 浓度的精密度与准确度 (%)
2.4.4 稳定性
配制“2.4.3”项下低、中、高及定量下限4 个浓度的QC 样品,每个浓度平行3 份,分别考察室温放置4 h、进样器放置6 h、反复冻融3 次、冰冻放置1 周后的稳定性。结果如表3 所示,表明上述条件对TGC 的检测结果无明显影响。
2.5 临床应用
本实验选取2 例接受TGC 治疗的多重耐药菌所致的重症颅内感染患者,脑脊液标本药敏试验均报告对TGC 敏感。患者1 接受说明书推荐剂量,即首剂静脉滴注100 mg,后以50 mg 每12 h 维持治疗。患者2 同样接受静脉给药,剂量为受试者1 的2 倍。达到稳定药物浓度后,留取两位受试者的脑脊液,按“2.2”项下操作后进样分析。受试者脑脊液中TGC 浓度分别为187.42、275.41 ng/ml。
3 讨论
3.1 蛋白沉淀剂的选择
甲醇、乙腈、10% 高氯酸是常用蛋白沉淀剂,本研究在空白脑脊液中分别加入3 倍体积上述沉淀剂,离心后与不加蛋白沉淀剂组比较,沉淀量无显著差异,且所得上清液与沉淀完全分离。现多项研究认为,因脑脊液中蛋白质含量低,故直接离心更利于生物样品的微量分析[6]。另直接离心法进样,脑脊液中TGC 浓度无稀释,也无其他前处理方法造成的误差,更利于临床样本的分析。
3.2 临床应用
TGC 对G-菌(如流感嗜血杆菌、大肠杆菌、对鲍曼不动杆菌等)MIC90为2~4 mg/L[7-8]。本试验中,无论是常规给药还是加倍剂量给药的患者,稳态脑脊液浓度显然均未起到杀菌作用,导致抗感染治疗效果不佳。这可能与以下因素有关:①TGC相对分子质量大而且水溶性强,很难进入到脑脊液中。有研究报道在血脑屏障正常的志愿者中,脑脊液中TGC 浓度仅为血浆的11%。而对于脑膜炎患者,血脑屏障通透性可增至33%~52%,这可能也是静脉注射TGC 成功治疗颅内感染的主要原因[9-10],但血脑屏障破坏的程度个体差异较大。②重症感染患者常伴有全身炎症反应、肝肾功能异常、多器官功能障碍综合征等,血药浓度低于正常水平,在同等穿透率的情况下,药物从血液进入脑脊液中的剂量减少[11]。③TGC 的蛋白结合率较高,为71%~87%[12]。颅内感染时,脑脊液蛋白水平提高,使游离的药物浓度降低[13]。④ 脑脊液引流量与药物清除率呈正相关,引流量越大,脑脊液中的药物浓度越低[14]。

表3 脑脊液中 TGC 在不同温度条件下的稳定性
目前,TGC 治疗方案大多参照说明书或文献报道推荐剂量,未考虑血脑屏障、脑脊液引流量、给药途径等患者自身因素的影响,使颅内TGC 的浓度不足、疗效不佳。本研究建立的脑脊液中抗菌药物TGC 的二维液相色谱分析方法简便、准确、稳定,对促进TGC 的合理使用、改善临床治疗结局具有重要意义。临床可根据脑脊液中TGC 的浓度,及时调整给药剂量或给药途径,提高治愈率,节省医疗费用。此外,也为研究TGC 在颅内的药动学及量效关系奠定了基础。

