真姬菇菌糠多糖促进肝癌HepG2细胞凋亡的功能和机制
张 山 董 超 吴澳华 焦凤萍 申 培 李 刚
山东第一医科大学(山东省医学科学院)公共卫生学院,山东 泰安 271016
真姬菇是常见的药食同源食用菌,也是我国食用菌工厂化生产的重要品种之一。其肉厚、味鲜、质韧、口感佳,还有独特的蟹香味,也被称为蟹味菇。在日本民间有“香在松茸、味在玉蕈”的说法。同时它还具有预防衰老、提高免疫力、抗癌、治疗便秘等多种药用价值[1]。
真菌多糖具有一定的抗癌作用和免疫活性[2],真姬菇多糖功能的研究多关注于其抗菌作用和抗氧化功能[3],而对其抗癌作用研究较少。本研究将采用细胞学实验检测真姬菇菌糠多糖对HepG2细胞增殖的抑制作用和促进HepG2细胞凋亡的作用,采用实时荧光定量PCR技术和Western blot法检测Wnt/β-catenin通路相关分子的基因和蛋白表达水平,以探索真姬菇菌糠多糖是否可以通过Wnt/β-catenin信号通路促进HepG2细胞的凋亡,从而为开发治疗肝癌的辅助药物提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞和多糖溶液 本实验中采用的HepG2细胞为本实验室保存,真姬菇菌糠多糖粉末由山东农业大学贾乐教授提供。
1.1.2主要试剂 1%青霉素链霉素、MTT、Trizol、SYBR Green实时荧光定量试剂盒等购自泰安联星科技有限公司,GAPDH、Bax、β-catenin和Caspase-3等抗体购自Abcam公司,DMEM培养基和胎牛血清FBS等试剂购自泰安华鹏生物科技有限公司。
1.2 方法
1.2.1多糖溶液配制 将5 g真姬菇菌糠多糖粉末溶于预热的10 mL双蒸水,37 ℃水浴中溶解1 h。3 000 r/min离心15 min,吸上清,采用0.45 μm、0.22 μm的滤膜2次过滤除菌。硫酸苯酚法测定多糖溶液浓度,将多糖溶液分装至1.5 mL Ep管中, -20 ℃冰箱冷冻保存。
1.2.2MTT法测定真姬菇菌糠多糖抑制HepG2细胞增殖 加入10%FBS和1%PS的DMEM培养基用于培养HepG2细胞,将HepG2细胞按2×104个/孔接种于96孔细胞培养板,5%CO2、37 ℃培养过液,加入真姬菇菌糠多糖溶液,设置25 μg/mL和50 μg/mL组、阴性对照组(细胞培养液),每组6个复孔。分别在第1、2、3、4和5天后,采用MTT法检测细胞的存活率,方法如下:每孔中加入5 mg/mL的MTT溶液20 μL,培养4 h,弃去上清,再加入150 μL二甲基亚砜(DMSO),注意避光、震荡10 min后采用酶标仪测定490 nm处的吸光度值,计算细胞的存活率,细胞存活率(%)=A药物组/A对照组×100%。
1.2.3真姬菇菌糠多糖对HepG2细胞形态的影响 将HepG2细胞接种于96孔细胞培养板,1×103个/孔,5%CO2、37 ℃培养过夜,加入真姬菇菌糠多糖溶液,终浓度为50 μg/mL,设立阴性对照组(细胞培养液)和阳性对照组(DOX,5 μmol/L)。继续5%CO2、37 ℃培养72 h,采用倒置显微镜观察HepG2细胞形态。
1.2.4实时荧光定量PCR法检测Wnt/β-catenin通路相关蛋白的基因表达水平 接种HepG2细胞至12孔板,2×105个/孔,分为真姬菇菌糠多糖50 μg/mL组和阴性对照组(细胞培养液),继续培养24 h后收集细胞,Trizol法提取细胞总RNA,逆转录为cDNA,再以cDNA为模板,采用 SYBR Green实时荧光定量PCR法检测β-catenin、Caspase-3、Bax和β-actin的 mRNA水平。引物:β-catenin正向5’-TTTGATGGAGTTGGACATGG-3’,反向 5’-CAGGACTTGGGAGGTATCCA-3’;Caspase-3正向 5’-GCCACGTCTCCACACATCAG-3’,反向 5’-TGGTGCATTTTCGGTTGTTG-3’;Bax正向5’-GATTTCATTTACGAGCGG-3’,反向5’-AGCGTCGA CCTCGAGATC-3’;β-actin正向5’-CAAGAGATGGCCACGGCTGCT-3’,反向5’-TCCTTCT GCATCCTGTCGGCA-3’。反应条件95 ℃、30 s,1个循环;95 ℃、5 s,60 ℃、10 s,40个循环。
1.2.5Western blot检测Wnt/β-catenin通路相关蛋白的表达情况 将HepG2细胞接种至六孔细胞培养板,5%CO2、37 ℃培养24 h后,加入真姬菇菌糠多糖溶液,终浓度为50 μg/mL。48 h后收集细胞用于Western blot检测。RIPA裂解细胞、离心、取上清、测定蛋白浓度。采用SDS-PAGE胶进行电泳、转膜、5%脱脂奶粉封闭1 h、孵育一抗(4 ℃过夜),采用TBST缓冲液清洗3次,每次放摇床约10 min;孵育二抗,室温摇床2 h;再用TBST缓冲液清洗3次,如上述方法。采用扫膜仪进行扫膜,观察结果。
1.3 统计学分析
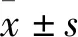
2 结 果
2.1 真姬菇菌糠多糖抑制HepG2细胞增殖
我们采用MTT法检测了真姬菇菌糠多糖对HepG2细胞增殖的抑制作用,对组间比较(F=30.956,P<0.001),时间效应 (F=155.487,P<0.001),交互作用(F=4.063,P<0.001)的统计分析结果见表1,结果表明50 μg/mL的真姬菇菌糠多糖具有明显的抑制细胞增殖作用,见图1。
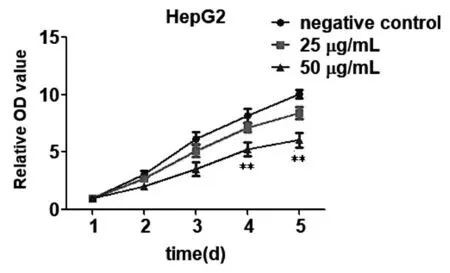
图1 真姬菇菌糠多糖对HepG2细胞增殖的抑制作用
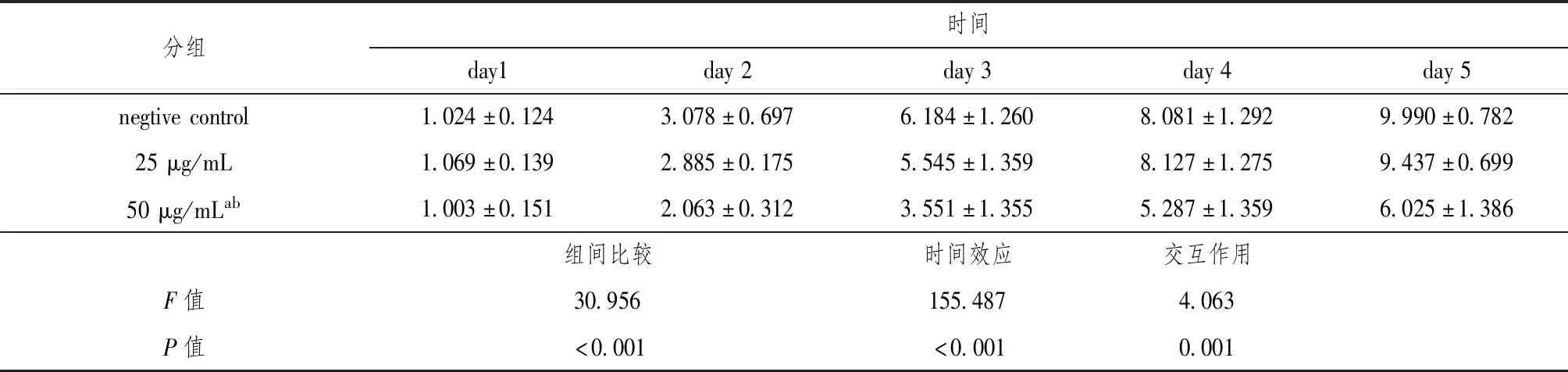
表1 阴性对照组与不同浓度多糖组数据的重复测量分析
2.2 真姬菇菌糠多糖对HepG2细胞形态的影响
同时,为了探索真姬菇菌糠多糖对HepG2细胞形态的影响,我们采用倒置显微镜放大200倍观察了真姬菇菌糠多糖溶液处理后的HepG2细胞形态,结果见图2,50 μg/mL真姬菇菌糠多糖处理后的HepG2细胞发生明显皱缩,其形态与阳性对照组(5 μmol/L DOX)相似,表明真姬菇菌糠多糖可能促使HepG2细胞发生了凋亡。
2.3 真姬菇菌糠多糖对HepG2细胞中Wnt/β-catenin信号通路相关基因表达影响
实时荧光定量PCR结果见表2,与阴性对照组相比50 μg/mL的真姬菇菌糠多糖可抑制HepG2细胞中β-catenin(t=3.940,P<0.05)和Caspase-3(t=3.847,P<0.05)基因的表达水平,但可以上调Bax(t=3.975,P<0.05)基因的表达水平,见图3。
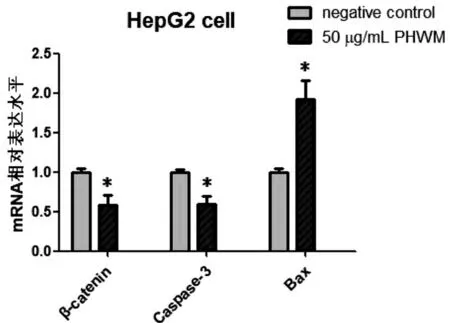
图3 真姬菇菌糠多糖对β-catenin、Caspase-3和Bax基因表达水平的影响(*为P<0.05)
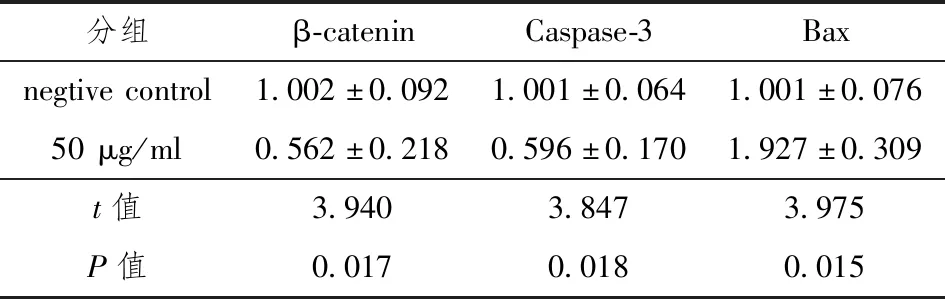
表2 β-catenin、Caspase-3和Bax实时荧光定量PCR检测数据及分析
2.4 真姬菇菌糠多糖对HepG2细胞中Wnt/β-catenin信号通路相关蛋白表达的影响
在本实验中,为了探索真姬菇菌糠多糖是否对Wnt/β-catenin信号通路产生影响,我们采用Western blot方法检测了Wnt/β-catenin信号通路相关蛋白β-catenin、Caspase-3及其下游分子Bax的表达情况。结果见图4,真姬菇菌糠多糖抑制HepG2细胞中β-catenin、Caspase-3的蛋白表达量,上调了通路下游分子Bax的表达。

图4 真姬菇菌糠多糖对β-catenin、Caspase-3和Bax蛋白表达量的影响
3 讨 论
肝癌的发病机制十分复杂,细胞信号转导通路的异常与肝癌的发生、发展密切相关[4-6]。Wnt/β-catenin信号通路是目前研究的热点,Wnt蛋白与跨膜受体结合后可将Wnt信号传递到胞质的蛋白上,然后经过一系列反应使细胞内的β-catenin水平升高、转位与细胞核内的转录因子结合,进而激活下游的靶基因发挥生物学功能[7-9]。细胞核内的转录因子包括:转录活化因子、T细胞转录因子等,下游的靶基因包括:survivin、细胞周期蛋白D1、c-myc等[10]。
Wnt/β-catenin信号通路中各成分突变或表达量的变化均可诱导肿瘤的发生,在乳腺癌、肝癌等恶性疾病中已检测出 Wnt/β-catenin信号通路发生了异常的活化[11-13]。吕君等[14]发现APS通过抑制Wnt/β-catenin信号通路导致Bcl-2的表达被抑制,最终导致HepG2细胞凋亡。包鸿慧等[15]研究发现真姬菇多糖具有免疫调节活性,可以作为免疫调节剂应用于医药行业。
Wnt/β-catenin信号通路在肿瘤的发生发展过程中发挥了重要的作用,是肿瘤靶向药物研究的热点。β-catenin不直接参与转录调控,通过与转录因子间的相互作用实现对下游相关基因表达的调控。Bax是水溶性相关蛋白,与Bcl-2同源,是Bcl-2基因家族中促细胞凋亡基因,Bax过度表达可拮抗Bcl-2抑制凋亡作用而使促进细胞发生程序性死亡。
在本实验中, MTT实验显示50 μg/mL的真姬菇菌糠多糖可以抑制HepG2细胞增殖,细胞形态观察发现真姬菇菌糠多糖处理后的HepG2细胞发生明显凋亡,结果表明真姬菇菌糠多糖具有促进HepG2细胞凋亡和抑制HepG2细胞增殖的双重作用。同时为了进一步探索机制,我们检测了真姬菇菌糠多糖对Wnt/β-catenin信号通路中相关基因和蛋白表达的影响,结果发现真姬菇菌糠多糖可抑制β-catenin和Caspase-3的表达,但可上调Bax的表达水平。因此,我们推测真姬菇菌糠多糖可能通过抑制Wnt/β-catenin信号通路相关基因的表达及上调其下游的Bax的表达而促进HepG2细胞发生凋亡,发挥抑制肝癌细胞增殖的作用,从而为将其开发为肝癌治疗的辅助药物提供了理论依据。

