粗壮脉纹孢菌高密度培养基的优化及补料策略
魏长浩,曹 余,邹新华,范亚苇,李 静,李红艳,邓泽元,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.播恩生物技术股份有限公司,江西赣州 341000)
粗壮脉纹孢菌(Neurosporacrassa)是本实验团队从江西本土发酵豆渣食品中分离筛选得到的一株具备较强的产酶能力和产类胡萝卜素能力的优良真菌[1]。目前,粗壮脉纹孢菌已在多种农副产品的发酵利用中取得好结果。叶俊等[2]利用粗壮脉纹孢菌固态发酵豆渣发现,在发酵48 h后,豆渣中的粗纤维含量得到了有效的降低,并且粗蛋白、可溶性总糖等营养成分都有提高。任志青等[3]以豆粕为发酵底物,发现在发酵过程中纤维素得到了有效的降解,形成了糖类物质;并且植酸等抗营养因子的含量也都有显著的下降。于新颖[4]利用它来发酵菜籽粕,在利用粗壮脉纹孢菌固态发酵菜籽粕时也得到了相似的结果,并得出结论,利用粗壮脉纹孢菌固态发酵菜籽粕可以很好地改善菜籽粕的营养水平,提高菜籽粕的利用价值。不仅如此,Zhou等[5]还通过研究发现粗壮脉纹孢菌发酵豆渣中提取的低聚糖具有出色的益生作用,说明经粗壮脉纹孢菌发酵后的豆渣很有可能是极具潜力的益生食品;李静等[1]以及杜佳等[6]通过对发酵产类胡萝卜素进行提取以及相关活性的测定,发现粗壮脉纹孢菌发酵后可以提取得到较高含量的类胡萝卜素,并且具有较高的抗氧化活性。此外粗壮脉纹孢菌高产纤维素酶以及蛋白酶的特性也是值得关注的方面,也正是因为高活性的酶系,为粗壮脉纹孢菌更好地发酵农副产物奠定了良好的基础[7-8]。
高密度培养(HCDC,high cell density culture)是一种提高菌体密度的发酵方式,它没有确切的意义,本身只是一个相对的概念[9]。高密度培养与常规培养方式相比,最显而易见的优势就是可以收获大量的菌体,大大提高生产效率和营养物质利用率、缩短生产周期、减少设备投资,从而降低成本、节约资源、减少污染,提高综合生产效率[10]。而合适的培养基组成与培养方式是实现菌体高密度培养的重要因素。就培养基组成而言,在分批培养过程中,当培养体系中的营养成分(包括碳源、氮源和无机盐等)的浓度超过某一临界值时,微生物会为维持胞内环境而消耗部分能量,其结果会明显抑制菌体生长,降低菌体得率[11]。因此为实现高密度培养,合适的培养基组成不可或缺。Wang等[12]通过优化鼠李糖杆菌最佳培养基组成,在最优条件下细胞密度提高到4.5×109CFU/mL,比乳酸细菌培养基(MRS培养基)高约9倍。就培养方式而言,补料分批培养是实现高密度培养的重要手段[13]。补料分批培养是通过补加新鲜培养液,为微生物提供充足的养分,从而使细胞达到较高密度的培养方式,相对于其他培养方式,补料分批培养可以削弱底物抑制,稀释有毒代谢物,最终达到细胞高密度培养。Chen等[14]发现,通过补加含C、N、P和微量元素的补料培养基对红曲霉进行分批补料培养,比常规分批培养菌体量提高四倍。Ji等[15]也发现,利用分批补料培养高山被孢霉能显著缩短培养周期并提高代谢产物量。
在国内外已报道的研究中,粗壮脉纹孢菌所表现出的改善农副产品营养价值的作用十分可观,但在以往的固态培养方式中粗壮脉纹孢菌的菌体产量十分有限,限制了其在大批量工业生产中应用,因此研究粗壮脉纹孢菌的高密度培养技术具有极大的应用价值。本研究从优化粗壮脉纹孢菌培养基组成入手,对高密度培养基的碳源、氮源、无机盐的组成与含量进行了优化,然后对比了补料时间、补料次数和补料碳氮比对粗壮脉纹孢菌生物量的影响,选择一种能够积累较高菌体生物量的补料培养策略。旨在实现粗壮脉纹孢菌菌体的高密度培养,为工业生产中的制种提供参考,为粗壮脉纹孢菌这一优良菌种工业化应用奠定基础。
1 材料与方法
1.1 材料与仪器
粗壮脉纹孢菌(NeurosporacrassaCGMCC NO.3088) 由本实验团队筛选分离并保存;马铃薯葡萄糖琼脂培养基(PDA)、玉米浆(发酵型)、酵母粉(生化试剂) 上海索莱宝生物科技有限公司;蛋白胨(生化试剂) 上海盛思生化科技有限公司;所有盐类试剂均为国产分析纯。
HPX-160BSH恒温恒湿箱 上海新苗医疗器械制造有限公司;DGG-9140A型电热鼓风干燥器 上海精宏实验设备有限公司;FA1104型电子天平 上海精天电子仪器厂;HD-650桌上型超净工作台 苏州安泰空气技术有限公司;BSD-YF2200智能精密摇床 上海博迅实业有限公司医疗设备厂;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;ELX800全自动酶标仪 美国BioTek公司;PHS-3C pH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 培养方法 菌种活化:将甘油保藏的菌种接入沙氏液体培养基中,于30 ℃、140 r/min下摇瓶培养72 h,连续活化3次。
种子液的制备:将菌种接种至马铃薯琼脂糖培养基试管斜面上,于30 ℃、湿度70%、光照条件下培养96 h,在无菌操作台内用接种环刮取孢子并与水混合,混合液过滤除去菌丝后加水稀释成1×106个/mL孢子悬液。
发酵培养:配制液体发酵培养基[14](葡萄糖40 g/L、蛋白胨10 g/L、磷酸二氢钾4 g/L,七水合硫酸镁0.5 g/L,七水合硫酸锌0.01 g/L,氯化钾0.5 g/L,硫酸锰0.03 g/L),按80 mL的装液量分装于250 mL锥形瓶中,灭菌后接种4 mL 1×106个/mL孢子悬液。置于30 ℃、140 r/min的恒温摇床中培养96 h。
1.2.2 菌密度测定及菌体生物量的测定 采用血球计数板法进行计数,计算种子液中的菌体密度。
菌体生物量的测定参照Chen等[14]及刘靖[16]的方法,将发酵液过滤,并用大量蒸馏水洗涤残留物,获得残留菌体,于80 ℃下烘干至恒重得到菌丝体干重(DW,dry weight)。
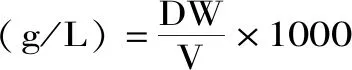
式中:DW表示菌丝体干重,g;V表示培养基的体积,mL。
1.2.3 生长曲线的绘制 在基础培养基及培养条件的情况下对粗壮脉纹孢菌进行液态摇瓶培养,从0 h开始至120 h结束,每间隔6 h 取样测定菌体生物量并绘制生长曲线。
1.2.4 发酵培养基的优化
1.2.4.1 不同碳源对粗壮脉纹孢菌高密度培养的影响 在保证氮源和无机盐种类及所有营养物质浓度不变的情况下,使用乳糖、蔗糖、葡萄糖、麦芽糖、可溶性淀粉作为不同的碳源替换发酵培养基中的碳源,在基础培养条件下培养96 h,并对发酵液进行生物量的测定、比较分析,确定最佳碳源。
1.2.4.2 不同氮源种类对粗壮脉纹孢菌高密度培养的影响 在最佳碳源条件下,保证无机盐种类及所有营养物质浓度不变,使用硫酸铵、蛋白胨、酵母粉、玉米浆、硝酸钠作为不同的氮源替换发酵培养基中的氮源,在基础培养条件下培养96 h,并对发酵液进行生物量的测定、比较分析,确定最佳氮源。
1.2.4.3 不同蔗糖含量对粗壮脉纹孢菌高密度培养的影响 在最佳碳源和最佳氮源条件下,保证无机盐种类、氮源浓度及无机盐浓度不变,使用10、20、40、60、80、100 g/L作为不同蔗糖浓度替换发酵培养基中的葡萄糖含量并保持其余营养物质浓度不变,在基础培养条件下培养96 h,对发酵液进行生物量的测定、比较分析,确定最佳蔗糖含量。
1.2.4.4 不同蛋白胨的含量对粗壮脉纹孢菌高密度培养的影响 在最佳碳源、最佳氮源以及最佳碳源浓度的条件下,保证无机盐种类及浓度不变,使用10、20、30、40、50、60 g/L作为不同蛋白胨浓度替换发酵培养基中的蛋白胨含量,在基础培养条件下培养96 h,并对发酵液进行生物量的测定、比较分析,确定最佳蛋白胨的含量。
1.2.4.5 不同无机盐含量对粗壮脉纹孢菌高密度培养的影响 在最佳碳氮源以及最佳碳氮源浓度条件下,除考察因素外其余无机盐种类及浓度不变,以KH2PO4、MgSO4·7H2O、ZnSO4·7H2O、KCl、MnSO4·H2O为考察因素分别设定浓度梯度KH2PO4(1、3、5、7、9、11 g/L)、MgSO4·7H2O(0.05、0.1、0.3、0.5、0.7、0.9 g/L)、ZnSO4·7H2O(0、0.01、0.06、0.11、0.16、0.21、0.26 g/L)、KCl(0、0.1、0.3、0.5、0.7、0.9 g/L)、MnSO4·H2O(0、0.03、0.06、0.09、0.12、0.15 g/L),考察不同无机盐及其浓度对菌体生物量的影响。
1.2.5 响应面法优化发酵培养基 利用Box-Benhnken(BB)实验方法[17],选择碳源含量、氮源含量、磷酸盐含量以及硫酸锌含量为关键因素,采用4因素3水平进行响应面分析,应用 Design-Expert 11软件设计并分析实验结果(每组实验重复三次),得到最适合粗壮脉纹孢菌生长的培养基配方。
1.2.6 粗壮脉纹孢菌高密度培养补料策略的确定
1.2.6.1 补料时间的确定 通过粗壮脉纹孢菌摇瓶分批发酵动力学曲线确定补料时间。以最适培养基对粗壮脉纹孢菌进行培养,从0 h开始至120 h结束,每间隔12 h 取样测定菌体生物量及残糖含量,并绘制动力学曲线。
1.2.6.2 补糖浓度的确定 选取40、80、120、160、200、400 g/L的蔗糖溶液作为不同糖浓度的补料液,在补料时间24~96 h内,每隔12 h向揺瓶中补加10 mL不同糖浓度的补料液,培养至108 h,对发酵液进行生物量的测定,并设置对照组,观察不同补糖浓度对粗壮脉纹孢菌生长的影响,确定最佳补糖浓度。
1.2.6.3 补料次数的确定 选取补料1次(24 h补料一次)、补料3次(每隔36 h补料一次)、补料4次(每隔24 h补料一次)、补料7次(每隔12 h补料一次)作为不同补料次数,在补料时间24~96 h内,每次向揺瓶中补加200 g/L的蔗糖溶液10 mL,培养至108 h,对发酵液进行生物量的测定,并设置对照组,观察不同补料次数对粗壮脉纹孢菌生长的影响,确定最佳补料次数。
1.2.6.4 补料碳氮比的确定 在补料液中保持碳源浓度不变,选取1∶0、2∶1、5∶1、10∶1、20∶1作为不同补料碳氮源浓度比,分别在培养24、60、96 h时向揺瓶中补加10 mL不同碳氮浓度比的补料液,培养至108 h,对发酵液进行生物量的测定,并设置对照组,观察不同补料碳氮浓度比对粗壮脉纹孢菌生长的影响,确定最佳补料碳氮浓度比。
1.2.7 糖含量的测定 采用苯酚-硫酸法测定发酵液中糖的含量[18]。取1 mL样液加入1 mL 6%的苯酚及5 mL的浓硫酸,摇匀,静置反应20 min后于490 nm测定其吸光值。使用不同浓度的葡萄糖溶液绘制标准曲线,蒸馏水为空白对照,对发酵液样品中糖含量进行定量。
葡萄糖标准曲线:y=5.6743x+0.086(R2=0.9968)
1.3 数据处理
使用Design Expert 11进行响应曲面设计和分析,用Origin 2017软件制图并对菌体生长曲线进行Logistics方程拟合以及生长速率的计算,用SPSS 19软件进行显著性分析(P<0.05),结果以(平均值±标准差)表示。
2 结果与分析
2.1 菌丝体生长曲线
粗壮脉纹孢菌的生长曲线见图1。图1表明粗壮脉纹孢菌的生长规律符合微生物生长一般规律。从 0~6 h,菌体浓度上升缓慢,菌体处于迟缓期,从第6 h开始,菌体生物量迅速上升,从 0.125 g/L骤增至96 h的6.088 g/L,该时间段包括了菌种的对数生长期,菌体细胞高速生长繁殖;从96 h 开始,菌体生长趋于平稳,至120 h实验结束,该阶段菌种处于稳定期,即新繁殖的菌体与衰亡的菌体数相等,或正生长与负生长相等的动态平衡中。造成该现象的原因是由于培养基中营养物质的消耗,毒性代谢产物积聚,pH下降,使菌体的繁殖速度渐趋减慢[19]。因此确定菌体生长时间为0~96 h。
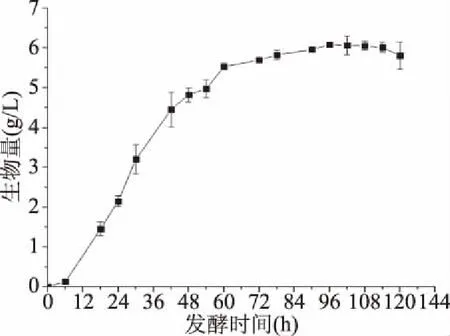
图1 粗壮脉纹孢菌培养生长曲线
2.2 发酵培养基成分的优化
2.2.1 碳源的选择 由图2可知,不同种类的碳源对粗壮脉纹孢菌生物量的影响差异明显,其中利用蔗糖作为碳源能获得最大的生物量7.238 g/L,而淀粉、麦芽糖和葡萄糖的生物量分别只有6.256、5.963、5.088 g/L,均低于蔗糖的生物量。当使用乳糖作为碳源时,菌体生物量为最低值1.219 g/L,说明乳糖最不适合作为粗壮脉纹孢菌生长的碳源。综上所述,选择蔗糖作为培养基碳源进行下一步优化。
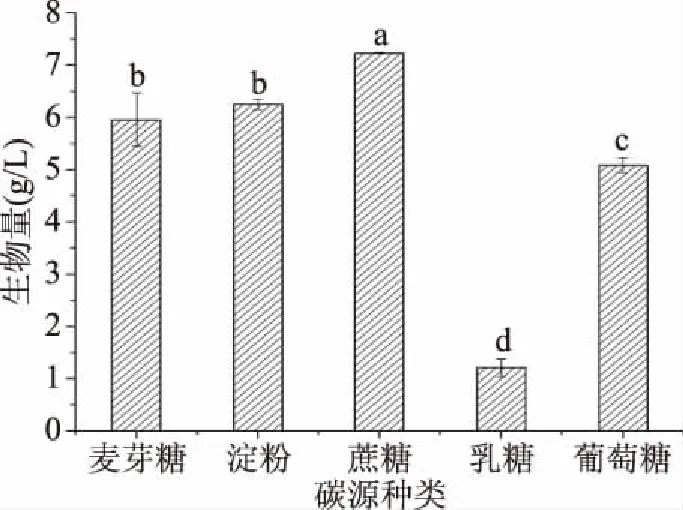
图2 不同碳源对粗壮脉纹孢菌生物量的影响
2.2.2 氮源的选择 由图3可知,蛋白胨相对于其他四种氮源来说,能收获最大的菌体量7.450 g/L,其次是酵母粉6.944 g/L和玉米浆5.150 g/L,因此选择蛋白胨作为培养基氮源进行下一步优化。从图中还可以看出,以有机氮源的玉米浆、酵母粉以及蛋白胨为培养基唯一氮源时,所获得的菌体量要远大于无机氮源硫酸铵和硝酸钠作为培养基氮源。魏培莲等[20]在进行发酵红曲霉培养基优化过程中也发现相对于无机氮源硝酸铵,蛋白胨、酵母粉和牛肉膏等有机氮源作为唯一氮源时能得到更大的生物量。结果表明,粗壮脉纹孢菌在有机氮源作为唯一氮源的情况下能获得更好的生长。
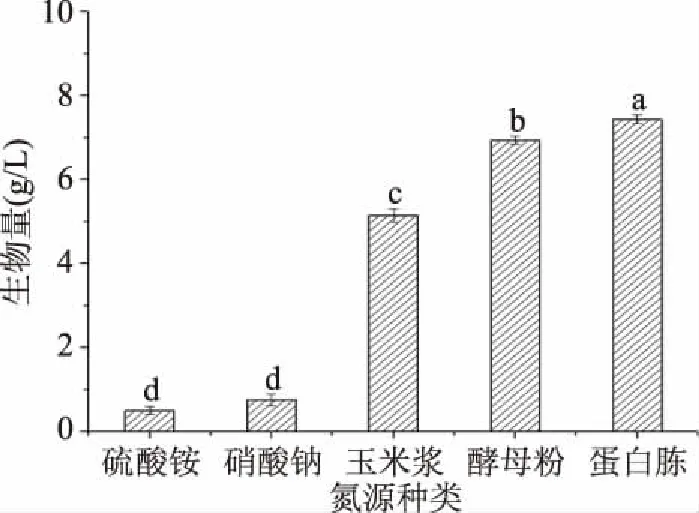
图3 不同氮源对粗壮脉纹孢菌生物量的影响
2.2.3 碳源、氮源、无机盐添加水平的选择
2.2.3.1 蔗糖添加量的选择 从图4中可以看出,随着蔗糖添加量的提升,菌体生物量呈现一个先增后减的趋势,在蔗糖浓度为40 g/L时,菌体生物量达到最高8.856 g/L。说明过低的蔗糖含量可能导致营养物质不足,菌体的生长受到限制,反之过高的糖含量其本身就会直接限制菌体的生长[11]。因此蔗糖添加量选择40 g/L时用来发酵培养效果最佳。
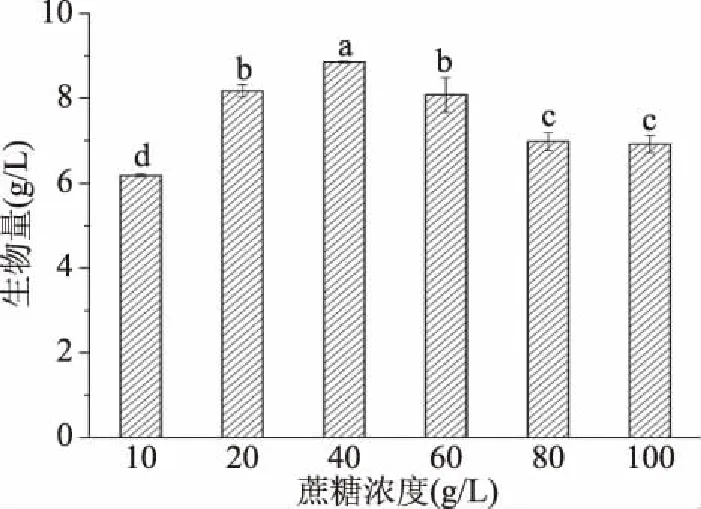
图4 不同蔗糖浓度对生物量的影响
2.2.3.2 蛋白胨添加量的选择 从图5中可以看出,随着蛋白胨添加量的增加,生物量呈现与不同蔗糖浓度生物量相近的变化趋势,当蛋白胨添加量选择40 g/L时,可以获得最大的生物量10.506 g/L,用来发酵培养效果最佳。
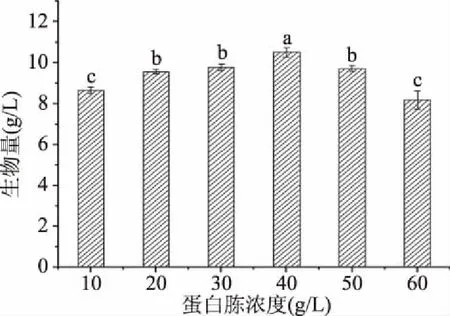
图5 不同蛋白胨浓度对生物量的影响
2.2.3.3 无机盐添加量选择 由图6(a)和图6(c)可知,五种无机盐中,磷酸二氢钾和硫酸锌随着浓度变化对生物量有着明显的影响,磷酸二氢钾浓度为3 g/L时生物量达到最大,硫酸锌为0.01 g/L时生物量达到最大。硫酸锰和氯化钾在一定的浓度内,对生物量的影响基本保持一个范围内波动。硫酸镁则随着浓度的增加,生物量呈现先增加后平稳的趋势,无法确定峰值,说明适量就可。因此确定硫酸镁、硫酸锰、氯化钾的添加量分别为0.1、0.03、0.1 g/L,并选择磷酸二氢钾和硫酸锌两种无机盐进行下一步的优化。
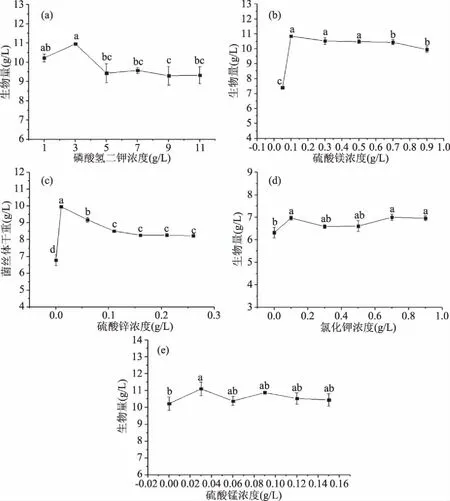
图6 不同种类无机盐及浓度对粗壮脉纹胞菌生物量的影响
2.2.4 响应面优化试验 通过上述单因素实验,确定了蔗糖添加量、蛋白胨添加量、磷酸二氢钾添加量以及硫酸锌添加量作为实验因素,其他培养基成分按硫酸镁0.1 g/L、硫酸锰0.03 g/L、氯化钾0.1 g/L添加。利用Design Expert 11软件进行响应曲面实验设计,详见表1。

表1 响应面试验因素和水平表
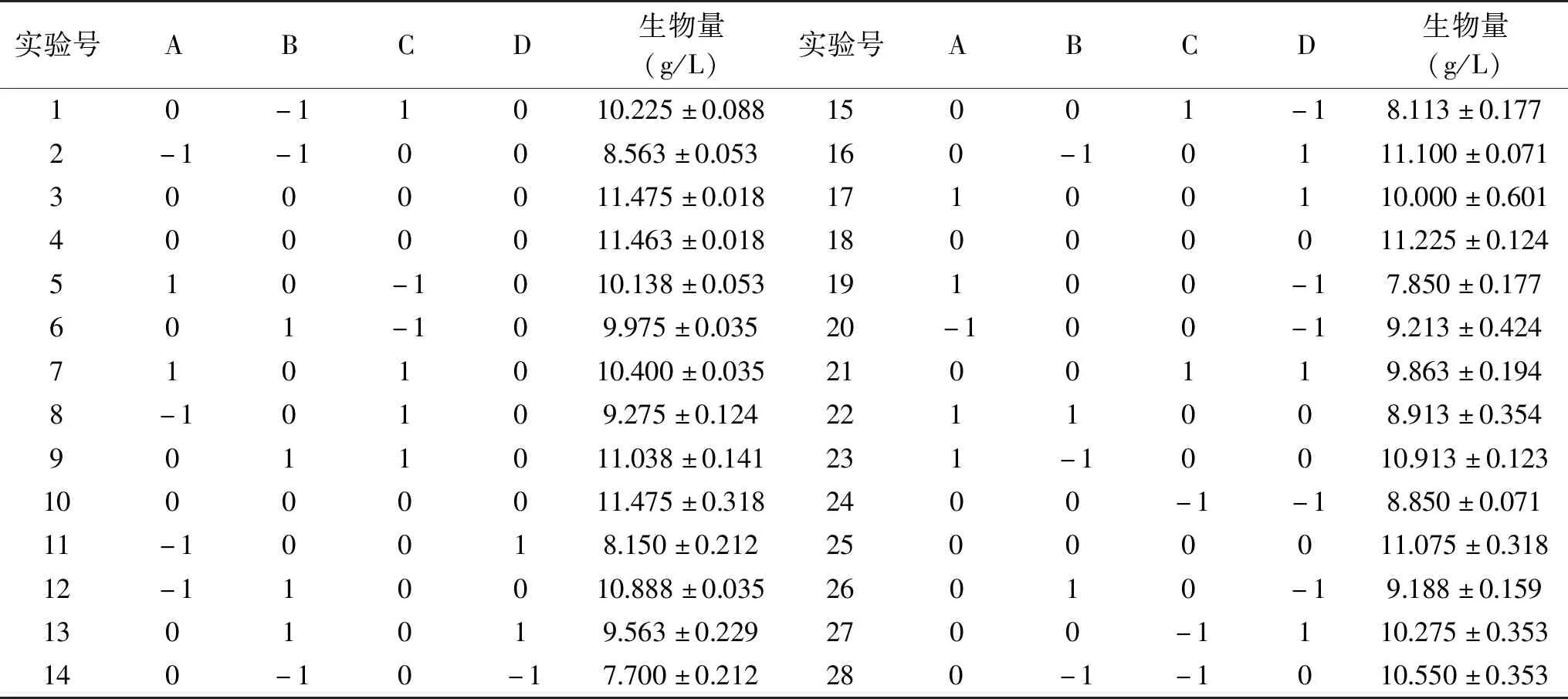
表2 响应面试验设计方案及结果
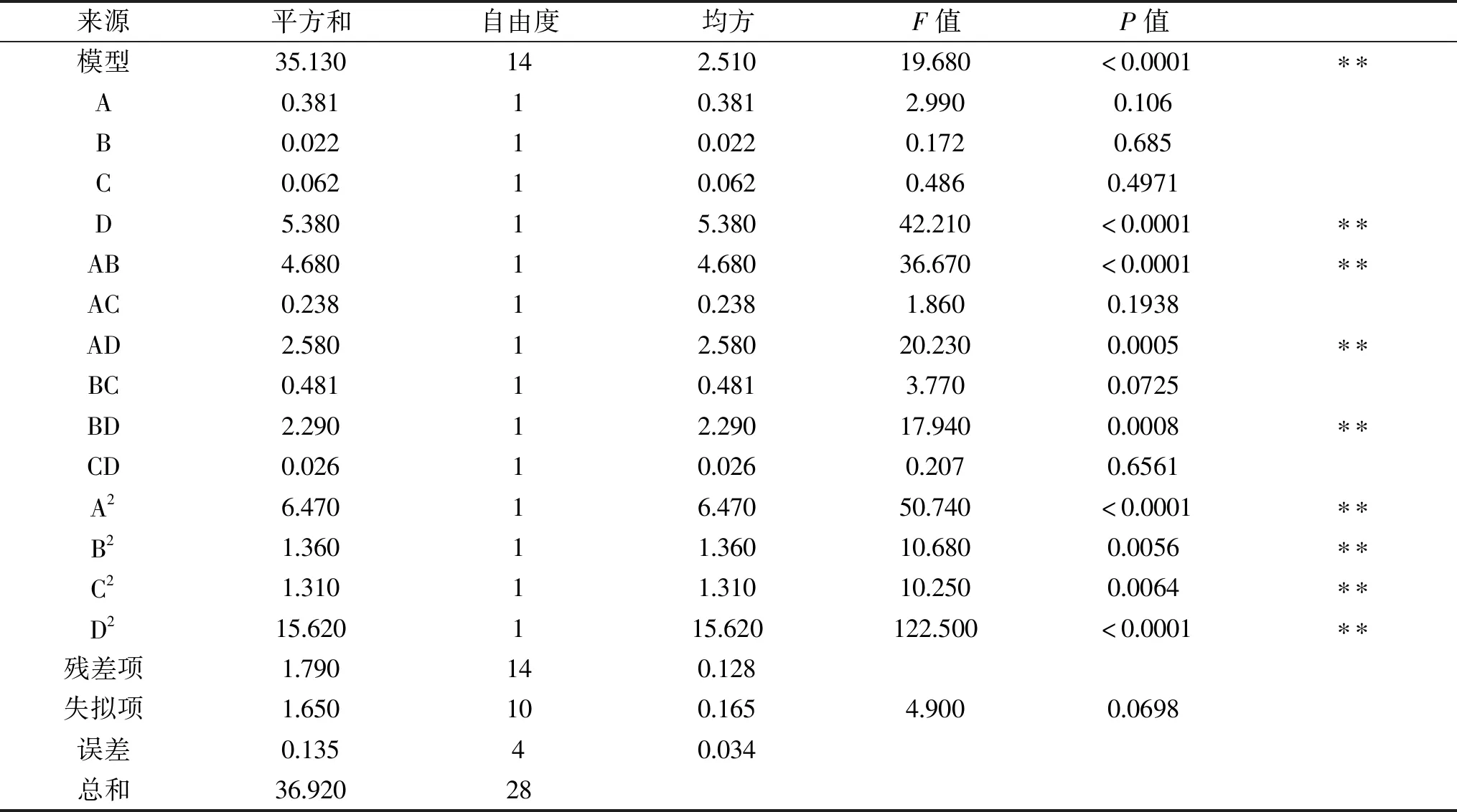
表3 响应面二次方模型方差分析
由表3可知,该实验所构建的模型P<0.0001,极为显著;且拟合模型的失拟项P值为0.0698>0.05,不显著;结果表明模型在整个回归区域内的拟合度高,与实际情况相似。同时对实验结果进行方差分析,得到模型拟合方程为:生物量(g/L)=11.3425+0.178125A+0.0427083B-0.071875C+0.669792D-1.08125AB+0.24375AC+0.803125AD+0.346875BC-0.75625BD+0.08125CD-0.998854A2-0.458229B2-0.448854C2-1.55198D2。模型的确定系数R2=0.9516,校正后的系数R2=0.9033,也说明模型拟合程度良好。而且从各项的方差分析中可以看出,各因素对生物量的影响从大到小排序为:D>A>C>B,表中D,AB,AD,BD,A2,D2,B2,C2对响应值影响极显著(P<0.01)。
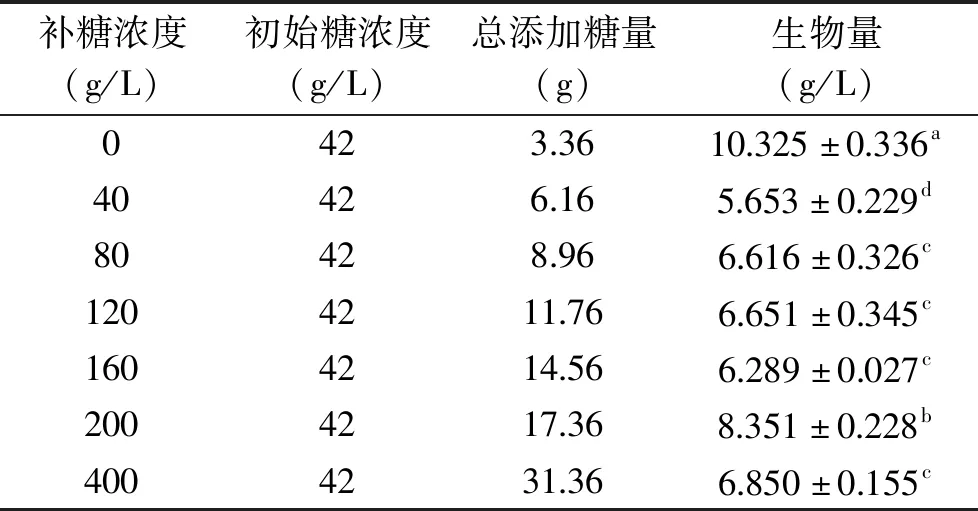
表4 不同补糖浓度对粗壮脉纹孢菌生物量的影响

表5 不同补料次数对粗壮脉纹孢菌生物量的影响
由图7可知,AB、AD、BD交互作用的等高线呈椭圆形,说明其对响应值影响显著,与方差分析结果一致。根据响应曲面模型计算,当蔗糖浓度为42.356 g/L、蛋白胨浓度为35.938 g/L、磷酸二氢钾浓度为2.614 g/L、硫酸锌浓度为0.038 g/L时,可以得到最大的菌体生物量11.483 g/L。使用响应曲面模型得到的最佳培养基进行验证实验,实际条件为:蔗糖42 g/L,蛋白胨36 g/L,磷酸二氢钾2.6 g/L,硫酸锌0.038 g/L,硫酸镁0.1 g/L,硫酸锰0.03 g/L,氯化钾0.1 g/L,得到的菌体生物量为11.295 g/L,与模型预测值接近,由此可知,基于响应曲面法优化得到的粗壮脉纹孢菌最佳培养基组成数据可靠,具有实际利用价值。
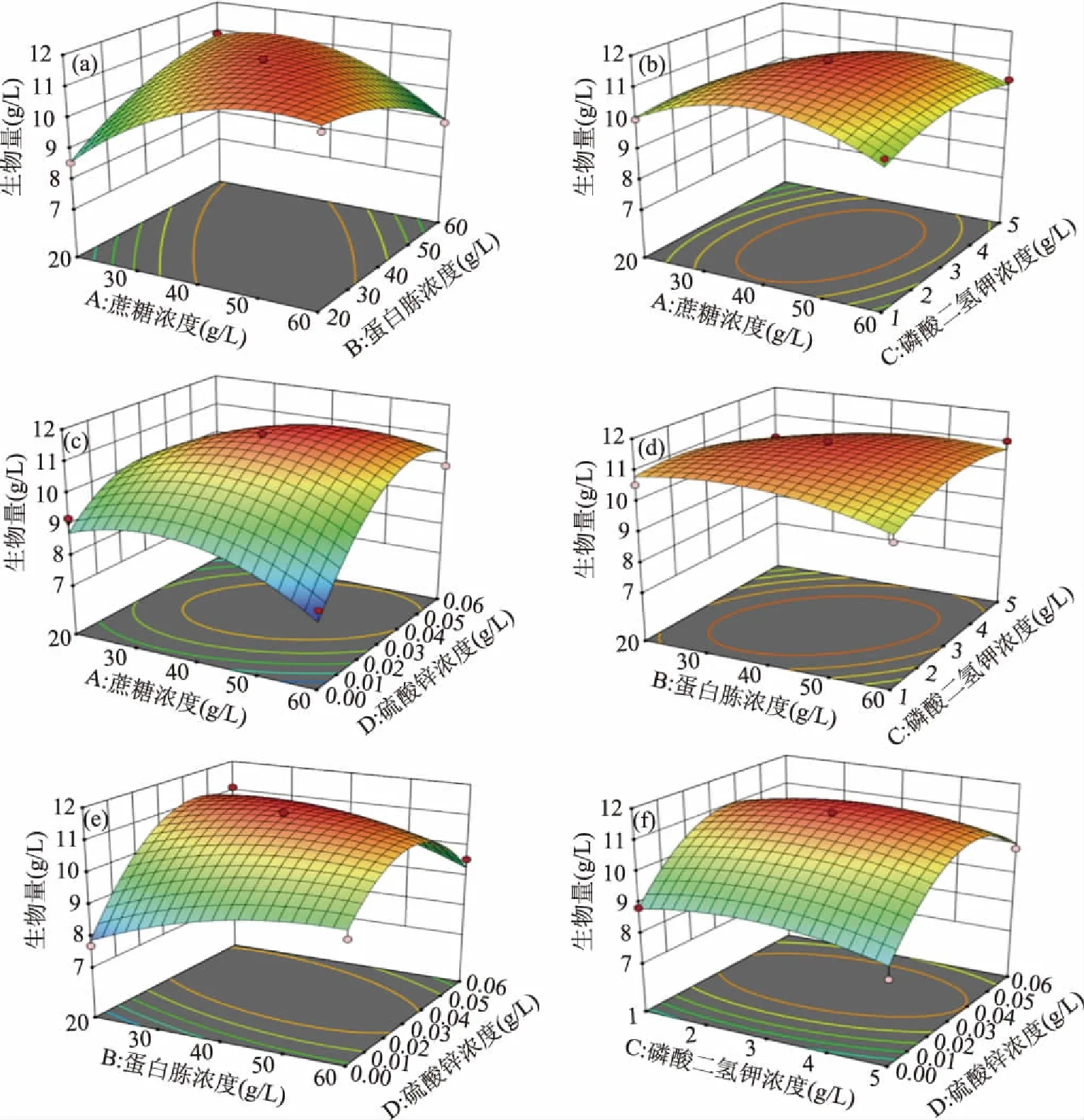
图7 各因素交互作用响应曲面及等高线图
2.2.5 粗壮脉纹孢菌分批补料策略的确定
2.2.5.1 粗壮脉纹孢菌补料时间的确定 由图8、图9可以看出,菌体生长在12 h之前都处于一个十分缓慢的阶段,培养基的糖含量并没有大幅度的下降;12 h以后,菌体生长速度加快,糖消耗量也逐渐增多,表明菌体生长进入了指数期;培养至96 h时菌体生物量达到了最大值11.295 g/L,之后菌体生长进入稳定期,同时作为碳源的糖类物质含量下降到极少。结合糖消耗曲线以及菌体生长速率曲线来看,12~36 h的糖消耗速率极快,生长速率也极快的增加,说明这一段时间菌体在高速生长。36 h后生长速率开始下降,说明糖含量的降低已经对菌体的生长造成了影响[21]。因此,综合考虑确定补料的时间为24~96 h,每12 h进行一次补料,培养至108 h停止。
2.2.5.2 粗壮脉纹孢菌分批补料碳源浓度的确定 由表4可知,通过摇瓶分批补料的方式确定最适补糖浓度为200 g/L,培养108 h后可收获8.351±0.228 g/L菌丝体,且发现过高和过低的补糖浓度均会限制粗壮脉纹孢菌的生长。与不添加补料培养基的对照组比较生物量明显降低,原因是补加的培养基会稀释原培养基中的菌体密度并且导致培养基中各类营养成分发生变化。王有旭[22]在黑曲霉的补料分批培养产柠檬酸的研究中发现,随着补料次数的增加导致补料量过大,发酵指数和转化率都呈现逐渐降低趋势,残糖含量也会随之上升。因此考虑通过改变补料次数,来减弱补料这一方式对菌体带来的不利影响,从而获得更多的生物量以达到高密度培养的目的。
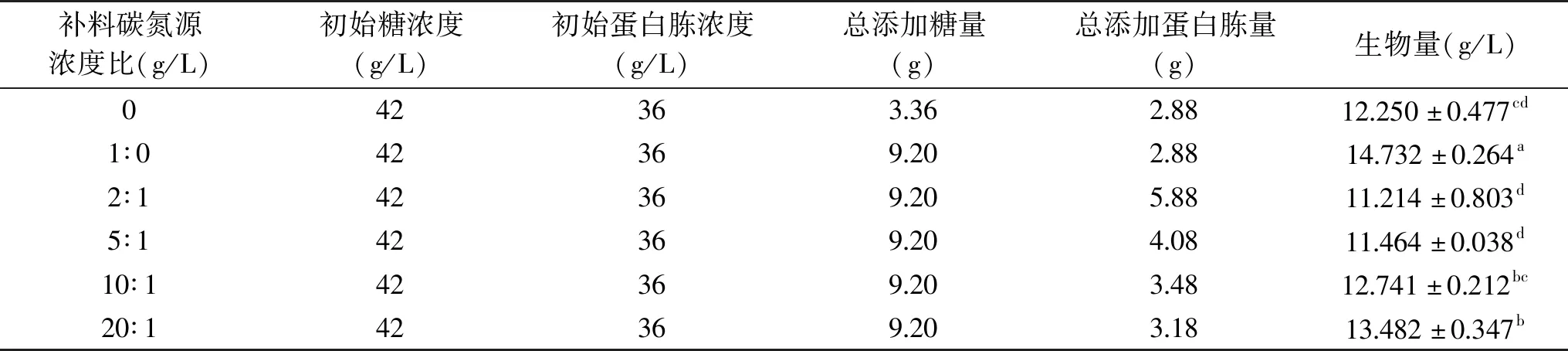
表6 不同补料碳氮比对粗壮脉纹孢菌生物量的影响
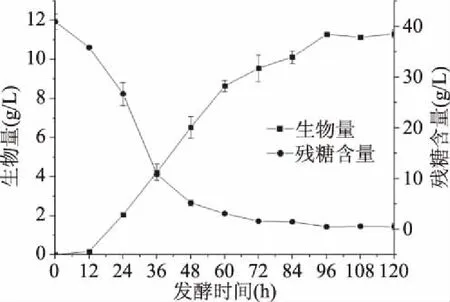
图8 最适培养基下的粗壮脉纹孢菌生长曲线及不同发酵时间的残糖含量
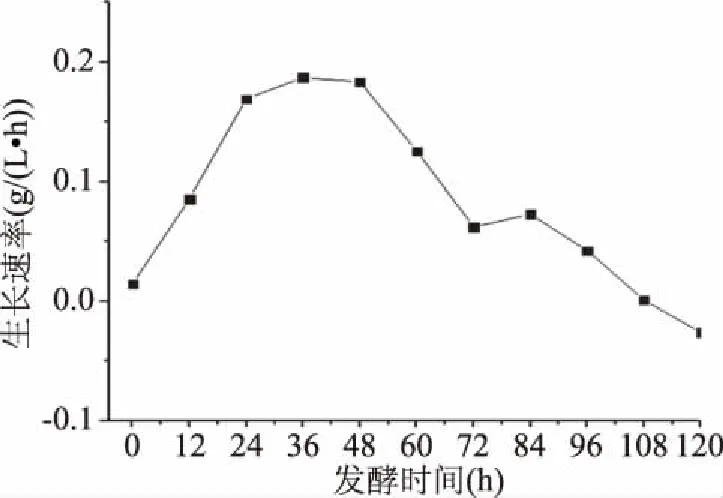
图9 粗壮脉纹孢菌生长速率曲线
2.2.5.3 粗壮脉纹孢菌分批补料次数的确定 由表 5 可知,在0~108 h的补料培养时间内,当补料次数为3次时,可获得最大生物量15.092±0.283 g/L。过少补料次数的实验组虽然与未进行补料的对照组相比生物量有所增加,但生物量还是低于补料三次的实验组,原因可能是菌体生长过程中因为补料过少营养物质供给不足从而影响菌体的生长,反之过多的补料次数的实验组则会因为加入了过多的培养基,从而改变菌体密度,降低溶氧量,导致菌体生物量降低。因此,选择补料3次为最佳补料次数。
2.2.5.4 粗壮脉纹孢菌分批补料碳氮比的确定 碳氮比是补料培养基中不可忽视的一项重要因素,碳氮比过高和过低都不利于细胞生长和外源蛋白表达和积累,过低导致菌体提早自溶;过高导致细菌代谢不平衡,最终不利于产物的积累,严重影响菌体的生长和代谢[16,23]。在摇瓶培养中,以蔗糖作为微生物培养基碳源,蛋白胨作为氮源,保证碳源浓度和补料添加量不变的情况下对粗壮脉纹孢菌进行分批补料培养。由表6可知,相对于不添加任何物质的对照组相比,只添加碳源能得到最大的菌体生物量,并且随着氮源添加量的下降,菌体反而呈现一个生长更加旺盛的趋势。说明在粗壮脉纹孢菌的初始培养基中氮源充足且不会成为菌体生长的限制性因素,因此不需要补加氮源。
3 结论
本研究以粗壮脉纹孢菌作为研究菌种,对其高密度培养的培养基组成以及分批补料培养方法进行了探索。实验结果表明,合适的粗壮脉纹孢菌培养基组成以及间歇补料方式能有效地促进粗壮脉纹孢菌的生长。在最佳培养基组成:蔗糖42 g/L、蛋白胨36 g/L、磷酸二氢钾2.6 g/L、硫酸锌0.038 g/L、硫酸镁0.1 g/L、硫酸锰0.03 g/L、氯化钾0.1 g/L的基础上分别于培养24、60、96 h进行补料,共补料3次,每次补加200 g/L的蔗糖溶液10 mL,可获得粗壮脉纹孢菌的最大生物量14.732 g/L,是未优化之前粗壮脉纹孢菌生物量的2.42倍。结果表明通过发酵技术实现粗壮脉纹孢菌的高密度培养是切实可行的,也为之后大批量工业化制种提供了一定的理论支持。对于其他补料方式,如恒pH补料以及葡萄糖反馈补料等对菌体生长的影响以及发酵罐放大实验还有待进一步的探索和优化。

