挖掘化学反应原理 提升学生解题技巧
[摘 要]
燃料电池根据采用的电解质不同可分为五种类型,是高考试题考查的热点。在实际教学中,教师需要引导学生深入思考化学反应原理的实质,归纳总结五种类型燃料电池的总反应式、正极反应式、负极反应式的书写模式,提升燃料电池试题的解题技巧。
[关键词]
高中化学;燃料电池;反应式
高三化学二轮复习,是高考总复习中一个关键性的环节。在复习相关化学知识时,教师需要引导学生深入思考化学反应原理的实质,总结出相关规律和解题技巧,以达到高效复习的目的。燃料电池是现代社会中具有广阔发展前景的新能源,因其能量转换效率高、洁净无污染而颇受人们关注,成为高考试题考查的热点。在实际教学中,对于燃料电池的工作原理特别是电极反应式的书写,学生往往感到比较困惑。如果能正确理解并写出电极反应式(尤其是燃料为有机物的负极反应式),那么其他问题依据原电池原理便可顺利解决。下面笔者结合教学实践和对高考试题的研究,总结了不同类型燃料电池的电极反应式书写方法,并建立书写模式,以提升解题技巧。
一、燃料电池基本原理
燃料电池是一种不经燃烧便可将燃料的化学能经过电化学反应直接转变为电能的装置。和其他电池中的氧化还原反应一样,电化学反应也是自发的化学反应,不会发出火焰,化学能可以直接转化为电能。
燃料电池的基本结构与一般化学电源相同,由正极(氧化剂电极)、负极(燃料电极)和电解质构成,但是电极本身仅起催化和集流作用。燃料电池工作时,活性物质由外部供给,因此,原则上说,只要燃料和氧化剂不断地输入,反应产物不断地排出,燃料电池就可以连续放电,供应电能。
燃料电池正极上的氧化剂仅限于氧气或空气。负极上的燃料主要为化石燃料以及由此得到的衍生物,如H2、CO、NH3、CH4、C2H6、C3H8、C4H10、C4H6、C3H4、CH3OH、C2H5OH等都可用作燃料。无论是什么类型的燃料电池,负极一定是燃料失电子发生氧化反应,正极一定是氧气(或空气)得电子发生还原反应。
燃料电池根据采用的电解质不同可分为五种类型:①酸性燃料电池(电解质溶液通常为浓H3PO4,导电离子为H+);②质子交换膜燃料电池(电解质是由质子导电聚合物构成的质子交换膜,导电离子为H+);③碱性燃料电池(电解质溶液常为浓KOH溶液,导电离子为OH-);④熔融碳酸盐燃料电池(电解质一般为Li2CO3、K2CO3或Na2CO3的二元混合物,导电离子为CO32-);⑤固体氧化物燃料电池(电解质常为ZrO2、Y2O3,导电离子为O2-)。
二、燃料电池电极反应式书写方法
(一)总反应式书写方法
燃料电池虽然是一种不经过燃烧而转化电能的装置,但其在放电时发生的总反应和燃料燃烧时的总反应一样(若生成物与电解液能继续反应的要考虑继续反应,总反应式是离子反应的最好写离子方程式)。
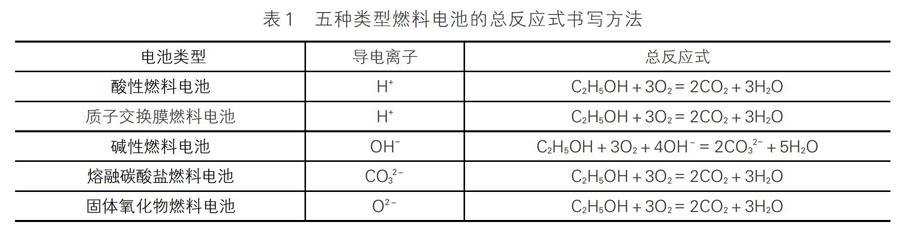
五种类型燃料电池的总反应式归纳如表1(以C2H5OH燃料电池为例):
电池总反应式(不写点燃条件)除了碱性燃料电池要考虑生成物CO2继续与OH-反应生成CO32-外,其他的都是燃料与O2反应生成CO2和H2O。
(二)正极反应式书写方法
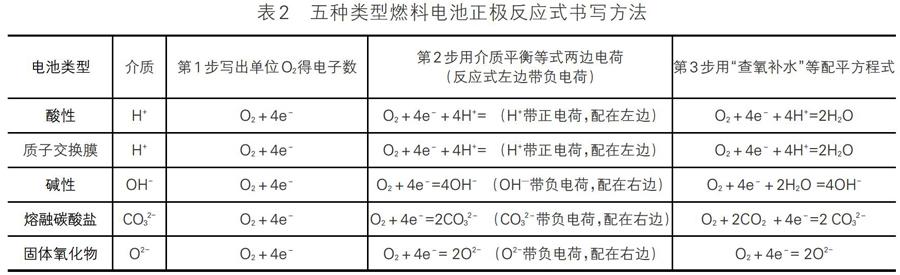
燃料电池正极是O2得电子发生还原反应,O2得电子生成O2-,O2-不是氧元素的稳定产物,O2-存在形式与燃料电池的电解质的状态和电解质溶液的酸碱性有着密切的关系。
1.酸性燃料电池中,导电离子是H+,在酸性环境中,不稳定的O2-与H+结合生成H2O(可理解为O2-带负电,在电性力作用下,O2-结合H+生成H2O),即O2+4e-=2O2-,2O2-+4H+=2H2O,正极反应式为O2+4H++4e-=2H2O。
2.质子交换膜燃料电池中,电解质是由质子(H+)导电聚合物构成的质子交换膜,导电离子为H+,不稳定的O2-要结合H+生成H2O,即正极反应式为O2+4H++4e-=2H2O。
3.碱性燃料电池中,导电离子是OH-,在碱性环境中,不稳定的O2-会继续与H2O反应生成OH-(可理解为O2-带负电,在电性力作用下与OH-相排斥,只能结合H2O生成OH-),即O2+4e-=2O2-,2O2-+2H2O=4OH-,正极反应式为O2+2H2O+4e-=4OH-。
4.熔融碳酸鹽燃料电池中,导电离子是CO32-,电解质中存在CO2,不稳定的O2-会结合CO2生成CO32-(可理解为O2-带负电,在电性力作用下与CO32-相排斥,只能结合CO2生成CO32-),即O2+4e-=2O2-,2O2-+2CO2=2CO32-,正极反应式为O2+2CO2+4e-=2CO32-。
5.固体氧化物燃料电池中,导电离子是O2-,该固态电解质是熔融氧化物,在高温下可允许O2-在其间通过,O2-在该环境下可稳定存在,正极反应式为O2+4e-=2O2-。
五种类型燃料电池正极反应式书写方法归纳如表2。
上述固体氧化物和熔融碳酸盐燃料电池,由于是非水体系,应该用“查氧补氧”或“查氧补二氧化碳”的方法,而不是“查氧补水”。
(三)负极反应式书写方法
燃料电池总反应式的书写比较容易,正极反应式的书写形式变化不大,有规律可循,但负极反应式的书写难度较大。为了更好地突破负极反应式的书写难点,下面依次介绍三种书写负极反应式的方法。
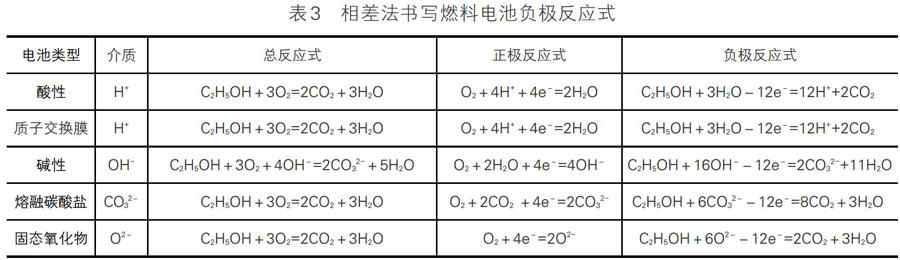
1.相减法
先写出总反应式,再写出正极反应式,然后结合电子守恒和元素守恒,用总反应式减去正极反应式,得到负极反应式。
以C2H5OH燃料电池为例,五种类型燃料电池的总反应式、正极反应式、负极反应式书写归纳如表3。
用“总反应式-正极反应式×3”可得负极反应式,另外质子交换膜燃料电池与酸性燃料电池的反应式相同。
这种写法必须建立在两个知识储备的基础之上:一是必须知道燃料电池的总反应式,而题目中一般不会直接给出;二是需要明确正极反应式的书写会因电池电解质的不同而不同。故上述书写方法过程比较繁杂且耗时较长,容易出现错写、漏写等问题,对学生来说仍有很大难度。
2.零价法
燃料电池的负极是燃料失电子发生氧化反应,燃料以有机物居多,其反应后的产物通常为CO2和H2O(非碱性介质)或CO32-和H2O(碱性介质)。但无论上述哪种情况,产物中C、H、O的化合价均为+4、+1、-2,如果把原有机物CxHyOz中所有元素都看成0价,其中C和H的化合价升高,失去的电子总数为4x+y,而O的化合价降低,得到电子数为2z,可知整个反应中失去的电子总数为4x+y-2z,即“碳四氢一氧减二”。若燃料有机物中不含氧元素,则负极反应中失去的电子数为4x+y。
例如,CH3OH燃料电池中,负极反应产物无论是CO2还是CO32-,1 mol CH3OH反应失去的电子数为(4×1+1×4-2×1)mol=6 mol,负极反应式的书写归纳如表4。
3.化合价法
运用相对化合价法书写燃料电池负极反应式的关键是依据电负性的相对大小确定燃料物质中各元素的相对化合价。一般来说,如果燃料分子中只含C、H、O三种元素,则以O元素为-2价,H元素为+1价来确定C元素的相对化合价,计算出单位燃料被氧化后失去的电子总数,确定化学计量系数之比,再考虑电解质环境,结合守恒原理直接书写负极反应式。
例如,在C6H12O6燃料电池中,C6H12O6中C的化合价为0价,1 mol C6H12O6发生反应后的产物无论是CO2还是CO32-都失去24 mol电子,负极反应式的书写归纳如表5。
通过上面的分析可以看出,“零价法”“化合价法”与“相减法”相比,省去了比较繁琐的书写总反应式和正极反应式的过程,具有简单、快速、准确等特点,学生更易接受,也更易掌握。
为了方便理解,笔者把试题中常涉及到的其他几种燃料的燃料电池负极反应式归类如表6,供学习者参考使用。教师可让学生在阅读理解后,根据表中信息在白纸上自行默写这几种燃料在不同电解质环境下的负极反应式,以便进一步熟练掌握“化合价法”“零价法”书写负极反应式的具体步骤。
三、燃料电池高考考查例析
(一)酸性燃料电池
【例1】(2012年四川卷)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O
D.正极上发生的反应是:O2+4e-+2H2O=4OH-
【解析】本题考查了电池反应原理、电极反应式的书写、离子移动方向的判断及电路中电子转移情况分析。根据负极反应CH3CH2OH-4e-+H2O=CH3COOH+4H+,且为酸性酒精燃料电池,所以得到电子的物质是O2,正极反应为O2+4e-+4H+=2H2O,电池总反应式为CH3CH2OH+O2=CH3COOH+H2O。根据正负极反应可知,负极生成H+,正极消耗H+,所以电解质溶液中的H+向正极移动。用电池总反应式进行判断,有0.4 mol的电子转移,消耗氧气为0.1 mol。答案为C项。
(二)质子交换膜燃料电池
【例2】(2015年全国新课标卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图1所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为:C6H12O6+6O2=6CO2+6H2O
【解析】本题通过给出以葡萄糖为燃料的质子交换膜微生物燃料电池结构示意图,考查了电池反应原理、电极反应的书写及离子移动方向的判断。电池的总反应为C6H12O6+6O2=6CO2+6H2O,正極反应为O2+4e-+4H+=2H2O,负极反应为C6H12O6-24e-+6H2O=6CO2+24H+。放电过程中,H+从负极区向正极区迁移,结合O2-生成H2O。在微生物的作用下,原电池能加快氧化还原反应速率,可以说微生物促进了电子的转移。答案为A项。
(三)碱性燃料电池
【例3】(2008年北京卷)据报道,我国拥有完全自主产权的氢氧燃料电池车在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
【解析】本题考查了电极反应式的书写、电解液的变化情况及电路中电子转移情况。据题意,氢氧燃料电池的总反应式为2H2+O2=2H2O,其电解液为KOH溶液,故正极反应式为O2+4e-+2H2O=4OH-,负极反应式为H2-4e-+4OH-=4H2O。反应过程中,生成和消耗的OH-相等,KOH的物质的量不变,KOH的物质的量浓度变小。D项根据电解CuCl2时的放电顺序可知,产生Cl2的电极反应式为2Cl--2e-=Cl2,故产生2.24 L Cl2时,有0.2 mol电子转移。答案为D项。
(四)熔融碳酸盐燃料电池
【例4】(2015年江苏卷)一种熔融碳酸盐燃料电池原理示意如图2。下列有关该电池的说法正确的是( )
A.反应CH4+H2O[]3H2+CO,每消耗1 mol CH4转移12 mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
【解析】本题考查了原电池的工作原理、电极反应式的书写、离子移动方向的判断及电路中电子转移情况分析。熔融碳酸盐燃料电池的总反应式为CO+H2+O2=CO2+H2O,电极B的正极反应式为O2+2CO2+4e-=2CO32-,电极A的负极反应式为CO+H2-4e-+2CO32-=3CO2+H2O(CO-2e-+CO32-=2CO2和H2-2e-+CO32-=CO2+H2O)。A项1 mol CH4生成CO,化合价由-4价到+2价上升6价,1 mol CH4参加反应共转移6 mol电子。C项根据原电池工作原理,阴离子CO32-向负极(电极A)移动。答案为D项。
(五)固态氧化物燃料电池
【例5】(2005年广东卷)一种新燃料電池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e-=2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
【解析】本题以熔融状态掺杂氧化钇的氧化锆为电解质,考查了电极反应、总反应的书写及离子移动方向的判断。丁烷燃料电池的总反应式为2C4H10+13O2=8CO2+10H2O,正极反应式为O2+4e-=2O2-,负极反应式为C4H10-26e-+13O2-=4CO2+5H2O。在熔融电解质中,负离子O2-由正极移向负极,正离子由负极移向正极,完成电子运动的循环。答案为B、C项。
总之,无论是什么类型的燃料电池,只要抓住不变的核心原理,考虑所给电解质类型,正确分析出电极反应式,问题便可解决。高考复习是一个系统工程,绝不是简单地拼时间、拼精力,漫无目标地做题、解题的过程,而是科学、有计划的复习过程。教师在强调刻苦学习的同时,要让学生在深入思考化学反应原理的基础上,把握好化学反应原理的实质,总结出规律和解题技巧,使复习达到事半功倍的效果。
[参 考 文 献]
[1]高丽.燃料电池负极反应书写方法探析[J].中学化学教学参考,2018(16):65.
[2]杨金才.浅析一种书写燃料电池负极反应式的新方法[J].化学教学,2016(4):87-89.
[3]刘茜茜,杨金才,万娇娇.例析高考化学燃料电池电极反应式的书写[J].化学教学,2016(12):77-79.
[4]刘三先.浅析一种书写燃料电池电极反应式的新方法[J].中学教学参考,2014(11):80-81.
(责任编辑:赵晓梅)
作者简介:刘鸿(1977-),男,云南富源人,高级教师,大学本科。

