类风湿关节炎合并骨质疏松与7关节超声评分相关性及预测模型
颜小斌 吕国荣,2* 徐振宏 李拾林 颜丽笙
1.福建医科大学附属第二医院超声科, 福建 泉州 362000 2.泉州医学高等专科学校临床医学院,福建 泉州 362000 3.福建医科大学附属第二医院放射科,福建 泉州 362000
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性炎性关节病变为主要表现的全身性疾病,可导致软骨及骨质的破坏,其特征是出现滑膜炎、关节破坏、骨质丢失和全身并发症[1]。RA与局部和全身性炎症有关,可引起关节周围骨丢失、骨侵蚀、骨质疏松和骨折。与原发性骨质疏松症相比,继发于RA的骨质疏松症发生骨折的可能性更高[2]。本研究旨在评价7关节超声评分与RA患者骨质疏松的相关性,并建立RA骨质疏松预测模型。
1 资料与方法
1.1 一般资料
收集2019年6月-2020年3月福建医科大学附属第二医院风湿免疫科门诊和住院的类风湿关节炎患者123例。以骨密度检查为金标准,将研究对象分为骨量正常组、低骨量组、骨质疏松组。骨质疏松组64例,其中女49例、男15例,平均年龄(60.28±10.11)岁,中位数病程25.25~120个月,中位数用药时间12.25~69个月;低骨量组30例,其中女23例、男7例,平均年龄(52.97±9.19)岁,中位数病程6.75~87个月,中位数用药时间5.25~45.75个月;骨量正常组29例,其中女19例、男10例,平均年龄(48.17±8.12)岁;中位数病程5~48个月,中位数用药时间1.5~36个月。
1.1.1诊断标准:所有研究对象均符合2010年美国风湿病学会(American college of rheumatology,ACR)/欧洲抗风湿病联盟(european union against rheumatism,EULAR)制定的类风湿关节炎分类标准[3]。骨质疏松诊断标准均符合《中国老年骨质疏松症诊疗指南(2018)》制定的骨质疏松诊断标准[4]。
1.1.2排除标准:①年龄小于18岁、体质量指数(body mass index,BMI)<18.5者;②伴有其他免疫性、内分泌疾病的患者;③患有肾脏疾病、严重肝肾功能异常、血液系统疾病、子宫附件切除、过早停经史(<45岁)等影响骨密度变化的疾病;④先天性关节发育异常患者、有关节外伤、关节置换手术史;⑤妊娠期或哺乳期;⑥大量吸烟、饮酒者(超过3单位/天);⑦长期应用导致骨质疏松的药物[包括长期(累计剂量>2年)、高剂量(>7.5 mg/d)的糖皮质激素的使用]。
1.2 仪器和方法
1.2.1仪器:超声仪器采用中国迈瑞mindray 7超声诊断仪,高频线阵探头(频率4-15 MHz),选择骨骼肌肉系统成像模式。骨密度检查采用Hologic Discovery 双能X线骨密度仪。
1.2.2方法:①实验室检查:记录所有患者C-反应蛋白(C-reaactive protein,C-RP)、血沉(erythrocyte sedimentation rate,ESR)、类风湿因子(rheumatoid factor,RF)、抗环瓜氨酶抗体(anti-cyclic cucurbitase antibody,CCP)检查结果值。正常值:C-RP:0~8 mg/L;ESR:≤20 mm/H;RF:0~30 IU/mL;CCP:0~25 RU/mL;②RA活动度评分方法:所有研究对象按DAS28评分法进行评分。计算公式DAS28=[0.56×sqrt(t28)+0.28×sqrt (sw28)+0.70×Ln (ESR)]×1.08+0.16;③超声检查:超声操作步骤按欧洲风湿病联盟制定的肌肉关节高频超声检查指南进行。采用7关节超声评分系统检测受累优势侧肢体(即主述症状和体征更严重的一侧肢体)的腕关节(Wri)、第二及第三掌指关节(MCP2、MCP3)、第二及第三近端指间关节(PIP2、PIP3)、第二及第五跖趾关节(MTP2、MTP5) 共7个关节。检查Wri、MCP2、MCP3、PIP2、PIP3 关节时患者端坐于检查医师对面,使腕、肘保持放松姿势,平放于检查台上(若某些高龄或制动患者不能保持上述姿势,可平卧于检查床上,将上臂分别放于身体两侧);检查MTP2、MTP5关节时患者取仰卧位或坐位膝关节伸展或屈曲45度,使踝关节保持自然位或休息位。采用二分类评分评价灰阶超声(gray scale ultrasound,GSUS)肌腱腱鞘炎和骨侵蚀,“无”为0分,“有”为1分;GSUS采用半定量评分评价滑膜炎:无滑膜增生:0分;滑膜轻度增厚,最高点低于关节腔连线水平:1分;滑膜中度增厚,最高点和关节腔连线水平接近:2分;滑膜重度增厚,最高点超过关节腔连线水平:3分。能量多普勒(power doppler ultrasound,PDUS)采用半定量法评价增生滑膜内及肌腱腱鞘内血流信号:未见明显血流信号:0分;≤3个点状或2个点状+1个线状血流信号:1分;﹥3个点状血流或血流融合成片,但≤50%病灶面积:2分;病灶内可及树枝状、网状血流信号,范围超过病灶的50 %:3分。以每个关节所见GSUS滑膜炎、PDUS滑膜炎、GSUS肌腱腱鞘炎、PDUS肌腱腱鞘炎及骨侵蚀最严重情况计分,计算7个关节各单项评分,并将各单项评分相加为US7最终评分;④骨密度检查:所有患者均采用Hologic Discovery A双能X线骨密度仪行骨密度测定,按常规DXA测定方法测定腰椎L1~4、股骨颈、全髋、桡骨远端1/3处骨密度。
1.3 统计学处理

2 结果
2.1 各组人口学特征、实验室检查、超声表现比较
骨质疏松组与低骨量组、骨质疏松组与骨量正常组在年龄、病程、用药时间、ESR、DAS28、CRP、RF、US7各项评分比较差异均具有显著的统计学意义。CCP在骨质疏松组与低骨量组之间比较差异没有统计学意义。低骨量组和骨量正常组除了DAS28、CCP、PDUS滑膜炎外其余各指标比较差异均没有统计学意义。见表1。
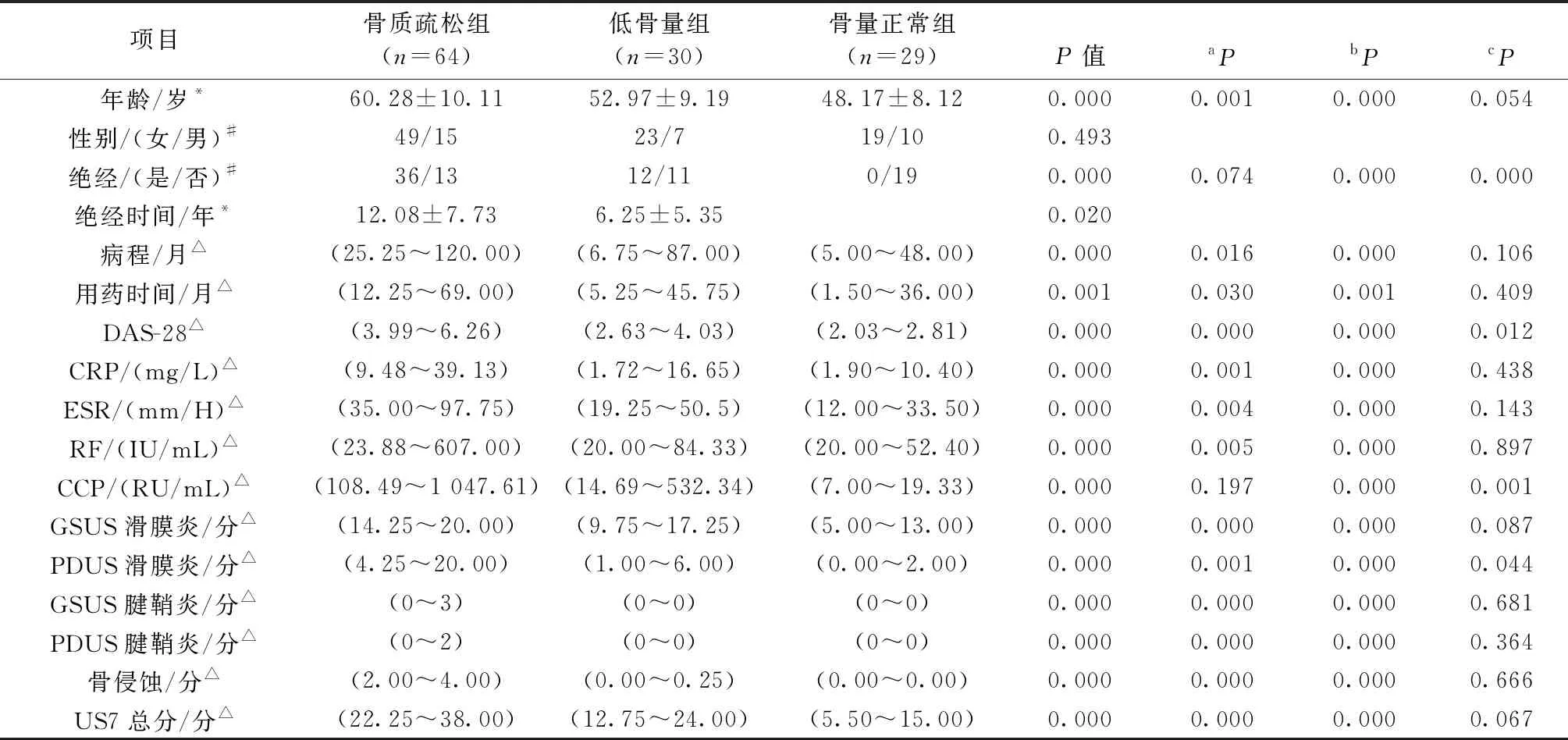
表1 各组人口学特征、实验室检查、超声表现比较Table 1 Comparison of demographic characteristics, laboratory examinations and ultrasound performance of each group
2.2 各组相关指标相关性分析
123例RA患者中,DAS28(r=0.676,P<0.001)、骨侵蚀(r=0.728,P<0.001)、US7总分(r=0.675,P<0.001)均与RA患者骨质疏松严重程度呈强正相关;年龄(r=0.468,P<0.001)、CRP(r=0.447,P<0.001)、ESR(r=0.517,P<0.001)、CCP(r=0.525,P<0.001)、RF(r=0.423,P<0.001)、GSUS滑膜炎(r=0.594,P<0.001)、PDUS滑膜炎(r=0.597,P<0.001)、GSUS腱鞘炎(r=0.593,P<0.001)、PDUS腱鞘炎(r=0.490,P<0.001)均与RA患者骨质疏松严重程度呈中等正相关;病程(r=0.399,P<0.001)、用药时间(r=0.346,P<0.001)与RA患者骨质疏松严重程度呈弱正相关。
2.3 单因素分析及多元Logistic回归分析结果及疏松模型
将年龄、病程、用药时间、DAS28、CRP、ESR、RF、CCP、GSUS滑膜炎、PDUS滑膜炎、GSUS腱鞘炎、PDUS腱鞘炎、骨侵蚀、US7总分分别赋值X1~ X14,通过单因素分析X1~ X14均为有意义的因素,将其纳入多元Logistic回归分析,以骨量正常组为对照,通过似然比和多重共线性检验得出年龄(X1)、病程(X2)、DAS28(X4)、CCP(X8)4个指标对构建模型有统计学意义。将4个有意义的自变量建立预测模型为:Logit (骨质疏松/正常)=-27.988+0.305X1+0.048X2+2.546X4+0.012X8;Logit (低骨量/正常)=-17.923+0.207X1+0.030X2+1.648X4+0.012X8。模型总的符合率为78.0 %,其中预测骨质疏松模型的符合率为87.5 %,低骨量为53.3 %,正常为82.8 %。所得模型有统计学意义(χ2=141.205,P<0.001)。多元Logistic回归分析显示:骨质疏松组与骨量正常组、低骨量组和骨量正常组比较显示年龄、病程、DAS28、CCP为骨质疏松的独立危险预测因子(P<0.001)。见表2、表3。
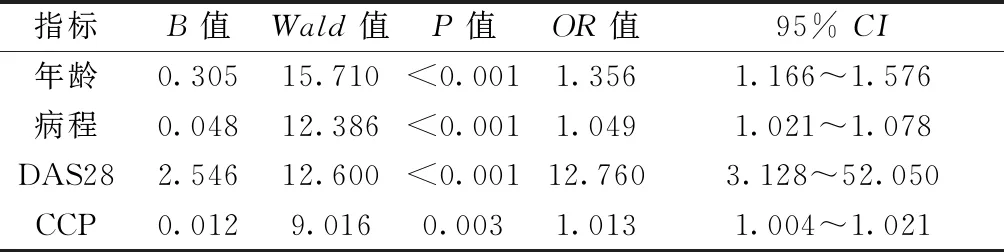
表2 骨质疏松组相比骨量正常组重要指标及OR值
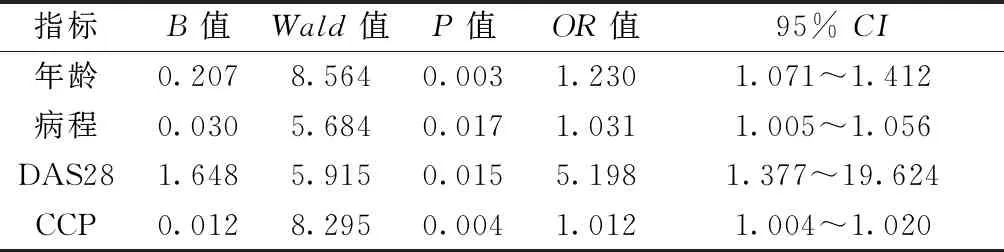
表3 低骨量组相比骨量正常组重要指标及OR值
3 讨论
RA是一种慢性炎症性疾病,其特征是滑膜持续炎症反应、关节破坏、骨质丢失和全身并发症[5]。类风湿关节炎的骨骼改变包括关节旁骨侵蚀、关节周围骨丢失和全身性骨质疏松[6]。
导致RA患者骨质疏松的可能危险因素很多,包括年龄大、女性、体质量指数低、使用糖皮质激素(每日剂量≥7.5 mg)、病程长、活动度高、CCP等。
本次研究显示骨质疏松组与低骨量组和骨量正常组相比,骨质疏松组年龄更大、病程更长;年龄和病程是预测骨质疏松的独立危险因素。Tong等[7]的研究表明年龄是RA患者骨质疏松的危险因素,年龄每增加1岁,RA患者发生椎体骨折的风险增加7.2 %。Gauri 等[8]的研究也表明病程越长、病情活跃度越高的患者更容易发生骨量减少和骨质疏松。以往的研究认为糖皮质激素等药物的使用是骨质疏松症的独立危险因素;有趣的是,本次研究结果显示骨质疏松组与低骨量组和骨量正常组相比,用药时间较长,用药时间和骨质疏松存在弱的相关性(r=0.346,P<0.001);导致该因素的原因可能是本研究排除了长期(累计剂量>2年)、高剂量(>7.5 mg/d)的糖皮质激素患者;并且多项研究[9]表明,在疾病活动性较高的早期RA情况下,短期、低剂量糖皮质激素治疗可以稳定骨密度。
DAS28是评价RA疾病活动度的重要方式,本研究显示三组患者疾病活动度不同,骨质疏松组疾病活动度最高,DAS28是骨质疏松的独立预测因素;并且疾病活动度与患者骨质疏松存在强烈的相关性(r=0.676,P<0.001)。表明疾病活动性和骨质丢失之间存在关联,骨密度丢失发生在RA早期,并随着疾病活动的增加而增加,这与国内外众多学者研究观点一致[10]。研究显示骨质疏松组和低骨量组相比于骨量正常组CRP、ESR值更高,与骨质疏松存在中等相关性,但CRP、ESR并不是骨质疏松的独立预测因子,Tomizawa等[11]学者的研究也证实了这一点。
RA患者血清中还存在多种自身抗体,最常见的是CCP和RF。在本次研究中,CCP抗体在骨质疏松组与骨量正常组,低骨量组与骨量正常组间存在差别。多项研究表明CCP与RA患者局部和全身骨密度降低和破骨细胞介导的骨吸收有关。对于早期RA患者,当抗CCP抗体阳性时,高频超声更有可能发现关节软骨破坏和骨侵蚀改变。本研究表明CCP是骨质疏松的预测因素。Tomizawa等学者的研究也表明CCP不仅是RA患者关节破坏的危险因素,也是骨丢失的危险因素。值得一提的是,RF虽然不是骨质疏松的预测因素,但在骨质疏松和低骨量组、骨质疏松和骨量正常组之间存在差别,并与骨质疏松存在相关性;分析其原因可能是RF和BMD丢失之间的关系是明显的剂量依赖关系,只有在高水平的患者中才观察到显著的差异,这是因为高水平的RF增强了CCP和BMD丢失之间的联系[12]。
US7评分的各个指标均在骨质疏松组与骨量正常组、低骨量组和骨量正常组之间存在显著的统计学差异。骨侵蚀(r=0.728,P<0.001)和US7总分(r=0.675,P<0.001)和骨质疏松存在强烈的正相关,Gong 等[13]研究也表明,伴随着骨侵蚀程度的进展,全身性骨质疏松增多,骨质发生率增加,疾病活动性增强。
国内外研究[14-16]更多的是应用Logistic回归对RA骨质疏松危险因素进行分析,结果表明年龄、病程、CCP、DAS28是RA患者骨质疏松危险因素,但均未建立骨质疏松预测模型。本研究应用多元logistic回归分析建立了RA患者骨质疏松的预测模型,结果显示模型总的符合率为78.0 %,其中预测骨质疏松模型的符合率为87.5 %,低骨量为53.3 %,正常为82.8 %。因此,本研究提出的预测模型具有较高的诊断效能,可作为RA患者骨量异常的预测模型,值得在临床上推广应用。
综上所述,RA患者病史、炎症指标及US7超声评分存在不同程度差异及相关性。本研究建立的骨质疏松模型可为预测RA患者骨质疏松提供重要参考。

