环境因子对精喹禾灵及其代谢物在土壤中降解研究
屈江玲,曹冬梅,2,3,汤华成,娄雨豪
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江省农产品加工与质量安全重点实验室;3.国家杂粮工程技术研究中心)
根据以往的研究,全世界使用的400 万t 农药中,只有1%挥发到空气中,其余消散到土壤、水等环境介质中,最终80%进入土壤环境[1-2]。因此,研究施用农药在土壤中的降解行为对探究该农药的有效性和持久性有重要意义,更有利于对农药的环境行为进行监测。近几年,随着认识到红豆、绿豆等杂粮丰富的营养,越来越多人喜爱食用杂粮。各类杂粮也被大量种植,其中豆类因其高含量的蛋白质(20%~50%),深受人们欢迎[3]。而为获取高产量,农民广泛并大量使用精喹禾灵。
精喹禾灵(quizalofop-p-ethyl)除草剂主要用于大豆、油菜等农作物中,清除禾本科杂草[4-7]。其在有土壤、植物组织等环境介质存在的情况下,能迅速水解成相应的精喹禾灵酸(quizalofop-p-acid),具有手性和生物活性[8-9]。精喹禾灵和精喹禾灵酸均可抑制目标杂草叶中细胞脂肪酸的合成,导致生长抑制和恶化[10]。两者已被证明具有生殖和基因毒性[12-16]。Mustafa 等[10]的研究发现,葱属植物根分生组织细胞总染色体畸变量随精喹禾灵浓度的增加而增加。Elefsiniotis 等[11]研究了精喹禾灵对肝脏的影响,发现精喹禾灵会造成梗阻性胆汁淤积,肝脏活性检查证明了精喹禾灵的毒性。由于两者广泛的应用范围,人类和许多其他动物通过主动或被动过程暴露于这两种化合物下。
目前常见的除草剂提取技术有液-液萃取法(LLE)、固相萃取法(SPE)。但前者用时久,且浪费大量有机溶剂,既不环保也花费高[17]。后者所需的墨盒较为昂贵,而且对于有些除草剂还会吸收导致损耗。而近年来,快速、简便、廉价、有效、可靠、安全的方法—QuEChERS 法在农药检测中得到了广泛的应用。选用QuEChERS 法,与其它提取方法相比,该方法安全、简便、经济、有效、高效、可靠。
释放到土壤中的农药会经历几个物理、化学和生物过程,包括吸附、地表径流、洗脱、挥发、吸附和降解。Wink 等[18]在好氧条件下,分别在两种土壤中培养并观察到禾草灵和恶唑禾草灵迅速水解成相应的酸并积累S 型对映体酸。Liu 等[19]在藻类培养中观察到手性除草剂对映体选择性降解存在差异,表明它们的应用形式是决定其对映体选择性环境行为的重要因素。Li 等[20]发现喹禾灵的耗散分为两个阶段,第一个阶段迅速减少,持续1 d;第二个阶段缓慢减少,直至降解结束。Diao 等[21]研究了在好氧和厌氧条件下,禾草灵及其主要代谢物二氯苯氧基丙酸在两种土壤中的降解情况。结果显示,两种土壤中禾草灵的降解不是对映体选择性的,两种土壤的计算半衰均小于1 d。然而,两种土壤中二氯苯氧基丙酸的降解都是对映选择性的,S 型二氯苯氧基丙酸优先被降解,导致R 型二氯苯氧基丙酸相对富集。
对于农药在土壤中的降解因子,有学者进行过深入研究。其中,有学者证明三唑酮、毒死蜱等农药降解时随温度变化较大。在合适的温度范围内,降解速率与温度变化保持一致[22]。有学者分析原因为温度升高,有机物易于分解,导致容易被微生物吸收。另一方面,温度可能也在逐渐达到微生物最舒适的状态,活性增加。当然,如果温度增加过高也会使得微生物生长受到抑制。此外,还有学者证明,温度可以使得农药水解加快。但不同农药随温度变化不同。有学者发现,湿度影响农药的水解从而影响降解速率,还会影响微生物的活性。有机质的含量影响土壤质地从而改变土壤对农药的吸附性,而且也会影响微生物的繁殖速度[23]。不同农药随环境因子变化较大,精喹禾灵的变化趋势还有待分析。
此前也有学者对精喹禾灵降解规律进行过分析,但少有人研究精喹禾灵的代谢物精喹禾灵酸,而其也具有毒性[24-27]。此外,研究影响精喹禾灵及精喹禾灵酸降解的因素,有利于监测两者的残留动态以及对环境的影响,同时还可以寻找出加快两者在环境土壤中的降解。
1 材料与方法
1.1 土壤的制备及其理化性质的测定
土壤样品采集于黑龙江省大庆市,采用随机采样法,挖取10 cm 深的土壤。在挖取过程中,筛选出可见的石头、植物残渣等。风干碾碎,过筛备用。黑龙江省大庆市土壤属暗棕壤,土壤pH 值为8.4,有机质含量为19.3 g·kg-1。
1.2 试剂
精喹禾灵标品和精喹禾灵酸标品。分析纯乙腈和冰乙酸作萃取剂。色谱纯乙腈和娃哈哈纯净水作流动相。精喹禾灵和精喹禾灵酸溶于分析纯乙腈制备1 000 mg·mL-1浓度的母液。
1.3 实验设备
安捷伦1 260 Infinity II 高效液相色谱仪。Athena C18 色谱柱(4.6×250 mm,5 μm)。DAD 检测器。
1.4 检测方法
1.4.1 前处理方法
取5 g 样品土壤放于50 mL 离心管中。萃取剂选用含1%乙酸的乙腈。取15 mL 萃取剂置于离心管内,涡旋2 min 让萃取剂充分萃取。再加入0.1 g NaCl,涡旋30 s 让水与有机溶剂分层。最后加入1.5 g 无水MgSO4,涡旋30 s 将水分吸收,4 000 r·min-1离心10 min。用移液器取7.5 mL 上层液体至试管中,将试管放置于氮吹仪上,于40 ℃下吹干滤液。再用1 mL乙腈定容,溶取检测物质,过0.22 μm 滤膜,待测。
1.4.2 色谱条件
等度洗脱,流动相:乙腈/含1%乙酸的水(70∶30,v/v),流速1 mL·min-1,柱温30 ℃,进样量20 μL,检测波长为236 nm。
1.5 试验设计
1.5.1 温度对土壤中精喹禾灵及其代谢物降解的影响
土壤采用1.1 制备的土壤样品,取5 g 土壤样品放于试管中。精喹禾灵的添加浓度为2 mg·kg-1。土壤含水量为25%。每组制样11 份,分别放置在15 ℃,25 ℃,35 ℃三个温度梯度的恒温箱中黑暗培养。于0、1、3、5、7、10、14、21、28、42、60 d 依次取出样品,按照1.4.1 中的前处理方法进行前处理,检测精喹禾灵及其代谢物精喹禾灵酸的含量。
1.5.2 湿度对土壤中精喹禾灵及其代谢物降解的影响
土壤采用1.1 制备的土壤样品,取5 g 土壤样品放于试管中。精喹禾灵的添加浓度为2 mg·kg-1。土壤含水量为15%,25%,35%。每组制样11 份,放置在25 ℃恒温箱中黑暗培养。于0、1、3、5、7、10、14、21、28、42、60 d 依次取出样品,按照1.4.1 中的前处理方法进行前处理,检测精喹禾灵及其代谢物精喹禾灵酸的含量。
1.5.3 有机质对土壤中精喹禾灵及其代谢物降解的影响
去除有机质:取1.1 制备的土壤样品200 g,放置于1 L 烧杯中,依次倒入10 mL 浓度为30%的过氧化氢溶液。反应剧烈可以快速搅拌。待气泡减少后再次加入过氧化氢溶液,直至有机质含量小于0.05%。将处理好的去有机质土壤样品烘干碾碎,过70 目筛备用[28]。
分别取未去有机质和去有机质的土壤样品5 g放于试管中。精喹禾灵的添加浓度为2 mg·kg-1。土壤含水量为25%。每组制样11 份,放置在25 ℃恒温箱中黑暗培养。于0、1、3、5、7、10、14、21、28、42、60 d 依次取出样品,按照1.4.1 中的前处理方法进行前处理,检测精喹禾灵及其代谢物精喹禾灵酸的含量。
1.5.4 微生物对土壤中精喹禾灵及其代谢物降解的影响
土壤灭菌处理:取1.1 制备的土壤样品200 g,放置于500 mL 烧杯中,并用纸和橡皮胶密封好,放置在120 ℃的灭菌锅中灭菌3 次。灭菌后的土壤于50 ℃烘箱中烘干,过70 目筛备用[28]。
分别取未灭菌和灭菌的土壤样品5 g 放于试管中。精喹禾灵的添加浓度为2 mg·kg-1。土壤含水量为25%。每组制样11 份,放置在25 ℃恒温箱中黑暗培养。于0、1、3、5、7、10、14、21、28、42、60 d 依次取出样品,按照1.4.1 中的前处理方法进行前处理,检测精喹禾灵及其代谢物精喹禾灵酸的含量。
2 结果与分析
2.1 标准曲线及方法的准确度、精密度
用0.5、1、2、5、25 μg·mL-1浓度梯度的标准溶液绘制标准曲线。回收率可通过标准曲线计算得到。如表1 所示,精喹禾灵和精喹禾灵酸的决定系数R2分别为0.999 5 和0.999 8,线性回归性良好。

表1 标准溶液回归方程Table 1 Standard solution regression equations
检测方法的准确度和精密度通常通过添加回收率和相对标准偏差确定。土壤样品添加浓度依次为0.05、0.2、2 mg·kg-1。日间精度为连续5 d 检测样品土壤,日内精度为1 d 检测5 次样品土壤。从表2 可以看出,土壤样品中精喹禾灵和精喹禾灵酸的添加回收率分别在95.6%~103.2%和97.1%~105.6%之间。相对偏差分别在0.36~3.55 和0.96~3.18 之间。可见准确度和精密度都能满足精喹禾灵及其代谢物的检测要求。以信噪比S/N=3 确定检出限,精喹禾灵及精喹禾灵酸的检出限为0.005 mg·kg-1和0.003 mg·kg-1。
2.2 温度对精喹禾灵及其代谢物降解的影响
适宜的温度对精喹禾灵和精喹禾灵酸的降解速率有很大影响。从图1 中可以看出,25 ℃条件下,土壤中两种化合物的降解最快。35 ℃条件下次之,15 ℃条件下最慢。原因分析,35 ℃和15 ℃不是微生物生存的最佳温度,导致其降解速率变慢。其次,温度也影响了精喹禾灵的水解。图1 中可以看出,精喹禾灵酸随着精喹禾灵的分解先增加,然后逐渐也被分解,其最高残留量大概在3~5 d 的时候,其随温度的变化与精喹禾灵一致,精喹禾灵降解的越慢,其最大值往右移动。
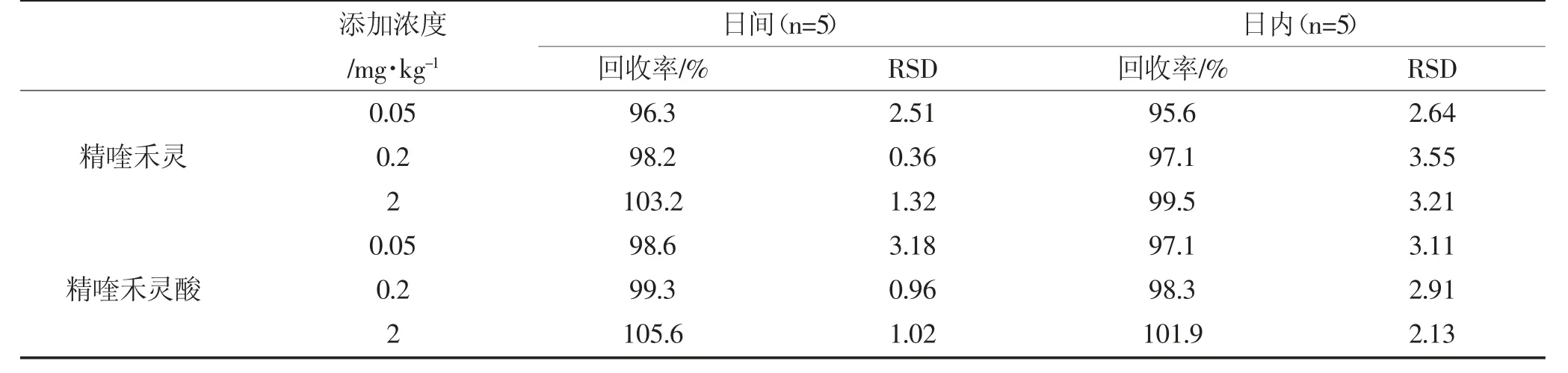
表2 精喹禾灵及其代谢物在土壤中的添加回收率和相对标准偏差(RSDs)Table 2 Recoveries and RSDs for quizalofop-p-ethyl and and its metabolite in soil
精喹禾灵的降解随时间先快后慢,符合一阶动力学方程,因此用一阶动力学方程来拟合其降解曲线,及浓度C=C0e-kt,其半衰期T1/2=ln2/k[28]。不同温度下的一阶动力学方程及半衰期如表3 所示,15 ℃和35 ℃条件下精喹禾灵的半衰期分别为13.6、12.8 d,而25 ℃时则短至5.3 d。

图1 精喹禾灵及其代谢物在不同温度土壤中的降解Fig.1 Degradation of quizalofop-p-ethyl and its metabolite in soil at different temperatures

表3 精喹禾灵在不同温度土壤中的动力学方程及半衰期Table 3 The kinetic equation and half-life of quizalofop-p-ethyl in different temperature soil
2.3 湿度对精喹禾灵及其代谢物降解的影响
从图2 中可以看出,当湿度在15%到35%范围内变化时,精喹禾灵的降解速率随着湿度的增加而逐渐加快,不过速率变化幅度很小,35%的含水量条件下分解最快。可能是微生物该三种湿度条件下都能保持很好的活性,当湿度略微增加时,微生物分解精喹禾灵的速率也有所增加。此外,水分较多时,精喹禾灵溶解的也比较多,这也可能对精喹禾灵的非生物降解有一定影响。精喹禾灵酸的变化趋势仍是随着时间增加,先极具增加,再逐渐减小,随湿度的变化几乎与精喹禾灵一致,精喹禾灵降解越慢,其最大值往右移动。精喹禾灵在三种湿度条件下的半衰期比较接近(表4),分别为5.6、5.3、5.3 d,都降解的比较快。
2.4 有机质对精喹禾灵及其代谢物降解的影响
从图3 中可以看出,去除有机质的土壤精喹禾灵降解的速率明显减慢下来。去除了有机质的土壤可能严重影响了微生物的繁殖。此外土壤中的腐殖质含量也可能影响了精喹禾灵的水解。有机质含量对于土壤吸附精喹禾灵也有影响。从图中可以看出,精喹禾灵酸的减小的趋势也变得平缓,大约在7~10 d达到最大值,最大值时间往右移动较多。从表5 中可以看出,精喹禾灵在去有机质土中的半衰期比较长,达到21.7 d。

图2 精喹禾灵及其代谢物在不同湿度土壤中的降解Fig.2 Degradation of quizalofop-p-ethyl and its metabolites in soil with different humidity

表4 精喹禾灵在不同湿度土壤中的动力学方程及半衰期Table 4 The kinetic equation and half-life of quizalofop-p-ethyl in different humidity soil

图3 精喹禾灵及其代谢物在未去有机质和去有机质土壤中的降解Fig.3 The degradation of quizalofop-p-ethyl its metabolites in soil without removing organic matter and removing organic matter

表5 精喹禾灵在未去有机质和去有机质土壤中的动力学方程及半衰期Table 5 The kinetic equation and half-life of quizalofop-p-ethyl in the soil without removing organic matter and removing organic matter
2.5 微生物对精喹禾灵及其代谢物降解的影响
微生物对精喹禾灵及其代谢物降解速率的影响结果如图4 所示。由于灭菌土壤中只有化学降解,降解速率显著减小。可见生物降解占其很大比例。而精喹禾灵酸在灭菌的土壤中变化趋势变化较大,先增多,后逐渐变平缓,有上下波动。可能是一方面精喹禾灵在降解为精喹禾灵酸,另一方面其本身也在降解。表6 显示,精喹禾灵在灭菌土壤中的半衰期延长至38.5 d,在所有条件中降解最慢。

图4 精喹禾灵及其代谢物在未灭菌和灭菌土壤中的降解Fig.4 Degradation of quizalofop-p-ethyl and its metabolites in unsterilized and sterilized soil

表6 精喹禾灵在未灭菌和灭菌土壤中的动力学方程及半衰期Table 6 The kinetic equation and half-life of quizalofop-p-ethyl in unsterilized and sterilized soil
3 结论与讨论
研究结果表明,土壤中残留的精喹禾灵中间代谢物为精喹禾灵酸。在室温25°C 时,35%的含水量下,有机质含量高的土壤,精喹禾灵及其代谢物降解最快。土微生物对精喹禾灵及其代谢物降解影响最大。同时也说明了精喹禾灵及其代谢物同时存在化学降解和微生物降解。
温度过高或过低都不利于精喹禾灵及其代谢物的降解,在较小的范围内,湿度的增加有利于精喹禾灵及其代谢物的降解。温度、湿度对精喹禾灵及其代谢物的降解一定程度上是因为影响了微生物活性。当然也改变了精喹禾灵化学降解的条件,这些都会改变两者的降解速率。去除有机质的试验表明,在贫瘠的土壤中,精喹禾灵及其代谢物的残留时间可能更长。
综上所述,微生物是影响精喹禾灵及其代谢物的最大影响因子,选择适合微生物生长的环境,更有利于精喹禾灵及其代谢物的快速降解。适宜的环境温度、较高的含水量和有机质含量条件对精喹禾灵的降解有促进作用。

