不同杀菌剂对小麦赤霉病及籽粒DON毒素的控制效果
陈宏州 吴佳文 庄义庆 杨红福 吴琴燕 徐超 缪康 姚克兵
摘要 :为探明不同杀菌剂对小麦赤霉病和小麦籽粒DON毒素(包括DON、3-ADON和15-ADON)的控制效果,采用菌丝生长速率法测定了12种药剂对禾谷镰刀菌野生型菌株PH-1的室内活性,同时采用液相色谱串联质谱法(LC-MS)测定了这些药剂对DON毒素的抑制效果,并开展了小麦赤霉病及籽粒DON毒素的田间防治试验。结果表明,12种原药对菌丝生长抑制活性强弱依次为氟唑菌酰羟胺>咪鲜胺>戊唑醇>丙硫菌唑>叶菌唑>氰烯菌酯>氟环唑>多菌灵>甲基硫菌灵>吡唑醚菌酯>嘧菌酯>井冈霉素A。氟环唑EC 50和EC 90离体胁迫均刺激DON毒素产生,其他杀菌剂EC 50和EC 90胁迫均抑制DON毒素产生。田间试验结果表明,200 g/L氟唑菌酰羟胺SC、30%丙硫菌唑OD和20%叶菌唑WP病指防效和DON防效为87.68%~94.77%;430 g/L戊唑醇SC、25%氰烯菌酯SC、45%咪鲜胺EW、25%氟环唑SC、50%多菌灵WP和70%甲基硫菌灵WP病指防效和DON防效为57.63%%~85.49%;250 g/L吡唑醚菌酯EC和250 g/L嘧菌酯SC病指防效分别为72.18%和51.98%,DON防效分别为43.06%和-7.96%;24%井冈霉素A AS病指防效和DON防效分别为42.37%和62.87%。药剂离体和田间控毒效果不完全一致,赤霉病有效防控是DON防控的前提,病害防效與DON防效不完全一致,本研究为小麦赤霉病及籽粒DON毒素防控提供了科学依据。
关键词 :小麦赤霉病; 禾谷镰刀菌; 毒力测定; 脱氧雪腐镰刀菌烯醇; 防治效果
中图分类号:
S 435.12.45
文献标识码: B
DOI: 10.16688/j.zwbh.2021084
Control efficacy of different fungicides on Fusarium head blight and deoxynivalenol in wheat grain
CHEN Hongzhou1, WU Jiawen2, ZHUANG Yiqing3, YANG Hongfu1, WU Qinyan1,
XU Chao1, MIAO Kang1, YAO Kebing1*
(1.Zhenjiang Institute of Agricultural Sciences in Hilly Area of Jiangsu Province, Jurong 212400, China;
2.Plant Protection and Quarantine Station of Jiangsu Province, Nanjing 210036, China;
3.Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract
In order to investigate the control efficacy of different fungicides on Fusarium head blight (FHB) and deoxynivalenol (DON) (containing DON, 3-acetyl-deoxynivalenol (3-ANON) and 15-acetyl-deoxynivalenol (15-ADON), the same below) in wheat grain, the indoor activity of 12 fungicides to Fusarium graminearum wild-type strain PH-1 was detected by using mycelium growth rate method, the inhibitory effect of these fungicides on DON was detected by using liquid chromatography tandem mass spectrometry (LC-MS) method, and the field control tests on FHB and DON in wheat grain was also conducted.Indoor toxicity tests showed that the inhibiting activity of 12 fungicides TC to mycelium growth were in the following order: pydiflumetofen > prochloraz > tebuconazole > prothioconazole > metconazole > phenamacril > epoxiconazole > carbendazim > thiophanate-methyl > pyraclostrobin > azoxystrobin > validamycin A.Epoxiconazole at the concentration of EC 50 and EC 90stimulated the production of DON in vitro, while other fungicides at the concentration of EC 50 and EC90 inhibited the production of DON.Field trials showed that the FHB disease index (DI) and DON control efficacy of pydiflumetofen 200 g/L SC, prothionazole 30% OD and metconazole 20% WP were 87.68%-94.77%, while those of tebuconazole 430 g/L SC, phenamacril 25% SC, prochloraz 45% EW, epoxiconazole 25% SC, carbendazim 50% WP and thiophanate-methyl 70% WP were 57.63%-85.49%.The DI control efficacy of pyraclostrobin 250 g/L EC and azoxystrobin 250 g/L SC were 72.18% and 51.98%, respectively, and the DON control efficacy were 43.06% and -7.96%, respectively.The DI and DON control efficacy of validamycin A 24% AS were 42.37% and 62.87%, respectively.The DON control efficacy of fungicides in vitro and in field was not completely consistent.Effective FHB control was the premise of DON control.The control efficacy of FHB was not completely consistent with that of DON.The results provides a scientific basis for the control of FHB and DON in wheat grain.
Key words
Fusarium head blight; Fusarium graminearum; toxicity test; deoxynivalenol; control efficacy
主要由禾谷镰刀菌Fusarium graminearum(有性态:玉蜀黍赤霉Gibberella zeae)和亚洲镰刀菌F.asiaticum引起的小麦赤霉病(Fusarium head blight, FHB)[12],在世界各地均有发生,不仅会造成小麦减产,而且病菌还会产生多种真菌毒素,如:脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)及其乙酰化衍生物(3A-DON和15A-DON)、雪腐镰刀菌烯醇(nivalenol)、玉米赤霉烯酮(zearalenone)等,带来食品安全问题[34]。此外,带菌种子还是赤霉病初侵染源之一[5]。
近年来,由于缺乏有效的抗病品种、气候条件变化、秸秆还田以及抗多菌灵病原种群的迅速扩展等原因,赤霉病导致我国每年超过500万hm2(约20%)的小麦严重减产[6],并且病害呈北擴西移态势,常发区已扩展到黄淮南部麦区,西北麦区病害发生也明显加重[7]。在我国,DON是污染小麦的主要真菌毒素,据报道,2010年安徽和江苏省小麦籽粒样品DON检出率达89.3%,DON含量在259~4 975 μg/kg之间,平均为1 962 μg/kg,约70%的籽粒样品DON含量超标(高于1 000 μg/kg)[8]。欧洲食品安全局(European Food Safety Authority)调查显示,2007年-2012年欧盟供人食用的谷物样品中DON(包括DON、3A-DON和15A-DON)检出率达43.5%,35.7%的样品DON含量高于100 μg/kg,DON含量均值为112 μg/kg,其中3A-DON和15A-DON平均占比达20%[9]。美国谷物化学家协会(American Association of Cereal Chemists)报告称,2003年-2014年美国运至面粉加工厂的小麦样品中有18.9%的样品DON含量至少达300~500 μg/kg,30%以上的软质小麦样品DON含量超过2 000 μg/kg,2014年样品DON含量均值为850 μg/kg[10]。DON性质稳定,耐热、耐压、耐弱酸、耐储藏,一般的食品加工不能破坏其结构,加碱或高压处理才可破坏部分毒素,具有细胞毒性,可引起人畜急慢性中毒,被国际癌症研究机构(International Agency for Research on Cancer)列为第三类致癌物[11]。依据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations)规定,人体DON临时最大每日耐受摄入量为1 μg/(kg·d)。许多国家都制定了毒素限量标准,我国《食品安全国家标准食品中真菌毒素限量》(GB2761-2017)中规定谷物及其制品中DON限量为1 000 μg/kg[12],美国、欧盟和加拿大食品中DON限量指标分别为1 000、500 μg/kg和2 000 μg/kg[13]。鉴于当前赤霉病危害与籽粒毒素污染现状,急需优化赤霉病防治药剂,有效防治病害的同时降低毒素污染,确保小麦高产稳产、保障食品质量安全。
为探明不同杀菌剂对小麦赤霉病和籽粒DON毒素(包括DON、3-ADON和15-ADON,下同)的控制效果,笔者采用菌丝生长速率法分别检测了氟唑菌酰羟胺、咪鲜胺、戊唑醇、丙硫菌唑、叶菌唑、氰烯菌酯、氟环唑、多菌灵、甲基硫菌灵、吡唑醚菌酯、嘧菌酯和井冈霉素A等12种原药对禾谷镰刀菌野生型菌株PH-1的室内毒力,采用液相色谱串联质谱法(LC-MS)分别检测了12种原药对PH-1菌株菌丝生长抑制EC 50和EC 90浓度离体胁迫下DON毒素产量,并进行了200 g/L氟唑菌酰羟胺SC、45%咪鲜胺EW、430 g/L戊唑醇SC、30%丙硫菌唑OD、20%叶菌唑WP、25%氰烯菌酯SC、25%氟环唑SC、50%多菌灵WP、70%甲基硫菌灵WP、250 g/L吡唑醚菌酯EC、250 g/L嘧菌酯SC和24%井冈霉素A AS等12种单剂推荐剂量下对小麦赤霉病及籽粒DON毒素的田间防治试验,以期为小麦赤霉病防治及降低籽粒DON毒素污染提供科学依据。
1 材料与方法
1.1 材料
供试菌株:禾谷镰刀菌野生型菌株PH-1(F.graminearum PH-1)[14],由江苏省农业科学院植物保护研究所提供。
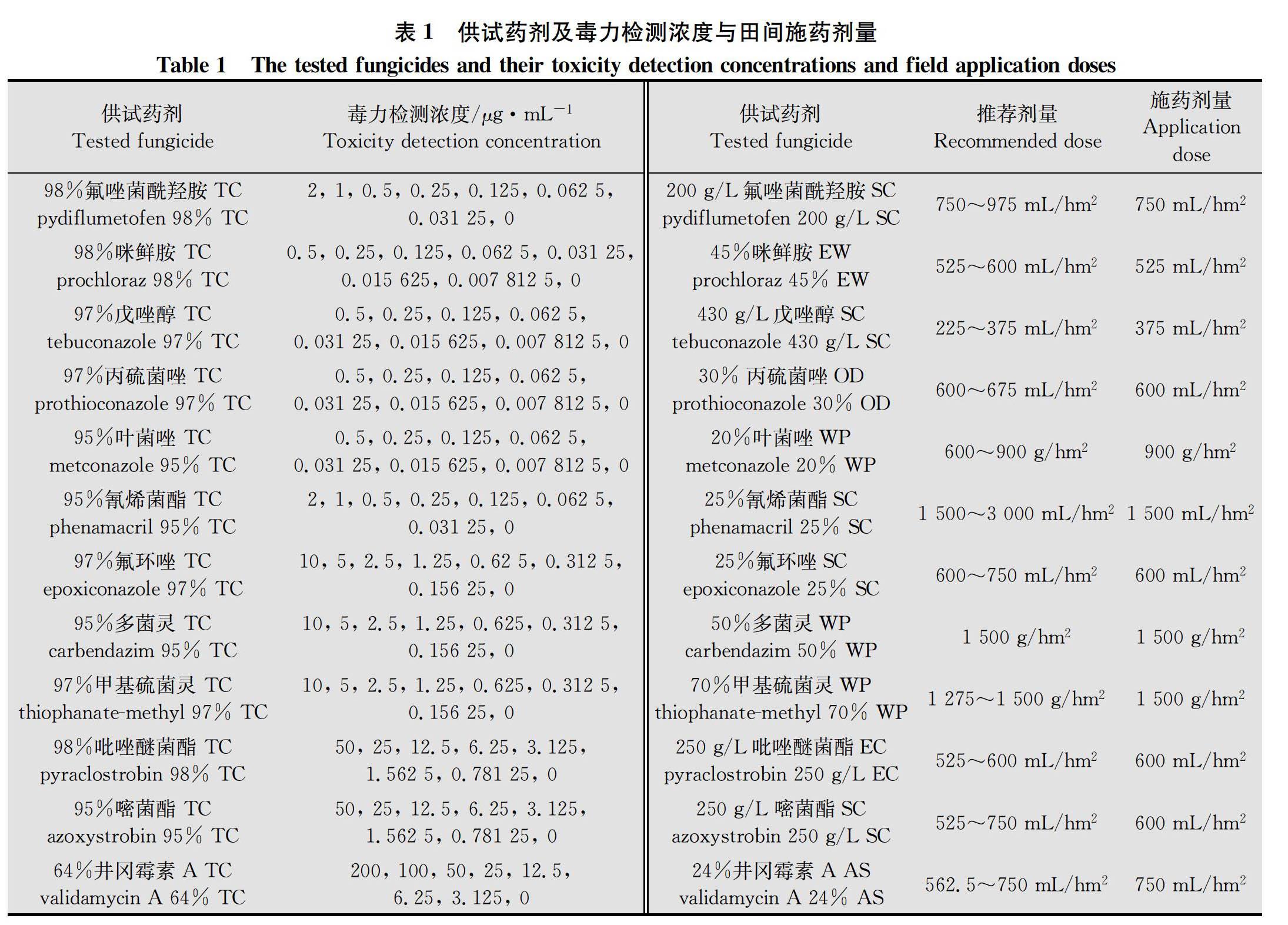
供试药剂:98%氟唑菌酰羟胺原药(TC)、 200 g/L氟唑菌酰羟胺悬浮剂(SC),瑞士先正达作物保护有限公司;98%咪鲜胺原药、95%叶菌唑原药、95%多菌灵原药,江苏辉丰生物农业股份有限公司;97%戊唑醇原药,江苏中旗作物保护股份有限公司;97%丙硫菌唑原药、30%丙硫菌唑可分散油悬浮剂(OD),安徽久易农业股份有限公司;95%氰烯菌酯原药、25%氰烯菌酯悬浮剂(SC),江苏省农药研究所股份有限公司;97%氟环唑原药、50%多菌灵可湿性粉剂(WP),江苏蓝丰生物化工股份有限公司;97%甲基硫菌灵原药,江苏嘉隆化工有限公司;98%吡唑醚菌酯原药,江苏宝灵化工股份有限公司;95%嘧菌酯原药,利尔化学股份有限公司;64%井冈霉素A原药,浙江省桐庐汇丰生物科技有限公司;45%咪鲜胺水乳剂(EW),江苏华农生物化学有限公司;430 g/L戊唑醇悬浮剂,拜耳作物科学(中国)有限公司;20%叶菌唑可湿性粉剂(试验样品),江苏省绿盾植保农药实验有限公司;25%氟环唑悬浮剂,青岛中达农业科技有限公司;70%甲基硫菌灵可湿性粉剂,扬州市苏灵农药化工有限公司;250 g/L吡唑醚菌酯乳油(EC),江苏耘农化工有限公司;250 g/L嘧菌酯悬浮剂,江阴苏利化学股份有限公司;24%井冈霉素A水剂(AS),武汉科诺生物科技股份有限公司(表1)。供试12种原药用于室内毒力测定及离体控毒试验,12种制剂用于田间试验。将95%多菌灵原药用适量0.1 mol/L盐酸溶液溶解,64%井冈霉素A 原药用适量无菌水溶解,其他原药分别用适量丙酮溶解后用无菌水定容至一定体积,并加入5%的吐温80作为乳化剂,各药剂均配制成50 000 μg/mL的母液冷藏备用。
供试培养基及植物:马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基:去皮马铃薯200 g、葡萄糖20 g、琼脂18 g、蒸馏水1 L,用于PH-1菌株的培养、保存及室内药剂试验;绿豆汤(mung bean broth, MBB)培养基:绿豆60 g、蒸馏水1 L,用于PH-1分生孢子培养;蔗糖硫酸铵培养基:蔗糖30 g、(NH 4) 2SO 4 2 g、KH 2PO 4 1 g、MgSO 4·7H 2O 0.5 g、KCl 0.5 g、FeSO 4·7H 2O 0.01 g、200 μL微量元素溶液(每100 mL含量:柠檬酸5 g、ZnSO 4·7H 2O 5 g、CuSO 4·5H 2O 0.25 g、MnSO 4·H 2O 0.05 g、H 3BO 3 0.05 g、NaMoO 4·2H 2O 0.05 g)、蒸馏水1 L、pH 6.5,用于PH-1菌株离体产毒培养。‘镇麦12号’麦种,由江苏丘陵地区镇江农业科学研究所提供,属春性中熟小麦品种。
试剂及仪器:丙酮(分析纯),国药集团化学试剂有限公司;甲醇和乙腈(色谱纯),美国默克公司;HPLC级乙酸铵,德国CNW公司;DON、3-ADON、15-ADON标准品(浓度均为100 mg/mL),美国Romer国际贸易有限公司。99%水杨肟酸(salicylhydroxamic acid, SHAM),美国Acros Organics公司,用适量甲醇溶解,配制成50 000 μg/mL的母液冷藏备用。GZP-300A型智能光照培养箱,南京恒裕仪器设备制造有限公司;THZ-702B型振荡培养箱,太仓华大实验仪器科技有限公司;Agilent 1290 型UPLC系统,安捷伦科技(中国)有限公司;AB Sciex 4500 质谱检测器,美国AB Sciex公司;AWL-020I-P超纯水系统,美国艾科浦国际有限公司; TTL-DCII型氮吹仪,北京同泰联科技发展有限公司;H2050R型离心机,湖南湘仪实验室仪器开发有限公司;KQ-250E 型超声波清洗器,昆山禾创超声仪器有限公司;YK-200B高速粉碎机,山东省青州市益康中药机械配件厂。
1.2 方法
1.2.1 不同杀菌剂对PH-1菌株的室内毒力测定
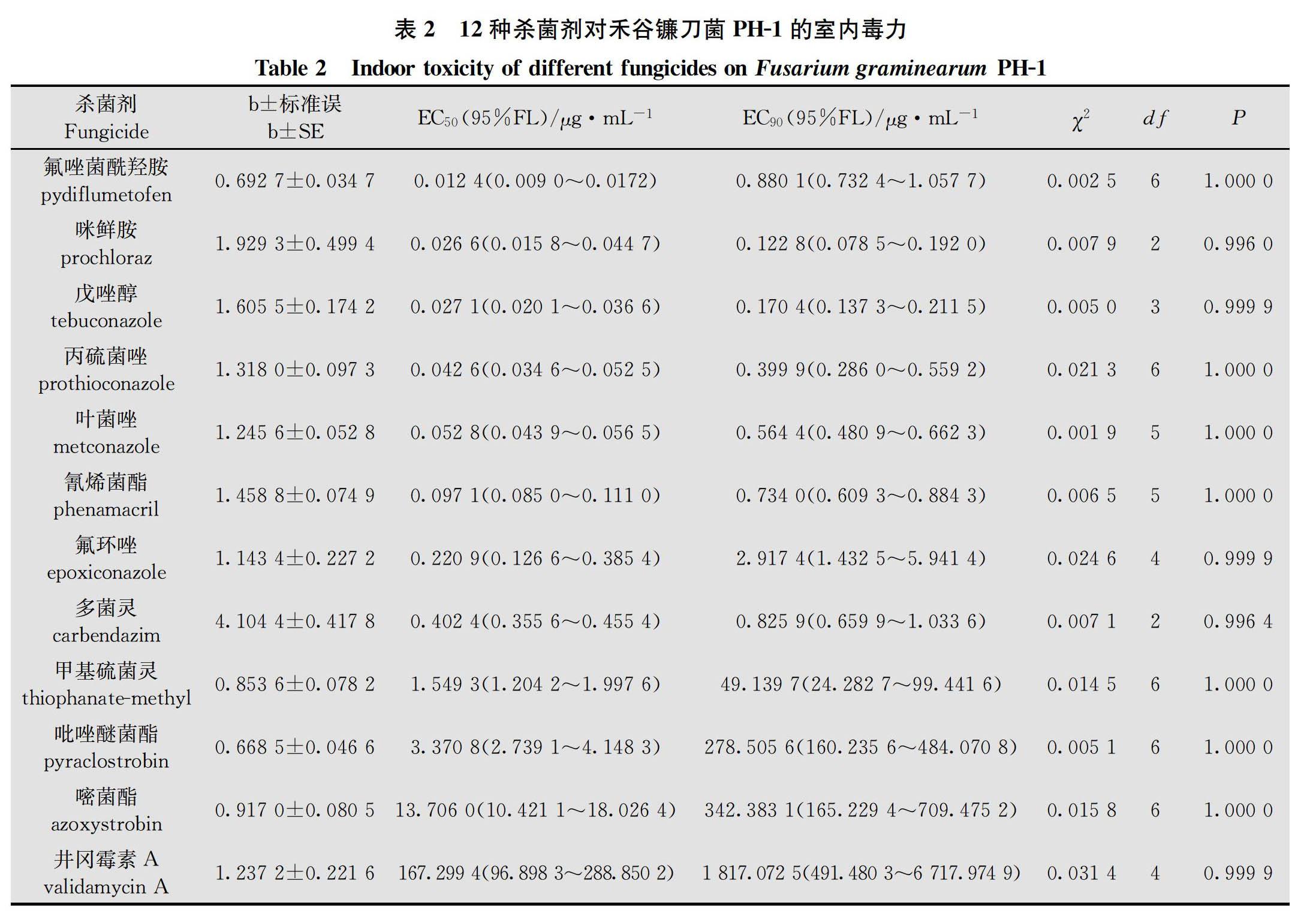
采用菌丝生长速率法[15],在预试验的基础上分别将12种原药按有效剂量进行2倍梯度稀释,获得7个不同浓度梯度的含药PDA培养基,以添加无菌水作空白对照。吡唑醚菌酯和嘧菌酯的处理与对照中均加入100 μg/mL的旁路氧化酶抑制剂SHAM,各处理重复4次(表2)。将PH-1菌株转接至PDA中,28℃活化72 h,然后在菌落边缘打取直径为4 mm的菌饼,并分别转接到含药和对照PDA中,28℃培养72 h,待对照平皿菌落长至平皿直径约4/5时,采用十字交叉法测量各处理的菌落直径,并计算菌丝生长平均抑制率。菌丝生长平均抑制率=(对照菌落平均直径-处理菌落平均直径)/(对照菌落平均直径-接种菌饼直径)×100%。采用DPS 7.05数据处理系统,基于各药剂对菌丝生长平均抑制率为5%至95%的毒力测定数据,分别计算出12种原药对PH-1菌株菌丝生长抑制的毒力回归方程、EC 50和EC 90及95%置信限等参数,并对毒力回归方程进行卡方检验。
1.2.2 不同杀菌剂离体胁迫下PH-1菌株产DON毒素检测
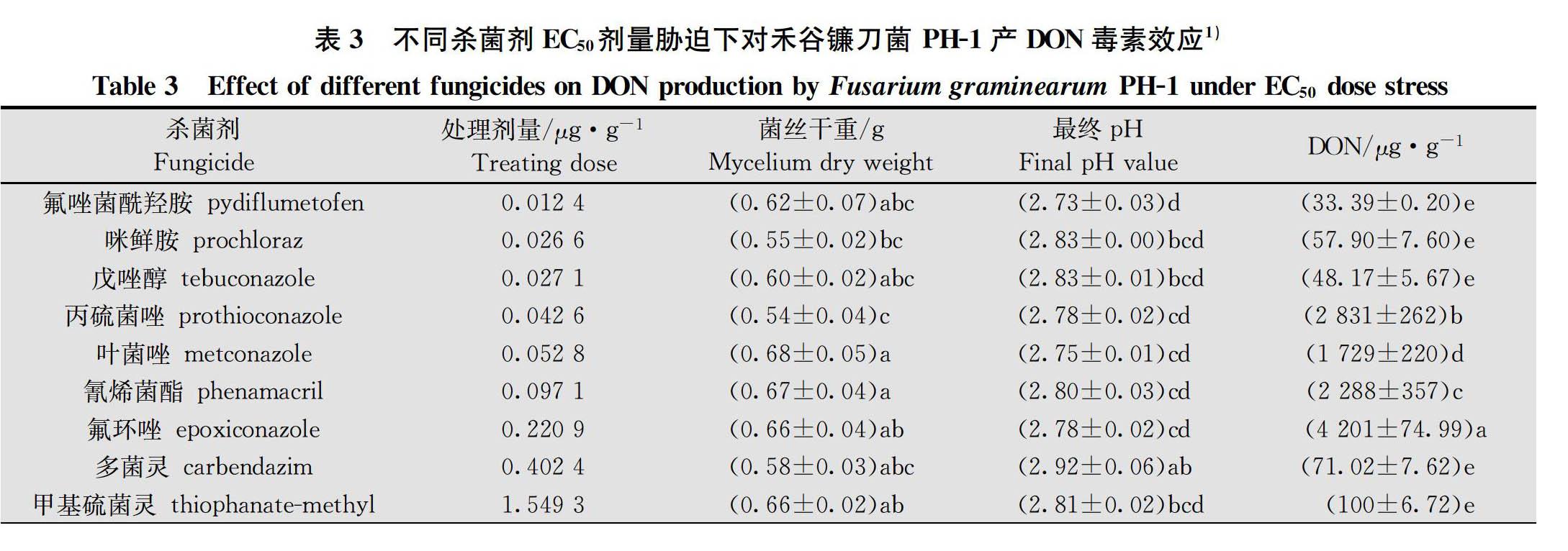
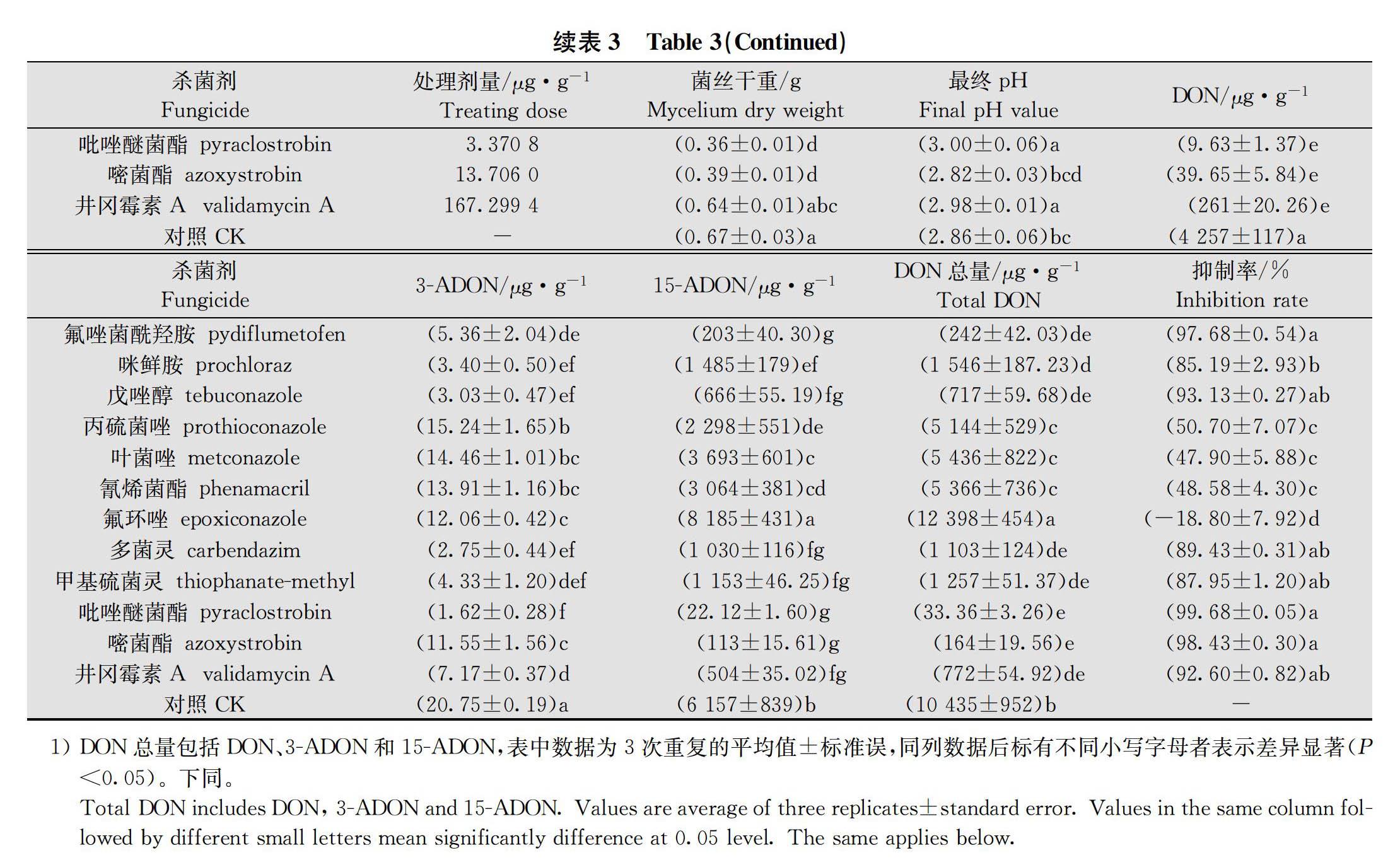
将PH-1菌株转接PDA平皿中,28℃活化72 h,接种于含MBB培养基的250 mL三角瓶(100 mL/瓶) 后置于摇床,28℃、180 r/min暗培养7 d后收集分生孢子悬浮液备用。配制蔗糖硫酸铵培养基并分装至250 mL三角瓶(100 mL/瓶),121℃下湿热灭菌20 min,冷卻至室温后接种分生孢子悬浮液(接种浓度为1.0×105个/mL),28℃、140 r/min 暗培养7 d。培养12 h 时,每瓶分别加入1 mL氟唑菌酰羟胺、咪鲜胺、戊唑醇等12种原药母液,并使培养基中的药剂终浓度为相应药剂对PH-1菌株菌丝生长抑制的EC 50和EC 90,以添加1 mL无菌水为空白对照。各处理重复3次,试验重复3次。培养7 d测定培养液pH后,用1号Whatman滤纸过滤,滤液于-20℃冷冻保存以备DON毒素检测,菌丝体用无菌水冲洗两次[16]。菌丝体置于干燥箱中60℃烘干至恒重,用电子天平称量其重量。
采用液相色谱串联质谱法(LC-MS)略作改进检测PH-1菌株培养滤液DON毒素[17]。分别将各处理的培养滤液置于室温复溶后放在摇床上140 r/min振荡30 min,然后2 500 r/min 离心5 min取上清液(待检液)备用;将氨基柱置于固相萃取装置上用 2 mL甲醇活化(弃滤液),活化后加入2 mL待检液过柱,过柱后再用2 mL 甲醇洗脱2次,收集流出液,将收集到的滤液氮吹干后用1 mL流动相重溶后待上机检测。LC-MS检测条件:Agilent 1290型UPLC系统,色谱柱:Agilent C 18柱(柱长100 mm,柱内径2.1 mm,填料粒径1.7 μm),柱温:40℃;进样量:2 μL;流速:0.2 mL/min;流动相:A(5 mmol/L醋酸铵水溶液),B(10%甲醇);梯度洗脱:90% A-10% B(0~1 min),10% A-90% B(4~5min),10% A-90% B(6min),90% A-10% B(6~10min)。AB Sciex 4500质谱,离子化模式:电喷雾电离模式(ESI);质谱扫描方式:多反应监测模式(MRM);离子源温度:500 ℃;驻留时间:100 ms;雾化气:50 psi;辅助气:50 psi;气帘气:35 psi;喷雾电压:5 500 V (ESI+);碰撞室射出电压:6 V (ESI+);DON、3-ADON 和 15-ADON母离子分别为297.2、339 Da和339 Da,DON、3-ADON和15-ADON定量子离子分别为249、231 Da和137 Da。
DON毒素以DON毒素的产量/菌丝干重(μg/g菌丝干重)的量表述,并计算不同杀菌剂离体胁迫下PH-1菌株产DON毒素抑制率。DON毒素抑制率=(对照DON毒素-处理DON毒素)/对照DON毒素×100%。
1.2.3 不同杀菌剂对小麦赤霉病及籽粒DON毒素的田间防控试验
于2019年10月至2020年5月,在江苏丘陵地区镇江农业科学研究所农业科技创新中心试验田(119.30°E,31.96°N,海拔21 m)进行12种药剂对赤霉病及籽粒DON毒素的田间防控试验。试验田土壤为下蜀马肝土,有机质含量中等,供试小麦品种为‘镇麦12号’。近年来试验田块赤霉病均发生较重,小麦生育期内肥水及虫草害按常规管理。试验设200 g/L氟唑菌酰羟胺SC、45%咪鲜胺EW、430 g/L戊唑醇SC、30%丙硫菌唑OD、 20%叶菌唑WP、25%氰烯菌酯SC、25%氟环唑SC、50%多菌灵WP、70%甲基硫菌灵WP、250 g/L吡唑醚菌酯EC、250 g/L嘧菌酯SC和24%井冈霉素A AS 等12个单剂处理,各药剂施药剂量均为厂家推荐剂量(表1)。以喷施等量清水为对照,每个处理重复3次,共39个小区,小区面积为30 m2,小区设保护行并随机区组排列。施药2次,间隔7 d,小麦扬花约10%(2020年4月13日)时使用郑州绿帝农用机械有限公司生产的WBD-16型电动喷雾器第1次均匀喷雾施药。喷液量为600 L/hm2,对照区喷施等量清水,施药后至试验结束,不喷施其他任何药剂。
赤霉病发生稳定后(2020年5月11日)调查发病情况,采用对角线五点取样,每处理调查500穗,病穗严重度分级标准及数据处理方法参照江苏省农作物病虫害预测预报方法[18]。病情指数和防治效果计算公式分别为:病情指数=Σ(各级病穗数×相应病级数值)/(调查总穗数×最高级代表值)×100;防治效果=(對照病情指数-处理病情指数)/对照病情指数×100%。
小麦成熟后(2020年5月29日),所有处理的每个小区对角线五点取样,每点剪取0.25 m2的所有麦穗,人工脱粒并晒干混匀后将各处理的籽粒样品用高速粉碎机进行粉碎,过20目筛,严格清理以免相互污染,收集各处理样品粉末进行DON毒素检测。采用液相色谱串联质谱法(LC-MS)略作改进检测样品粉末DON毒素[17],称取5 g样本粉末置于50 mL离心管中,加入25 mL 84%乙腈溶液(提取液)后置于摇床上140 r/min振荡30 min,3 000 r/min离心5 min取上清液后石墨化碳柱过滤,收集的溶液氮气吹干,用1 mL 10%甲醇复溶,再用0.22 μm微孔滤膜过滤后上机检测,LC-MS检测条件同1.2.2。DON毒素含量以DON毒素的总量/样品粉末干重(ng/g或μg/g粉末干重)的量表述,并计算不同杀菌剂对籽粒DON毒素的防治效果。DON毒素防效=(对照DON毒素含量-处理DON毒素含量)/对照DON毒素含量×100%。
1.3 数据分析
采用DPS 7.05数据处理系统对试验数据进行统计分析,应用Duncan氏新复极差法进行差异显著性检验;采用Excel软件进行不同杀菌剂对赤霉病病指防效和籽粒DON毒素防效相关性分析并制图。
2 结果与分析
2.1 不同杀菌剂对PH-1菌株的室内毒力
室内毒力测定结果得出,12种原药对PH-1菌株的室内毒力由高至低依次为氟唑菌酰羟胺>咪鲜胺>戊唑醇>丙硫菌唑>叶菌唑>氰烯菌酯>氟环唑>多菌灵>甲基硫菌灵>吡唑醚菌酯>嘧菌酯>井冈霉素A;氟唑菌酰羟胺、咪鲜胺、戊唑醇、丙硫菌唑、叶菌唑、氰烯菌酯对PH-1菌株菌丝生长抑制EC 50为0.012 4~0.097 1 μg/mL,对菌丝生长抑制活性整体较高;氟环唑、多菌灵和甲基硫菌灵EC 50为0.220 9~1.549 3 μg/mL,对菌丝生长抑制活性中等;吡唑醚菌酯和嘧菌酯EC 50分别为3.370 8 μg/mL和13.706 0 μg/mL,对菌丝生长抑制活性相对较低;农用抗生素类杀菌剂井冈霉素A EC 50为167.299 4 μg/mL,对菌丝生长抑制活性最低(表2)。
2.2 不同杀菌剂离体胁迫下PH-1菌株产DON毒素效应
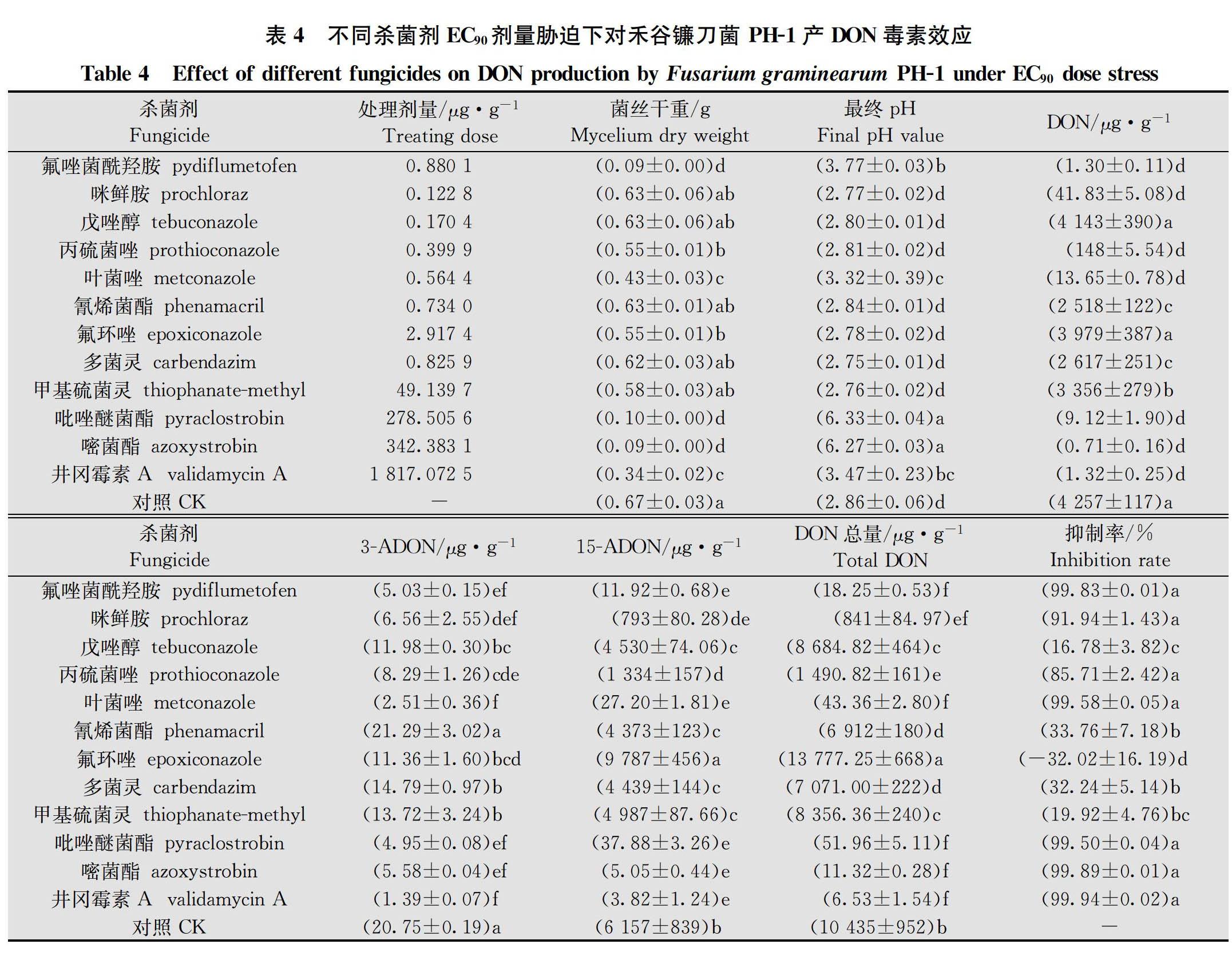
在分别以蔗糖和硫酸铵为碳氮源的蔗糖硫酸铵液体培养基中,12种杀菌剂原药对PH-1菌株菌丝生长抑制EC 50和EC 90浓度离体胁迫下产DON毒素(包括DON、3-ADON和15-ADON)检测结果得出,
12种供试杀菌剂在EC 50浓度胁迫下对PH-1菌株产DON毒素抑制率为-18.80%~99.68%,EC 90浓度胁迫下对PH-1菌株产DON毒素抑制率为-32.02%~99.94%;氟唑菌酰羟胺、甲氧基丙烯酸酯类杀菌剂吡唑醚菌酯和嘧菌酯以及农用抗生素类杀菌剂井冈霉素A对禾谷镰刀菌产DON毒素均具有优良抑制效果;咪唑类杀菌剂咪鲜胺,三唑类杀菌剂戊唑醇、丙硫菌唑和叶菌唑以及苯并咪唑类杀菌剂多菌灵和甲基硫菌灵对产DON毒素均具不同程度的抑制效果,但剂量效应波动较大;氰烯菌酯对产DON毒素抑制效果较差;三唑类杀菌剂氟环唑刺激DON毒素产生(表3~表4)。
2.3 不同杀菌剂对小麦赤霉病及籽粒DON毒素的田间防效
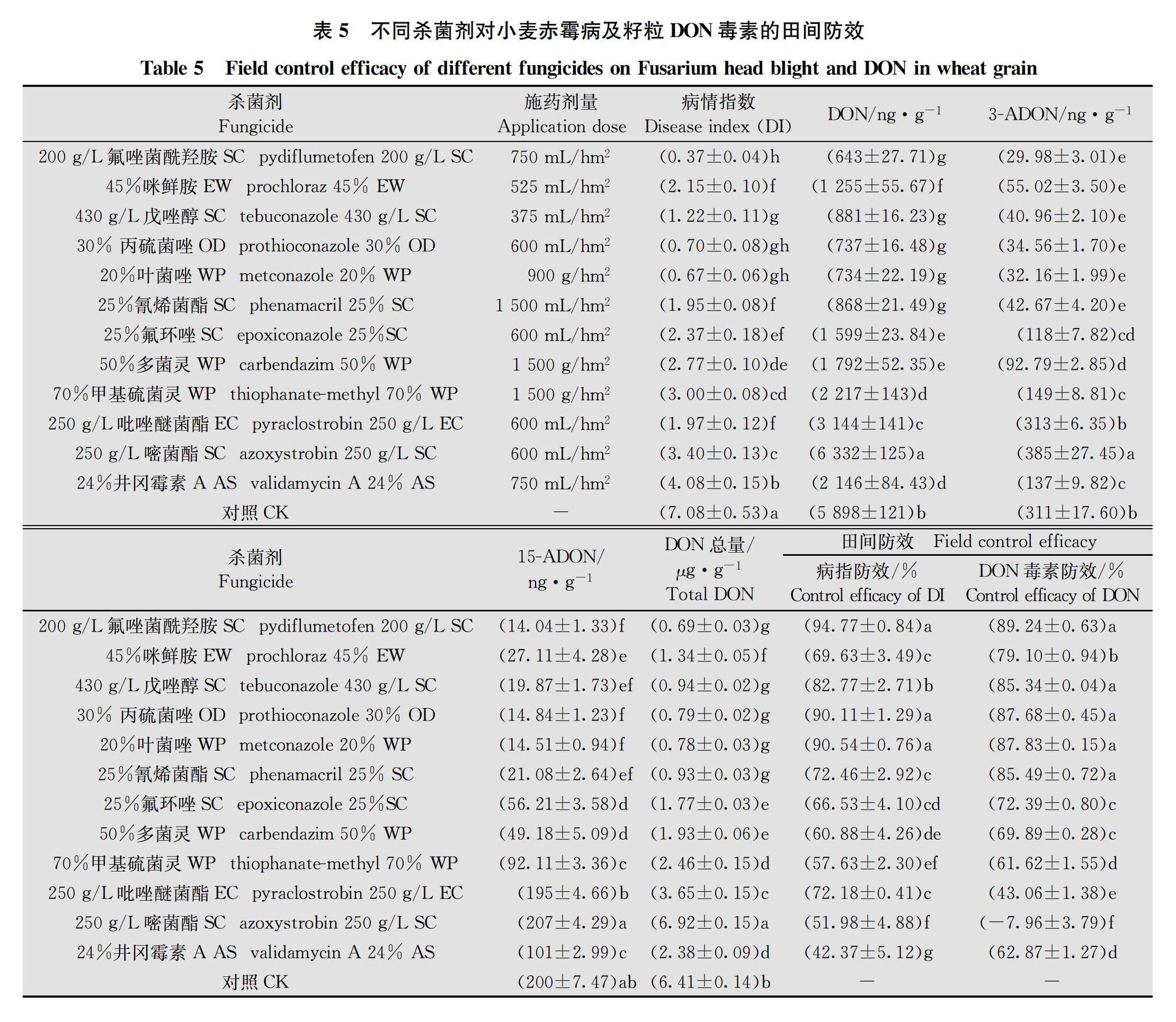
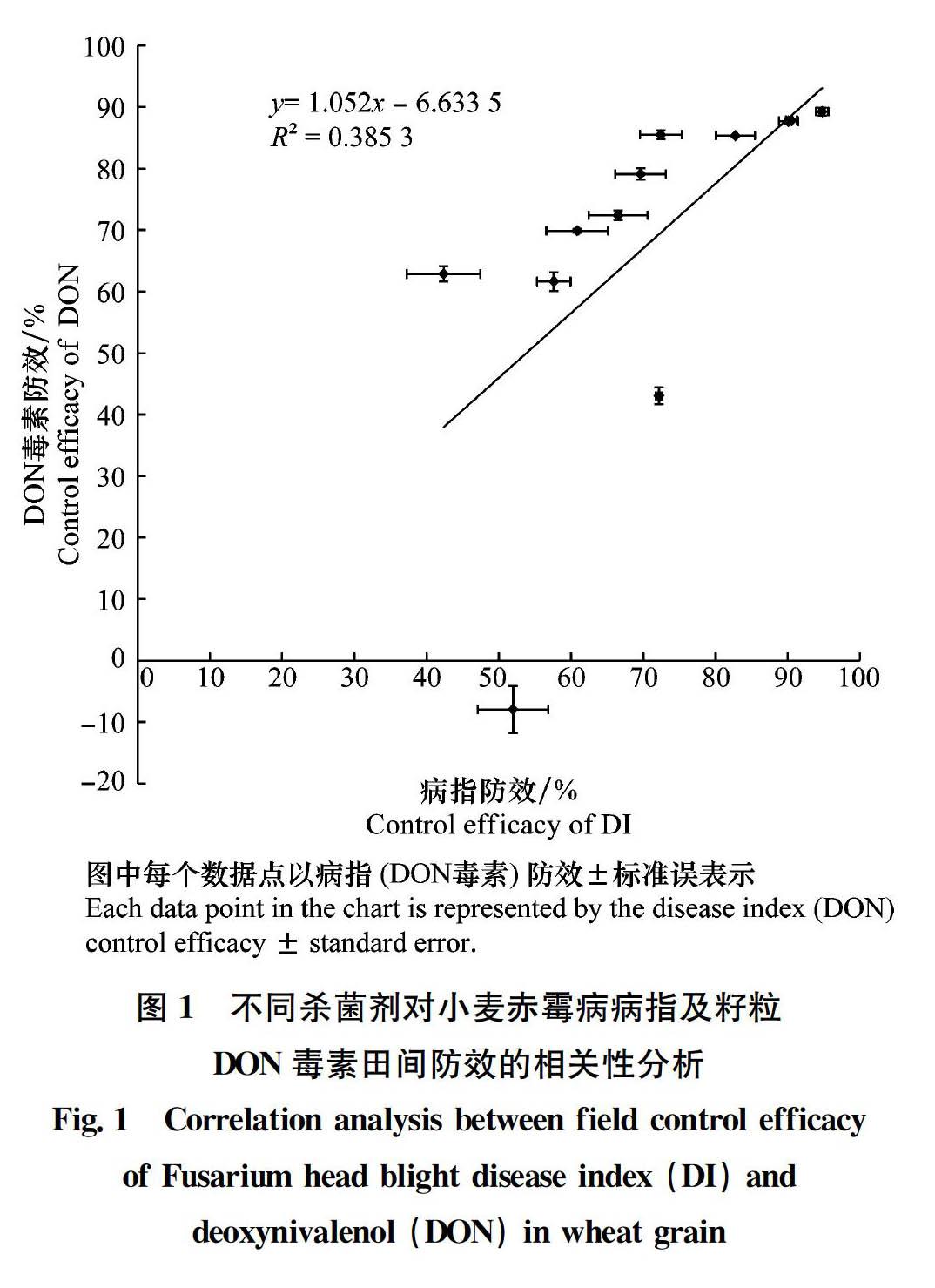
田间试验结果得出,200 g/L氟唑菌酰羟胺SC 750 mL/hm2对赤霉病病指防效和小麦籽粒DON毒素(包括DON、3-ADON和15-ADON)防效均最高,分别为94.77%和89.24%; 24%井冈霉素A AS 750 mL/hm2病指防效最低,防效为42.37%;250 g/L嘧菌酯SC 600 mL/hm2 DON防效最低,防效为-7.96%。基于推荐剂量下对赤霉病和籽粒DON毒素的田间防效,12种药剂大致可分为以下6个类别: 1)200 g/L氟唑菌酰羟胺SC、30%丙硫菌唑OD 和20%叶菌唑WP等3种制剂,对赤霉病及籽粒毒素防效优良; 2)430 g/L戊唑醇SC和25%氰烯菌酯SC等2种制剂,对赤霉病及籽粒毒素防效约为72%~85%,防效良好; 3)45%咪鲜胺EW和25%氟环唑SC等2种制剂,对赤霉病及籽粒毒素防效约为66%~79%,防效一般; 4)50%多菌灵WP和70%甲基硫菌灵WP等2种制剂,对赤霉病及籽粒毒素防效约为57%~69%,防效较差; 5)250 g/L吡唑醚菌酯EC和250 g/L嘧菌酯SC等2种制剂,对赤霉病病指防效不突出,并且对籽粒DON毒素防效明显低于病指防效,甚至增加籽粒毒素污染;6)24%井冈霉素A AS,对赤霉病病指防效较差,但对籽粒毒素防效明显高于病指防效,具一定的降低籽粒毒素污染作用(表5)。12种单剂对赤霉病病指防效和籽粒DON毒素防效的线性相关性分析得出,线性回归方程为y=1.052x-6.633 4, R2值为0.385 3,在0.05水平上显著(图1)。这表明,病指防效与毒素防效不完全一致,不同杀菌剂对赤霉病及籽粒毒素的田间防效呈正相关。
3 讨论
长期以来,小麦赤霉病危害造成的产量损失与毒素污染一直是全球普遍关注的问题[19],由于缺乏有效的抗病品种,药剂防治仍是减轻赤霉病危害和毒素污染的主要措施[20]。我国防治赤霉病的药剂较多,但真正高效防治赤霉病,同时又显著降低毒素污染的品种并不多。因此,寻求和开发新型药剂防治赤霉病以达到高防效、降毒素、增产量、提品质的目的尤为重要。在本研究中,琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitor, SDHI)类杀菌剂氟唑菌酰羟胺,对禾谷镰刀菌PH-1菌株的抑菌活性、离体控毒效果以及田间病害防效和DON毒素防效均非常优异。SDHI类杀菌剂氟唑菌酰羟胺,也是全球范围内不可多得的赤霉病高防效药剂,已于2019年在我国获得正式登记并成为赤霉病防治药剂的强有力补充,应用前景广阔。SDHI类杀菌剂大多作用位点单一,抗性发展水平较高,因此,在生产中需将氟唑菌酰羟胺与其他不同作用机理的杀菌剂复配或轮换使用。
在赤霉病防治药剂中,甾醇脱甲基抑制剂 (demethylation inhibitor, DMI) 类杀菌剂是最常用药剂,如戊唑醇、叶菌唑和丙硫菌唑等多种DMI类杀菌剂可有效防控赤霉病并降低毒素污染[21]。在本研究中,戊唑醇、丙硫菌唑和叶菌唑等DMI类杀菌剂均对禾谷镰刀菌PH-1菌丝生长具优良抑制活性,离体胁迫下具有不同程度的控毒效果但剂量效应波动较大,田间病害和DON毒素防效较好,尤其是丙硫菌唑和叶菌唑对赤霉病及籽粒毒素防效优良。DMI类杀菌剂氟环唑离体条件下刺激DON毒素产生,但在田间对赤霉病及籽粒毒素防效與DMI类杀菌剂咪鲜胺相当。Duan等[22]报道氟环唑在离体条件下刺激DON产生及Tri5基因表达,但在田间氟环唑(225 g/hm2)对赤霉病及籽粒毒素防效优于多菌灵(750 g/hm2)而仅略低于氰烯菌酯(375 g/hm2),并且还具有延缓小麦植株衰老与增产的作用。Tang等[23]报道禾谷镰刀菌肌球蛋白I在其真菌毒素生物合成中起着关键作用,肌球蛋白抑制剂类杀菌剂氰烯菌酯能够抑制禾谷镰刀菌DON毒素合成;黄婷婷[24]报道在液体摇培条件下氰烯菌酯EC 50或EC 90剂量处理禾谷镰刀菌抗性菌株,菌株产毒能力均受强烈抑制,氰烯菌酯可有效控制菌株产毒能力。在本研究中,氰烯菌酯在EC 50和EC 90剂量胁迫的液体摇培条件下对产DON毒素抑制效果均较差,在田间对赤霉病及籽粒毒素污染防效良好。相关研究表明,甲氧基丙烯酸酯类杀菌剂嘧菌酯刺激禾谷镰刀菌产DON毒素,不建议用于赤霉病及DON毒素防控[2526]。Simpson等[27]报道嘧菌酯对不产毒病原菌如:雪腐镰刀菌Microdochium nivale等抑菌效果较好,而对产毒镰刀菌抑制效果较差,田间喷施嘧菌酯后菌群结构发生变化,产毒镰刀菌菌群占比上升,最终导致毒素污染增加。殷宪超等[28]报道嘧菌酯对小麦DON防效为负值,苯并咪唑类杀菌剂多菌灵对赤霉病和DON防效均较差,嘧菌酯和多菌灵不宜单独用于赤霉病和DON的防控。在本研究中,甲氧基丙烯酸酯类杀菌剂吡唑醚菌酯和嘧菌酯对禾谷镰刀菌菌丝生长抑制活性相对较低,离体胁迫下对禾谷镰刀菌产DON毒素均具优良抑制效果,在田间对赤霉病防效不佳,吡唑醚菌酯对籽粒毒素防效明显低于病指防效,嘧菌酯则增加籽粒毒素污染。苯并咪唑类杀菌剂多菌灵和甲基硫菌灵对禾谷镰刀菌菌丝生长抑制活性适中,离体胁迫下具有不同程度的控毒效果但剂量效应波动较大,田间病害和DON毒素防效较差。Li等[29]报道井冈霉素通过干扰海藻糖酶的活性抑制了禾谷镰刀菌DON生物合成,既降低了禾谷镰刀菌的致病力从而减轻了病害,又降低了小麦籽粒毒素污染;此外,井冈霉素还能诱导寄主抗性,增强了小麦对禾谷镰刀菌的抗性。在本研究中,井冈霉素A对禾谷镰刀菌菌丝生长抑制活性最低,离体胁迫下对禾谷镰刀菌产DON毒素具优良抑制效果,田间对赤霉病防效较差但对毒素防效明显高于病指防效,具一定的降低籽粒毒素污染作用。DON等单端孢霉烯族毒素的生物合成是以乙酰辅酶A为基本前提,起始于反式法尼基焦磷酸环化形成单端孢霉二烯,再经过一系列的加氧、异构化、环化和酯化反应,最终形成不同结构的毒素,毒素的生物合成受水分、温度、碳氮源、胺、pH、光和活性氧等多种因素影响[23,30]。可见,药剂离体控毒效果和田间控毒效果不完全一致。
相关研究表明,赤霉病病指与籽粒DON毒素污染呈显著正相关,这也预示着有效防控赤霉病也将减少籽粒DON毒素污染[31]。在本研究中,不同杀菌剂对赤霉病及籽粒DON毒素防效呈正相关,病害与毒素防效不完全一致,病害有效防控是毒素防控的前提。在赤霉病防控中,药剂防治已被广泛使用,但即使喷施最好的杀菌剂也不能完全有效地防控赤霉病。因此,赤霉病和籽粒毒素污染防控需采取包括种植抗病(耐病)品种、优化田间水肥管理、病害预测预报、药剂防治以及得当收获与贮藏措施等多方面的综合防控措施,方可达到理想效果,从而保障小麦优质安全高效生产。
参考文献
[1] O’DONNELL K, WARD T J, ABERRA D, et al. Multilocus genotyping and molecular phylogenetics resolve a novel head blight pathogen within the Fusarium graminearum species complex from Ethiopia [J]. Fungal Genetics and Biology, 45(11): 15141522.
[2] YLIMATTILA T, GAGKAEVA T, WARD T J, et al. A novel Asian clade within the Fusarium graminearum species complex includes a newly discovered cereal head blight pathogen from the Russian Far East [J]. Mycologia, 2009, 101(6): 841852.
[3] MCMULLEN M, JONES R, GALLENBERG D. Scab of wheat and barley: A re-emerging disease of devastating impact [J]. Plant Disease 1997, 81(12): 13401348.
[4] SCHMEITZL C, WARTH B, FRUHMANN P, et al. The metabolic fate of deoxynivalenol and its acetylated derivatives in a wheat suspension culture: identification and detection of DON-15-O-glucoside, 15-acetyl-DON-3-O-glucoside and 15-acetyl-DON-3-sulfate [J]. Toxins, 2015, 7(8): 31123126.
[5] PARRY D W, JENKINSON P, MCLEOD L, et al. Fusarium ear blight (scab) in small grain cereals-a review [J]. Plant Pathology, 1995, 44(2): 207238.
[6] LIU Ye, CHEN Xiang, JIANG Jinhua, et al. Detection and dynamics of different carbendazim-resistance conferring β-tubulin variants of Gibberella zeae collected from infected wheat heads and rice stubble in China [J]. Pest Management Science, 2014, 70(4): 12281236.
[7] 陳云, 王建强, 杨荣明, 等. 小麦赤霉病发生危害形势及防控对策[J]. 植物保护, 2017, 43(5):1117.
[8] CUI Li, SELVARAJ J N, XING Fuguo, et al. A minor survey of deoxynivalenol in Fusarium infected wheat from Yangtze-Huaihe river basin region in China [J]. Food Control, 2013, 30(2): 469473.
[9] European Food Safety Authority. Deoxynivalenol in food and feed: Occurrence and exposure [J]. EFSA Journal, 2013,11(10):156.
[10]BIANCHINI A, HORSLEY R, JACK M M, et al. DON occurrence in grains: a north American perspective [J]. Cereal Foods World, 2015, 60(1):3256.
[11]ROTTER B A, PRELUSKY D B, PESTKA J J. Toxicology of deoxynivalenol (vomitoxin) [J]. Journal of Toxicology & Environmental Health, 1996, 48(1):134.
[12]国家食品药品监督管理总局. 食品安全国家标准食品中真菌毒素限量: GB 2761-2017 [S]. 北京: 中国标准出版社, 2017.
[13]BAI Guihua, SHANER G. Management and resistance in wheat and barley to Fusarium head blight [J]. Annual Review of Phytopathology, 2004, 42(1):135161.
[14]CUOMO C A, GULDENER U, XU Jinrong, et al. The Fusarium graminearum genome reveals a link between localized polymorphism and pathogen specialization [J]. Science, 2007, 317(5843): 14001402.
[15]黄国洋. 农药试验技术与评价方法[M]. 北京: 中国农业出版社, 2000:3031.
[16]PINSON G L, RICHARD F F, FRASSE P, et al. Magnesium represses trichothecene biosynthesis and modulates Tri5, Tri6, and Tri12 genes expression in Fusarium graminearum [J]. Mycopathologia, 2008, 165(1): 5159.
[17]国家食品药品监督管理总局.食品安全国家标准食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定: GB 5009.111-2016 [S]. 北京: 中国标准出版社, 2016.
[18]江苏省植物保护站. 农作物主要病虫害预测预报与防治[M]. 南京: 江苏科学技术出版社, 2006: 15.
[19]DA ROCHA M E B, FREIRE F D C O, MAIA F E F, et al. Mycotoxins and their effects on human and animal health [J]. Food Control, 2014, 36(1): 159165.
[20]RUDD J C, HORSLEY R D, MCKENDRY A L, et al. Host plant resistance genes for Fusarium head blight: Sources, mechanisms, and utility in conventional breeding systems [J]. Crop Science, 2001, 41(3): 620627.
[21]PAUL P A, MCMULLEN M P, HERSHMAN D E, et al. Meta-analysis of the effects of triazole-based fungicides on wheat yield and test weight as influenced by Fusarium head blight intensity [J]. Phytopathology,2010, 100(2): 160171.
[22]DUAN Yabing, XIAO Xuemei, LI Tao, et al. Impact of epoxiconazole on Fusarium head blight control, grain yield and deoxynivalenol accumulation in wheat [J]. Pesticide Biochemistry and Physiology, 2018, 152: 138147.
[23]TANG Guangfei, CHEN Yun, XU Jinrong, et al. The fungal myosin I is essential for Fusarium toxisome formation [J/OL]. PLoS Pathogens, 2018, 14(1): e1006827. DOI: 10.1371/journal.ppat.1006827.
[24]黄婷婷. 多菌灵·氰烯菌酯对禾谷镰孢菌DON毒素合成的影响[D]. 南京: 南京农业大学, 2016.
[25]BLANDINO M, MINELLI L, REYNERI A. Strategies for the chemical control of Fusarium head blight: effect of yield, alveographic parameters and deoxynivalenol contamination in winter wheat grain [J]. European Journal of Agronomy, 2006, 25(3): 193201.
[26]徐飞, 王俊美, 杨共强, 等. 不同杀菌剂防治小麦赤霉病及减少籽粒中DON毒素积累的效果[J]. 植物保护, 2018, 44(3): 214219.
[27]SIMPSON D R, WESTON G E, TURNER J A, et al. Differential control of head blight pathogens of wheat by fungicides and consequences for mycotoxin contamination of grain [J]. European Journal of Plant Pathology, 2001, 107: 421431.
[28]殷宪超, 武德亮, 孟旭, 等. 不同殺菌剂及其复配制剂在小麦赤霉病及呕吐毒素防治中的作用[J]. 麦类作物学报, 2020, 40(10): 12751280.
[29]LI Jing, DUAN Yabing, BIAN Chuanhong, et al. Effects of validamycin in controlling Fusarium head blight caused by Fusarium graminearum: Inhibition of DON biosynthesis and induction of host resistance [J]. Pesticide Biochemistry and Physiology, 2019, 153: 152160.
[30]DESJARDINS A E. Fusarium mycotoxins: chemistry, genetics and biology [M]. St. Paul, MN, USA, APS Press, 2006: 3353.
[31]WEGULO S N. Factors influencing deoxynivalenol accumulation in small grain cereals [J].Toxins, 2012, 4(12): 11571180.
(责任编辑:田 喆)

