基于响应面设计茎段形成层培养猕猴桃幼苗的优化研究
段新钰 郭婷语 王朝兰 申婷 严胜柒 张云峰



摘 要: 为降低猕猴桃组培快繁中的污染率,提高其繁殖效率,該文以猕猴桃的幼嫩茎段为外植体,采用两步培养法进行茎段形成层的愈伤及成苗诱导研究,并利用响应面设计软件对NAA浓度、6-BA浓度、低渗处理时间进行了各条件的优化,同时通过组织切片确定愈伤的来源及幼苗的形成方式。结果表明:(1)培养过程中撕除茎段周皮能显著降低污染率,用200~400 mg·L-1的PVP处理猕猴桃茎段可有效防止去皮茎段的褐化。(2)愈伤诱导的最佳条件为预培养28.3 h、NAA 4.45 mg·L-1、6-BA 0.28 mg·L-1,而幼苗形成的最佳条件为预培养26.4 h、NAA 4.84 mg·L-1、6-BA 0.42 mg·L-1。这表明形成层愈伤诱导需较长低渗处理时间和较高生长素,而成苗诱导则需较高生长素、激动素及较短的低渗处理时间。(3)组织切片观察结果表明猕猴桃愈伤组织源于形成层干细胞的分裂,且幼苗株源于胚状体的发育。综上结果表明,通过除去猕猴桃嫩茎周皮,外加抗氧化、低渗处理,可有效降低猕猴桃组培快繁中的污染率,提高繁殖系数和胚状体发生率,为猕猴桃种苗的规模化生产提供技术支撑。
关键词: 猕猴桃, 组培快繁, 干细胞, 茎段形成层, 响应面设计软件
中图分类号: Q943.1; S663.4
文献标识码: A
文章编号: 1000-3142(2021)12-2091-09
收稿日期: 2020-01-11
基金项目: 国家自然科学基金(30660075,31960066);云南省自然科学基金(2009CD052);云南师范大学大学生科研训练基金(ky2018-132) [Supported by the National Natural Science Foundation of China (30660075,31960066); Natural Science Foundation of Yunnan Province (2009CD052); Student Scientific Training Fund Program of Yunnan Normal University (ky2018-132)]。
作者简介: 段新钰(1999-),主要从事生物技术研究, (E-mail)15126981896@163.com。
通信作者: 张云峰,教授,硕士生导师,主要从事植物资源与植物遗传等研究工作,(E-mail)zhyunfeng001@163.com。
Optimized study for plantlet inducing from cambium stem cell of young stem based on response surface design in Actinidia chinensis
DUAN Xinyu1, GUO Tingyu2, WANG Chaolan2, SHEN Ting2, YAN Shengqi2, ZHANG Yunfeng2*
( 1. School of Life Sciences, Yunnan Normal University, Kunming 650500, China; 2. Energy Development and Utilization, Ministry of Education, Kunming 650500, China )
Abstract: In order to reduce the contamination rate and improve the propagation efficiency during the Aitinidia chinensis tissue rapid propagation, the young stem segments of Aitinidia chinensis were used as explants, using the two-step culture method. The response surface design software had been used to optimize the condition or influencing factor for callus inducing and its differentiation in this experiment. The condition was designed at three levels for the concentration of NAA and 6-BA, and hypotonic treatment time, respectively. Meanwhile, the origin of callus and the way of seedling formation were determined by tissue section. The results were as follows: (1) The periderm of young stem was removed using tweezers under aseptic conditions can reduce the contamination rate, and the stems without periderm were treated with 200-400 mg·L-1 PVP to prevent stem browning. (2) The optimum condition for callus induction was 28.3 h for hypotonic treatment time, NAA and 6-BA concentration was 4.45 mg·L-1 and 0.28 mg·L-1, respectively. On the other hand, the optimum condition for callus differentiation or seedling formation was 26.4 h for hypotonic treatment time, NAA and 6-BA concentration was 4.84 mg·L-1 and 0.42 mg·L-1, respectively. That suggested that the formation of callus induction required a longer hypotonic treatment time and a higher content of auxin, and a higher content of auxin and kinetin and shorter hypotonic treatment time was required for plantlets inducing. (3) Furthermore, the slice observation during culture indicated that the inducing callus would be derived from division of cambium stem cell and the plantlets would be originated from embryoid development. To sum up, lower contaminated rate, higher propagation coefficient and somatic embryogenesis which had been obtained in this experiment would be based the foundation for the stable propagation system for kiwi fruit industrial culture.
Key words: Aitinidia chinensis, rapid propagation, stem cell, stem cambium, Design-Expert 8.06
獼猴桃(Aitinidia chinensis)为猕猴桃属(Actinidia Lindl)的多年生藤本植物,是20世纪人工驯化栽培野生果树中最为成功的树种之一(吴晓梅,2010),在全世界所发现的66个种及118个分类单元中,云南分布有56个种、变种及变型(黄宏文等,2000;胡忠荣等,2003)。猕猴桃作为一种雌雄异株植物,利用种子繁殖猕猴桃种苗,易造成品种退化,不利于优良性状的保持;采用扦插、嫁接等方法,工作效率及成活率又较低。利用组培快繁技术,不仅可较好地保持品种的优良性状,维持其遗传稳定性,而且可以缩短育苗周期,降低幼苗运输成本。因此,组培快繁已成为猕猴桃产业发展中的重要技术措施。
有关猕猴桃的组培快繁,目前已有大量的相关研究,其中包括外植体的灭菌方式、植物生长调节剂的组合、外植体愈伤诱导分化等条件的系统分析,并建立了相应的离体快繁体系。目前采用的外植体有叶片、茎段、腋芽等(陈红惠,2005;罗强和刘建林,2009;于非,2017;张玉杰,2014;文国琴和何震,2004;顾福明等,2018)。这些研究对猕猴桃快繁技术的研究及应用具有积极的促进作用。然而,当采用叶片、茎段、腋芽等为外植体时,由于叶表面具绒毛或茎段具裂缝,会造成组培快繁中污染率较高。植物干细胞,传统上又称为分生组织,是植物体内相对已分化为成熟组织的细胞团或细胞群(Aichinger et al., 2012; Sozzani & Iyer-Pascuzzi, 2014)。初生分生组织包括顶端分生组织、居间分生组织和花分生组织;次级分生组织包括形成层、木栓形成层和外伤形成的愈伤(Martyna et al., 2014;Heidstra et al., 2014)。研究表明,组织培养中所形成的愈伤也多源于干细胞中存在细胞群的形成及脱分化,表明干细胞在愈伤的形成过程中起到重要作用(Alison et al., 2002;Sugimoto et al., 2010; Kaoru et al., 2011)。由于植物形成层干细胞的细胞壁较薄,在分离过程中极易受损,导致植物干细胞的分离、纯化非常困难。而形成层干细胞中液泡较多,对渗透压的耐性较强,可利用渗透压处理以提高植物干细胞的成活率(Garces et al., 2007;Yu et al., 2010;Li et al., 2012)。
本实验以红阳猕猴桃的幼嫩茎段为实验材料,首先将茎段经消毒处理后撕除茎段周皮;其次通过两步培养法,在仅加生长素的低渗培养基中培养剥去周皮的猕猴桃茎段,促使形成层干细胞存活、分裂,降低其他细胞的活性;最后在正常培养基中培养经低渗处理的茎段或其切片,诱导其形成愈伤,并分化成苗,实现猕猴桃茎段形成层细胞的一次成苗诱导。这有效地解决了上述利用叶片或茎段为外植体存在的污染率较高、植物干细胞分离纯化非常困难等问题。
1 材料与方法
1.1 材料
材料为幼嫩的猕猴桃茎段,品种为红阳猕猴桃(Actinidia chinensis cv.‘Hongyang’)。
1.2 方法
1.2.1 外植体消毒 茎段先用自来水冲洗1~2 h后,用滤纸吸干表面水分,在无菌条件下,用75%的无水乙醇消毒30 s,再用0.15% 的氯化汞消毒8 min,用无菌蒸馏水冲洗5次,用消毒的滤纸吸干表面水分后,将茎段切成长度2~3 cm的小段为接种外植体。
1.2.2 形成层幼苗的诱导 茎段接种前,用镊子剥离猕猴桃幼嫩茎段的周皮,将茎段两端各切除0.1~0.2 cm后置于防氧化处理液(300 mg·L-1PVP)处理30 min,随后将处理完毕的茎段置于形成层干细胞低渗处理培养基,低渗培养基以MS为基本培养基,添加8 g·L-1琼脂粉、2.5 g·L-1蔗糖及3 mg·L-1NAA,在黑暗、温度为24~26 ℃条件下进行培养,培养时间为25~30 d。茎段培养25~30 d后,将茎段再次切短,形成长度为2~4 cm的小段或0.2~0.3 cm的薄片,转入形成层干细胞诱导愈伤培养基中诱导培养。在前期的预备实验中,发现采用2,4-D为生长素,虽然能提高愈伤诱导率,但是会严重影响胚性愈伤的诱导及胚状体的形成、分化。猕猴桃组培快繁中多采用的植物激素多为6-BA和NAA(罗强和刘建林,2009;张玉杰,2014;于非,2017;顾福明等,2018)。因此,参考吕海燕等(2019)的报道,本实验形成层干细胞诱导培养基是在MS基本培养基基础上进行如下调整,添加6 g·L-1琼脂粉、35 g·L-1蔗糖及不同浓度的NAA及6-BA,在1 800~2 200 lx,(25±2)℃下培养。同时,对低渗培养基的处理时间进行了预备实验,处理时间分别为0、5、10、15、20、25、30、35 d,结果发现处理时间在25 d以下,茎段多以愈伤-器官形成方式形成幼苗,而30 d以上茎段形成胚状体的频率会大幅下降。因此,在利用Design-Expert 8.06软件进行三水平设计培养条件优化选择时,低渗培养基的处理时间选择25~30 d。而NAA、6-BA浓度的下限分别设为3、0.2 mg·L-1,NAA、6-BA浓度的上限分别设为5、0.5 mg·L-1。低渗处理完毕后的茎段或茎段切片转入愈伤诱导培养基中培养,经20~30 d培养后茎段形成层会形成胚性愈伤及胚状体,并逐步分化为不定芽。所有处理中,实验重复3次。
1.2.3 愈伤组织来源途径的确定及幼苗生根 取培养中的猕猴桃茎段及长有愈伤的茎段切片,进行切片观察,切片采用徒手切片,中性红染色观察。当不定芽所形成的幼苗至2~3 cm时,将其从猕猴桃茎段或茎段切片切下,转入生根及壮苗培养基诱导生根及壮苗,培养基分别为1/2MS培养基+NAA 0.3 mg·L-1+(蔗糖及琼脂下同)3%糖+0.8%琼脂、1/2MS培养基+IBA 0.3 mg·L-1及MS培养基+NAA 0.3 mg·L-1。每瓶生根培养基分别接种10株幼苗,每隔10 d 统计生根数量与根长。实验重复3次。
1.3 数据处理
数据通过软件SPSS 20.1及Design-Expert 8.06处理。
2 结果与分析
2.1 形成层干细胞诱导愈伤及其分化的形态学变化
猕猴桃茎段或有绒毛,或有微小裂纹,易吸附微生物,造成猕猴桃茎段培养过程中的污染,撕掉周皮相当于除去了污染源。未撕周皮的猕猴桃茎段的污染率为45%~62%,而撕掉周皮的污染率为15%~21%。但是猕猴桃茎段非常容易发生褐化,褐化茎段会释放酚类物质而影响茎段愈伤的形成。将猕猴桃茎段置于抗氧化液处理后,可有效防止去皮茎段的氧化(图1: A)。在前期预备实验中,曾对150、200、300、400mg·L-1的PVP各处理30 min,发现200~400 mg·L-1都能取得较好抗氧化效果。因此,实验选择了300 mg·L-1的PVP为抗氧化剂,并利用Design-Expert 8.06软件对其处理时间进行了优化。经形成层干细胞低渗培养基培养25~30 d的茎段或茎段切片转入愈伤诱导培养基中进行培养,培养10~15 d后,可在茎段表面及茎段切片上观察到浅绿色的胚性愈伤(embryonic callus)凸起(图1: B,C),隨着凸起愈伤的增大及转绿,培养20~25 d后,胚性愈伤可直接分化为胚性幼芽从而形成幼苗(图1:D,F)。从幼芽不定芽的横切片看,不定芽源于愈伤团内的致密组织(图1:E)。当幼苗长至2~3 cm时就可将其切下转入生根培养基中培养生根(图1:G)。
2.2 形成层干细胞的愈伤诱导及成苗条件优化
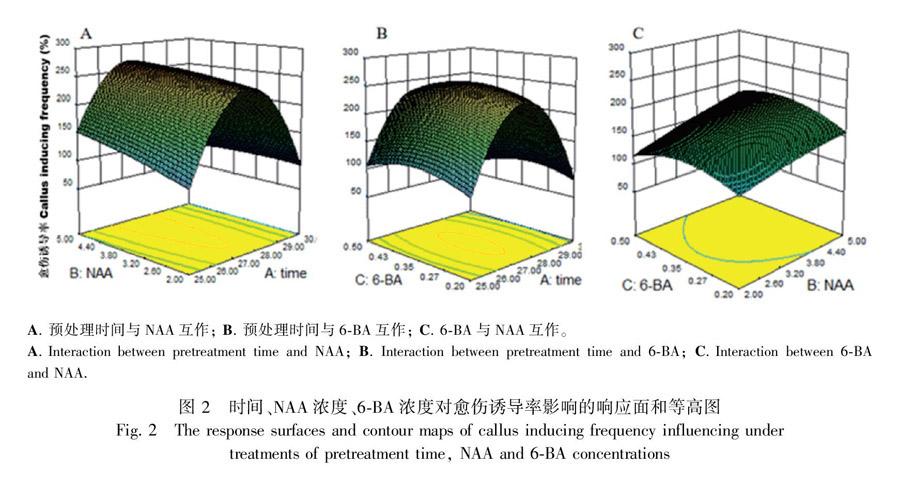
培养20~30 d后,猕猴桃茎段开始长出浅绿色胚性愈伤(图1:B,C),各处理组合中胚性愈伤组织的诱导情形见表1。图2为经Design-Expert 8.06分析所得的效应面及等高图。从图2可以看出,各因素对愈伤诱导率的影响较为复杂。在Design-Expert软件所分析的等高线及响应面中,等高线的形态可反映因素间交互作用的大小,圆形表示交互作用小,椭圆形则相反(代文亮等,2007),响应面的坡度变化可反映出各因素对响应值的影响力,坡度越缓表明影响越小,反之亦然(张黎明等,2014)。由图2可知,时间与NAA浓度、6-BA浓度与NAA浓度的交互作用较强,同时时间对NAA浓度及6-BA浓度的影响较大。这也反映在方差分析中(表2),在三个因素中只有时间对愈伤诱导率和植物形成率呈显著性差异(P ≤0.05)。软件所得的回归方程为Y=-17 839.8+1 296.8x1+109.8x2+982.3x3-3.5x1x2-13.3x1x2+27.1x2x3-23.4x12-1.91x22-1 017.1x32(R2=0.964)。式中:Y 为愈伤诱导率;x1、x2、x3分别为时间、NAA浓度、6-BA浓度。方程拟合非常好,模拟回归模型的P值为0.000 31≤0.05,缺失项的P值为0.251 8≥0.05。方程解析后的最佳条件为时间28.3 h、NAA 4.45 mg·L-1、6-BA 0.28 mg·L-1,从中可以看出形成层愈伤诱导需要较长的处理时间和较高的生长素。
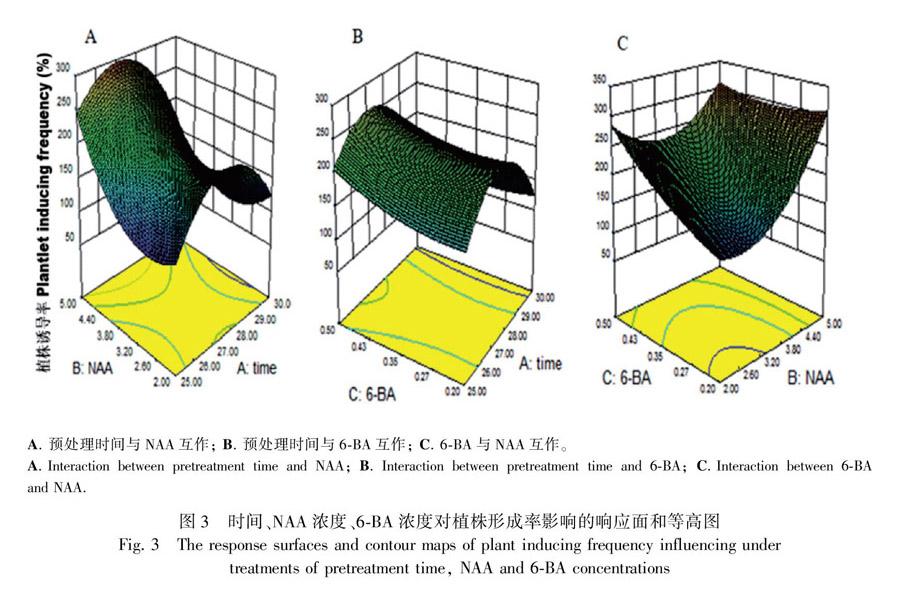
随着培养时间的延长,茎段或茎段切片所形成的胚性愈伤会分化幼芽(图1:D),并形成幼苗(图1:F),当苗长至2~3 cm时,将幼苗切下转至生根培养基生根培养。各处理组合中幼芽的形成率见表1,图3为经Design-Expert 8.06分析所得的效应面及等高图。从图3可以看出,各因素对植株形成率影响较为复杂,尤其是NAA与处理时间之间。从等高线上看,NAA浓度、6-BA浓度及时间三因素间均有较强的互作关系,而NAA与6-BA间的互作相对小;从响应面上看,NAA浓度、6-BA浓度对植株形成率的影响较大。从软件中得到各因素对植株形成率影响的回归方程为Y=-10 237.9+743.6x1+21.1x2+940.3x3- 4.8x1x2-23.1x1x2-156x2x3-13.2x12+27.6x22-658.3x32(R2=0.892)。式中:Y为植株形成率,其他与上述方程的相同。表2显示模拟模型的P值为0.011 2(P≤0.05),而拟失项的P值为0.345 5(P≥0.05),表明模拟模式较为成功。模拟方程解析后的最佳条件为时间26.4 h、NAA 4.84 mg·L-1、6-BA 0.42 mg·L-1,从中可以看出植株形成需要较高的生长素和激动素,而要求前期的低渗处理时间较短。
2.3 愈伤组织来源途径的确定
从茎段横切片上来看,可观察到干细胞形成的细胞团,经中性红染色,可观察到排列紧密的细胞团(图1:I,J,K)。随着细胞团的不断分裂,可观察到细胞团形成胚状体结构(图1:J,L),甚至有胚状体萌发的结构(图1:J),在茎段切片的表面可观察到胚状体萌发形成的胚状体茎和胚状体芽(图1:D)。经中性红染色,在茎段形成层的细胞内部可观察到大量的微小液泡及所形成的细胞团(图1:M),众多微小液泡是干细胞的一大特征,表明猕猴桃幼嫩茎段的形成层中存在有干细胞,且分裂形成细胞团,这些细胞团随后形成愈伤或胚状体,最终形成胚状体芽及幼苗。
2.4 幼苗生根培养基的选择
幼苗接种在生根培养基上15 d后,发现几乎所有幼苗都能生根。从生根的数量及根长上看,1/2MS更合适,而在苗高上,1/2MS与MS没有差异,选择NAA的生根诱导效果更好。这表明猕猴桃幼苗较易生根。对少量幼苗进行移栽(图1:H),成活率在95%以上,表明猕猴桃组培幼苗的移栽要求不高。
3 讨论与结论
本研究通过去除茎段周皮降低污染率,低渗前处理促进茎段干细胞活性,培养诱导干细胞分裂形成胚性愈伤及其分化,并通过响应面设计对处理条件的优化,实现了红阳猕猴桃茎段干细胞直接形成幼苗的快繁体系构建。该体系中,在预处理时间、NAA浓度、6-BA 浓度分别为27.50 h、3.00 mg·L-1、0.20 mg·L-1时,胚性愈伤诱导率达(287.30 ± 12.00)%;在预处理时间、NAA浓度、6-BA 浓度分别为27.50 h、5.00 mg·L-1、0.20 mg·L-1时,植株形成率达(329.50 ± 9.06)%。综合胚性愈伤形成率及植株形成率,低渗预处理27.50 h、NAA 5.00 mg·L-1、6-BA 0.2 mg·L-1时,胚性愈伤形成率和植株形成率分别为(249.47 ± 3.21)%、(329.50 ± 9.06)%,可实现红阳猕猴桃的高效快速繁殖。有关红阳猕猴桃的快繁研究中,文国琴和何震(2004)利用红阳猕猴桃茎段,在MS+BA 1.0 mg·L-1 + NAA 0.1 mg·L-1诱导培养基中获得88%的愈伤组织诱导率;相应愈伤在MS + BA 2.0 mg·L-1 + NAA 0.1 mg·L-1中,芽分化率达到56.6%。甘丽萍等(2016)也利用红阳猕猴桃茎段作为外植体,分别对红阳猕猴桃快速繁殖进行过相关的研究, 但愈伤诱导率、 植株形成率均较本实验低;从激素组成上看,愈伤诱导激素组合为1.0 mg·L-1 ZT+0.1 mg·L-1 NAA,与本实验的愈伤诱导组合有一定的差异,但都利用了ZT。
在常用的细胞分裂素中,ZT的活性最强。本实验利用较低浓度的6-BA实现红阳猕猴桃的高效诱导应该与实验中低渗预处理有关。在渗透胁迫条件下,植物细胞,尤其是其细胞器会发生结构变化,引发膜脂过氧化程度的加剧,从而快速积累活性氧物质(蒋明义等,1994;朱美琛等,2019)。作为植物中重要的信号分子,活性氧物质(ROS)在植物的生长、发育中具有重要的作用(Schmidt & Schippers, 2015;Schippers et al., 2016)。在植物中除子叶源于顶端分生组织的中心区(central zone)外,其他的器官均源于围绕中心区周围区域(peripheral zone)已分化的瞬态放大细胞(differentiated transient amplifying cells )(Aichinger et al., 2012),基因组中同源结构域转录因子WUS(wuschel)可首先在组织中心表达,随后迁移至中心区以维持干细胞的状态(Daum et al., 2014)。最近,Zeng et al.(2017)以擬南芥为材料,研究了活性氧物质对干细胞的调节机制,表明干细胞中所累积超氧阴离子可激活WUS的表达, 从而维持干细胞的特性,同时在周边区细胞的富集促进干细胞的分化, 而过氧化氢(H2O2)则对超氧阴离子的合成进行负调控,提高过氧化氢浓度或降低超氧阴离子浓度,则导致干细胞状态的结束。因此,超氧阴离子与过氧化氢的比例是决定干细胞是否分化或维持原状态的关键(Zeng et al., 2017)。蒋明义等(1994)对水稻的研究表明,在低渗透胁迫下, 渗透对水稻细胞中超氧阴离子含量及过氧化氢含量的影响差别不大;而在高渗透胁迫下,不仅两者的含量均有提高,且比例也发生明显变化。本实验中,对猕猴桃幼嫩茎段进行低渗预培养,一方面可促进茎段干细胞的活性,另一方面可提高干细胞中的活性氧及调节活性氧不同组分的比例。这可能是本实验胚性愈伤诱导率较高的原因之一,当然这种推断是否属实需要对诱导过程中活性氧进行检测和对相关基因表达进行检验。
参考文献:
AICHINGER E, KORNET N, FRIEDRICH T, et al., 2012. Plant stem cell niches [J]. Ann Rev Plant Biol, 63(1): 615-636.
ALISON MR, POULSOM R, FORBES S, et al., 2002. An introduction to stem cells [J]. J Pathol, 197(4): 419-423.
CHEN HH, 2005. Kiwi fruit seed ingredient analysis and active oil withdrawing [J]. J Wenshan Univ, (4): 326-328. [陈红惠, 2005. 猕猴桃籽成分分析及活性油脂提取工艺的研究 [J]. 文山师范高等专科学校学报, (4): 326-328.]
DAI WL, CHENG L, TAO WY, 2007. Application of response surface methodology in optimization of precursors fortaxol production by Fusarium mairei K178 [J]. J Chin Biotechnol, 27(11): 66-72. [代文亮, 程龙, 陶文沂, 2007. 响应面法在紫杉醇产生菌发酵前体优化中的应用 [J]. 中国生物工程杂志, 27(11): 66-72.]
DAUM G, MEDZIHRDSZKY A, SUZAKI T, et al., 2014. A mechanistic framework for noncell autonomous stem cell induction in Arabidopsis [J]. Proc Nat Acad Sci USA, 111(40): 14619-14624.
GAN LP, RUAN SQ, ZENG XL, 2016. Tissue culture system screening of Actinidia chinensis cv. Hongyang ‘Sanxia Horg’ [J]. Nor Hortic, (9): 114-117. [甘丽萍, 阮神清, 曾晓琳, 2016. “三峡虹”红阳猕猴桃组织培养体系的筛选 [J]. 北方园艺, (9): 114-117.]
GARCES HMP, CHAMPAGNE CEM, TOWSLEY BT, et al.,
2007. Evolution of asexual reproduction in leaves of the genus Kalanchoe [J]. Proc Natl Acad Sci USA, 104(39): 15578-15583.
GU FM, SHEN Q, JIAN DF, 2018. Study on induction of adventitious buds in tissue culture of Actinidia chinensis of soft date [J]. Mod Agric Res, 32(8): 46-48. [顾福明, 沈晴, 建德锋, 2018. 软枣猕猴桃组培繁殖中不定芽诱导技术研究 [J]. 现代农业研究, 32(8): 46-48.]
HEIDSTRA R, SABATINI S, 2014. Plant and animal stem cells: similar yet different [J]. Nat Rev Mol Cell Biol, 15(5): 301-312.
HU ZR, YUAN Y, YI SW, et al., 2003. Yunnan wild kiwifruit resources and its distribution [J].SW J Agric Sci, 16(4): 47-52. [胡忠榮, 袁媛, 易芍文, 等, 2003. 云南野生猕猴桃资源及分布概况 [J]. 西南农业学报, 16(4): 47-52.]
HUANG HW, GONG JJ, WANG SM, et al., 2000. Genetic diversity in the genus Actinidia [J]. Biodivers Sci, 8(1): 1-12. [黄宏文, 龚俊杰, 王圣梅, 等, 2000. 猕猴桃属(Actinidia)植物的遗传多样性 [J]. 生物多样性, 8(1): 1-12.]JIANG MY, YANG WY, XU J, et al., 1994. Osmotic stress-induced oxidative injury of rice seedlings [J]. Acta Agron Sin, (6): 733-738. [蒋明义, 杨文英, 徐江, 等, 1994. 渗透胁迫诱导水稻幼苗的氧化伤害 [J]. 作物学报, (6): 733-738.]
KAORU S, SEAN PG, ELLIOT MM, 2011. Regeneration in plants and animals: dedifferentiation, transdifferentiation, or just differentiation? [J]. Trends Cell Biol, 21(4): 428-439.
LI F, CUI X, FENG ZH, et al., 2012. The effect of 2,4-D and kinetin on dedifferentiation of petiole cells in Arabidopsis thaliana [J]. Biol Plant, 56(1): 121-125.
LI L, ZHANG S, HE Q, et al., 2015. Application of response surface method in experimental design and optimization [J]. Res & Exp Lab, 34(8): 41-45. [李莉, 张赛, 何强, 等, 2015. 响应面法在试验设计与优化中的应用 [J]. 实验室研究与探索, 34(8): 41-45.]
LIU XD, LIU YX, LIU RL, et al., 2012. Study on fast plant regeneration of Actinidia chinensis [J]. J Hubei Agric Sci, 51(11): 2369-2371. [朱学栋, 刘奕清, 赵荣隆, 等, 2012. 红阳猕猴桃快速繁殖体系的建立 [J]. 湖北农业科学, 51(11): 2369-2371.]
LUO Q, LIU JL, 2009. Study on wild kiwifruit resources in Panxi area and its distribution [J]. J Jiangsu Agric Sci, (4): 373-375. [罗强, 刘建林, 2009. 攀西地区野生猕猴桃资源及分布概况 [J]. 江苏农业科学, (4): 373-375.]
L HY, LI DW, ZHONG CH, 2019. Regeneration system of tissue culture of Actinidia chinensis ‘Dong hong’ [J]. Guihaia, 39(4): 464-471. [吕海燕, 李大卫, 钟彩虹, 2019. ‘东红’猕猴桃高效再生体系的建立 [J]. 广西植物, 39(4): 464-471.]
MARTYNA M, BARAN M, ROSTROSZKOWSKA M, et al., 2014. Plant stem cells as innovation in cosmetics [J]. Acta Pol Pharm, 71(5): 701.
SCHIPPERS JH, FOYER CH, VAN DJT, 2016.Redox regulation in shoot growth, SAM maintenance and flowering [J]. Curr Opin Plant Biol, 29: 121-128.
SCHMIDT R, SCHIPPERS JHM, 2015. ROS-mediatedredox signaling during cell differentiation in plants [J]. Biochim Biophys Acta (BBA)-General Subjects, 1850(8): 1497-1508.
SOZZANI R, IYER-PASCUZZI A, 2014. Postembryonic control of root meristem growth and development [J]. Curr Opin Plant Biol, 17: 7-12.
SUGIMOTO K, JIAO Y, MEYEROWITZ EM, 2010. Arabidopsis regeneration from multiple tissues occurs via a root development pathway [J]. Dev Cell, 18(3): 460-471.
WEN GQ, HE Z, 2004. Multiplication plant technique of Actinidia chinensis stem section callus [J]. J Fujian For Sci & Tech, 31(4): 78-79. [文国琴, 何震, 2004. 红阳猕猴桃茎段愈伤组织诱导成苗技术 [J]. 福建林业科技, 31(4): 78-79.]
WU XM, 2010. Prospect of genetics, breeding and industrialization of kiwi fruit [J]. J Fujian For Sci & Technol, 37(2): 174-178. [吴晓梅, 2010. 猕猴桃遗传育种及其产业化进展 [J]. 福建林业科技, 37(2): 174-178.]
YU F, 2017. Establishment of tissue culture and rapid propagation system of kiwi [J]. Chin Abs Horticul, 33(6): 17-18. [于非, 2017. 野生软枣猕猴桃组织培养快繁体系的建立 [J]. 中国园艺文摘, 33(6): 17-18.]
YU Y, FENG ZH, WANG GC, et al., 2010. Initiation of dedifferentiation and structural changes in vitro cultured petiole of Arabidopsis thaliana [J]. Protoplasma, 241(1): 75-81.
ZENG J, DONG ZC, WU HJ, et al., 2017. Redox regulation of plant stem cell fate [J]. The EMBO J, 36(19): 2844-2855.
ZHANG LM, LI RC, HAO LM, et al., 2014. Response surface methodology for optimization of extracting total flavonoids from Maca leaves and antioxidant evaluation [J]. Mod Food Sci & Tech, 30(4): 233-239. [张黎明, 李瑞超, 郝利民, 等, 2014. 响应面优化玛咖叶总黄酮提取工艺及其抗氧化活性研究 [J].现代食品科技, 30(4): 233-239.]
ZHANG YJ, 2014. Study on Actinidia kolomikta in vitro rapid propagation [D]. Changchun: Jilin Agricultural University. [张玉杰, 2014. 狗棗猕猴桃离体快繁的研究 [D]. 长春: 吉林农业大学.]
ZHU MC, MA XL, YU X, et al., 2019. Effects of water stress on reactive oxygen species and cell death in wheat seedlings [J]. SW Chin J Agric Sci , 32(4): 776-782. [朱美琛, 马兴立, 余幸, 等, 2019. 水分胁迫对小麦幼苗中活性氧与细胞死亡的影响 [J]. 西南农业学报, 32(4): 776-782.]
(责任编辑 何永艳)

