温阳化浊通络方对系统性硬化病患者Th17 细胞增殖的影响
吕 芹韩 立 丁生晨 郭克磊臧文华张 鹏卞 华*
(1.南阳医学高等专科学校,河南 南阳 473061;2.南阳理工学院张仲景国医学院,河南 南阳 473004;3.河南省张仲景方药与免疫调节重点实验室,河南 南阳 473004)
系统性硬化病是一种以皮肤增厚和纤维化为主要表现的自身免疫性疾病,随着疾病进展而累及多种内脏器官(如心、肺、肾、消化道等),10 年累积生存率为66.3%~77.5%[1],女性发病率约为男性的3~4 倍,治疗方法以抗炎、改善血循环、抑制纤维化、免疫抑制及调节等为主,但均难以根治。目前认为,免疫学异常是系统性硬化病纤维化的一个重要因素,在其发病中起着主导作用[2],故从免疫调节角度开发有效的相关药物是研究重点。
中医认为,系统性硬化病属“皮痹” “皮痹疽” 等范畴,病位在络脉,与肺、脾、肾密切相关,以补肺健脾益肾治其本,化浊通络治其标,具有疗效好、不良反应少等优势。温阳化浊通络方是课题组以黄芪桂枝五物汤、二仙汤、补肺汤等为基础创制而成的,前期发现该方能降低系统性硬化病患者外周血辅助性T 细胞17 (Th17) 细胞及其分泌的细胞因子IL-17 水平,但其机制尚不明确[3]。Th17细胞参与机体免疫应答,在系统性硬化病进展和纤维化过程中发挥了重要作用[4];白细胞介素-6 受体(IL-6R) 是白细胞介素-6 (IL-6) 促进Th17 分化和增殖的重要因子,介导多种自身免疫性疾病的组织慢性炎症反应,是治疗系统性硬化病的潜在靶点[5-6];微小核糖核酸-155 (miR-155)可通过调节Th17 细胞增殖、分化、发育来介导自身免疫炎症反应,并可调节机体IL-6 等细胞因子的分泌来调控Th17[7-8]。本实验将考察温阳化浊通络方对Th17 细胞增殖的影响,探讨其调控miR-155/IL-6R 通路治疗系统性硬化病的作用机制。
1 材料
1.1 试剂与药物 黄芪(产地山西)、党参(产地山西)、山药(产地河南)、熟地(产地河南)、淫羊藿(产地四川)、积雪草(产地云南)、桂枝(产地广西)、白芥子(产地河南)、丝瓜络(产地河南) 等温阳化浊通络组方药材均购自河南省张仲景大药房股份有限公司(南阳店),经南阳理工学院张超云副教授鉴定为正品,均符合2015 年版《中国药典》 项下标准。人Th17 细胞磁性分选试剂盒(批号18F91695)、T Cell Exp Medium 无血清培养基(批号19C100395A),购自加拿大Stemcell 公司;miRNA Isolation Kit,购自美国Omega Bio-Tek 公司;All-in-OneTMmiRNA qRT-PCR Detection Kit,购自美国Genecopoeia 公司;RevertAid First Strand cDNA Synthesis 试剂盒(批号00591330)、LipofectamineTM3000 转染试剂盒(批号1887047),购自美国赛默飞世尔公司;FastStart Universal SYBR Green qPCR 试剂盒(批号31598800),购自德国默克公司;miR-155 诱导剂agomir、miR-155 抑制剂antagomir,购自广州锐博生物技术有限公司;PCR 引物、UNlQ-10 柱式Trizol 总RNA 抽提试剂盒(批号E613KA8742),购自生工生物工程(上海)股份有限公司;人IL-6、IL6-R 一抗及Alexa Fluor® 488(AF-488) -羊抗鼠、Alexa Fluor® 647 (AF-647) -羊抗兔二抗,购自美国Proteintech 公司。
1.2 动物 Wistar 大鼠60 只,雌性,体质量220~250 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK (京) 2016-0011,饲养及实验操作均符合实验动物伦理学要求。
1.3 仪器 ABI Veriti 96 W 梯度PCR 仪、ABI ViiA7 实时荧光定量PCR 仪,购自美国赛默飞世尔科技公司;CB160二氧化碳培养箱,购自德国Binder 公司;LSM800 激光共聚焦显微镜,购自德国蔡司公司。
2 方法
2.1 Th17 细胞分离 根据2013 年美国风湿病学会/欧洲风湿病学会联合制定的系统性硬化病分类标准[9],选择2018 年3 月至2019 年7 月在南阳市中心医院治疗的16 例系统性硬化病患者,男性2 例,女性14 例;平均年龄(51±13 岁);肾脏受累者3 例,抗核抗体阳性者15 例。患者签署知情同意书后抽取外周血,密度梯度离心法分离外周血单核细胞(PBMC),Stemcell Th17 磁性分选试剂盒分离Th17 细胞,加到T Cell Exp Medium 无血清培养基中,于37 ℃、5% CO2条件下培养。本研究得到南阳市中心医院伦理委员会的批准。
2.2 含药血清制备 60 只大鼠随机分为空白组及温阳化浊通络方低、中、高剂量组,每组15 只,空白组以等量生理盐水灌胃,而温阳化浊通络方水煎浓缩至相当于原生药1.5 g/mL 后,分别按15、30、60 g/kg 剂量每天灌胃,连续7 d。各组于末次灌胃给药后60 min 内采血,分离血清,制备空白血清及不同剂量含药血清,微孔滤膜过滤除菌,56 ℃下灭活30 min 后,-80 ℃冰箱保存备用。
2.3 含药血清对Th17 细胞增殖的影响 调整Th17 细胞浓度为1×107/mL,根据文献[10]报道的方法,采用追踪活细胞分裂增殖过程的无细胞毒性荧光染料CFSE(5 μmol/L),在37 ℃下标记5 min,分为高、中、低剂量含药血清组和空白血清组,加入不含ImmunoCult Hu CD3/CD28 T 细胞刺激剂的无血清T Cell Exp Medium 培养基,于37 ℃、5%CO2培养箱中培养,另设仅加入ImmunoCult Hu CD3/CD28 T 细胞刺激剂的阳性对照组。48 h 后收集细胞,通过流式细胞术检测Th17 细胞中CFSE 荧光强度,Flowjo分析Th17 细胞增殖指数。
2.4 含药血清对Th17 细胞miR-155 表达的影响 Th17 细胞以1×105/mL 浓度接种24 孔板,37 ℃、5% CO2条件下培养过夜。按照LipofectamineTM3000 转染试剂盒说明书,分别转染miR-155 诱导剂agomir (诱导表达阳性对照)、miR-155 抑制剂antagomir (抑制表达阳性对照),另设miR-155 干扰阴性对照组。转染6 h 后,各转染组分别加入10%低、中、高剂量含药血清以及空白血清,48 h 后弃上清,PBS 缓冲液洗涤,按照miRNA Isolation Kit 说明书操作步骤提取miRNA,采用All-in-OneTMmiRNA qRT-PCR Detection Kit 逆转录,并以RT-qPCR 扩增miR-155,正向引物5′-GGGGGGTTAATGCTAATCGTG-3′,反向引物5′-TATGGTTGTTCACGACTCCTTCAC-3′;内参 RNAU6 正向引物 5′-CTCGCTTCGGCAGCACA-3′,反向引物 5′-AACGCTTCACGAATTTGCGT-3′,扩增条件为95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火60 s,72 ℃延伸1 min,35 个循环。以RNAU6 为内参,通过2-△△Ct法计算各处理组miR-155 相对于对照组表达量的变 化,ΔΔCt=(Ct目标基因-Ct内参基因)处理组-(Ct目标基因-Ct内参基因)对照组。
2.5 含药血清对Th17 细胞IL-6、IL-6R mRNA 表达的影响 Th17 细胞接种、培养、转染、分组同上,转染6 h 后各转染组加入10% 低、中、高剂量含药血清及空白血清,48 h后弃上清,PBS 缓冲液洗涤,按照UNlQ-10 柱式Trizol总RNA 抽提试剂盒说明书操作步骤提取总RNA,逆转录合成cDNA,RT-qPCR 扩增IL-6、IL-6R mRNA,IL-6 正向引物 5′-CCTGATCCAGTTCCTGCAGA-3′,反向引物 5′-GAACTCCTTAAAGCTGCGCA-3′;IL-6R 正向引 物 5′-GAATCTTGCAGCCTGATCCG-3′,反向引物 5′-GACCGTTCAGCCCGATATCT-3′。内参基 因GAPDH 正向引 物5′-GAGTCAACGGATTTGGTCGT-3′,反向引物5′-GACAAGCTTCCCGTTCTCAG-3′,扩增条件及IL-6、IL-6R 相对于对照组表达量的计算方法同上。
2.6 含药血清对Th17 细胞中IL-6、IL-6R 蛋白表达的影响 分组及Th17 细胞接种浓度同上,各组细胞于37 ℃、5%CO2培养箱中孵育48 h 后弃去培养基,PBS 缓冲液洗涤,4%多聚甲醛固定5 min,PBS 缓冲液洗涤3 次,含0.5%Triton X-100 的PBS 通透10 min,含5%羊血清的PBS 室温封闭1 h,按照说明书推荐比例加入IL-6、IL-6R 蛋白一抗,室温下孵育1 h,0.01% Triton X-100/PBS 缓冲液洗涤3 次,加入与一抗对应的AF488 或AF647 荧光标记二抗,室温下孵育1 h,含0.01% Triton X-100 的PBS 缓冲液洗涤3 次,DAPI 染细胞核5 min,PBS 缓冲液洗涤后滴加适量防荧光淬灭封片剂,在蔡司激光共聚焦显微镜下观察拍照,通过Zen 软件分析各组蛋白表达的平均荧光强度。
2.7 统计学分析 通过SPSS 25.0 软件进行处理,计量资料以() 表示,组间比较采用单因素方差分析。以P<0.05 为差异具有统计学意义。
3 结果
3.1 含药血清对Th17 细胞的增殖抑制作用 与空白血清组比较,经CD3/CD28 T 细胞刺激剂处理后Th17 细胞增殖指数升高(P<0.01),而经含药血清处理后受到抑制(P<0.01),并呈剂量依赖性,见图1。

图1 含药血清对Th17 细胞增殖指数的影响
3.2 含药血清对miR-155 表达的影响 miR-155 agomir 诱导前,含药血清可剂量依赖性地抑制miRNA 155 表达(P<0.01);miR-155 agomir 诱导后,与空白血清组比较虽然miR-155 表达升高,但含药血清仍可部分抑制miR-155 表达(P<0.01);miR-155 antagomir 抑制miR-155 表达后,与空白血清组比较,含药血清组对其表达无明显抑制作用(P>0.05),表明miR-155 是含药血清的潜在作用靶点,见图2。
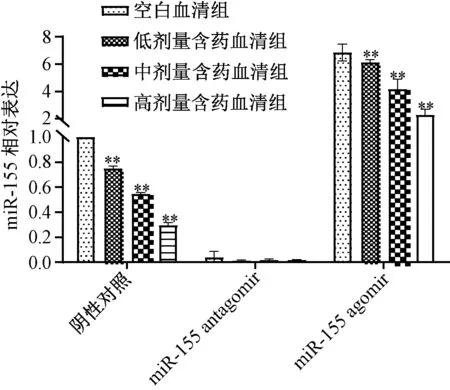
图2 miR-155 agomir 诱导前后含药血清对miR-155表达的影响
3.3 含药血清对IL-6、IL-6R mRNA 表达的影响 miR-155 agomir 诱导前,含药血清可剂量依赖性地抑制IL-6、IL-6R mRNA 表达;miR-155 agomir 诱导后,与空白血清组比较,含药血清组仍可抑制两者mRNA 表达(P<0.01);miR-155 antagomir 抑制miR-155 表达后,与空白血清组比较,含药血清组对IL-6R mRNA 表达无明显抑制作用(P>0.05),但仍剂量依赖性地抑制IL-6 mRNA 表达,提示IL-6R 可能是miR-155 的靶基因,含药血清可能直接通过后者对前者mRNA 进行靶向调控,见图3~4。
3.4 含药血清对IL-6、IL-6R 蛋白表达的影响 与空白血清组比较,含药血清组可剂量依赖性地抑制Th17 细胞中IL-6、IL-6R 蛋白表达,两者平均荧光强度降低(P<0.05,P<0.01);miR-155 agomir 诱导miR-155 表达后,与空白血清组比较,含药血清组仍对两者蛋白表达具有一定抑制作用,平均荧光强度有一定程度的下降(P<0.01);miR-155 antagomir 抑制miR-155 表达后,与空白血清组比较,含药血清组对IL-6R 蛋白表达无明显抑制作用(P>0.05),但仍可抑制IL-6 蛋白表达(P<0.01),提示含药血清对IL-6R 的调控可能与调控miR-155 有关,见图5~7。

图3 miR-155 agomir 诱导前后含药血清对IL-6 mRNA 表达的影响

图4 miR-155 agomir 诱导前后含药血清对IL-6R mRNA 表达的影响
4 讨论
系统性硬化病致病因素众多,包括遗传、感染、血管异常、免疫异常等,目前认为其主要发病机制为患者免疫系统受到致病因素干扰,使免疫细胞和淋巴系统失去正常功能。西医治疗系统性硬化病以药物为主,但其疗程较长,不良反应较多,易造成患者肝肾功能损害及并发症,依从性差,从而影响其长期疗效[11];中医认为,系统性硬化病属于“皮痹” 范畴,早在《素问·痹论》中就有记载,积累了丰富的临床经验,疗效显著,不良反应少。中药复方具有多成分、多靶点的特点,在现代药理研究中已证实其疗效机制,如软皮汤、温阳除痹汤等在硬皮病模型小鼠中能抑制Ⅰ、Ⅲ型胶原合成,在皮肤成纤维细胞中可通过抑制增殖、诱导凋亡、改善其促纤维化表型来发挥抗纤维化作用[12-13];五痹胶囊能提高辅助性T 细胞的功能,降低免疫球蛋白表达[14]。
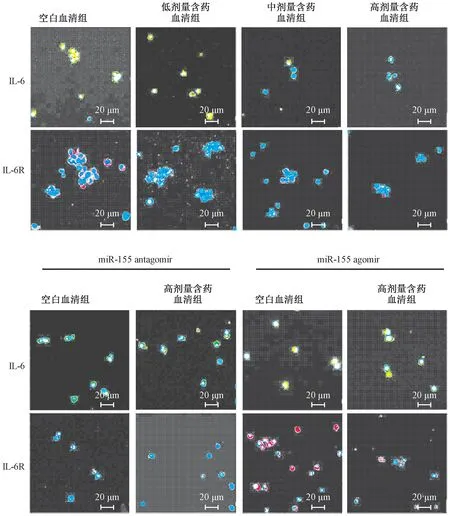
图5 各组IL-6、IL-6R 蛋白表达的影响(400×)
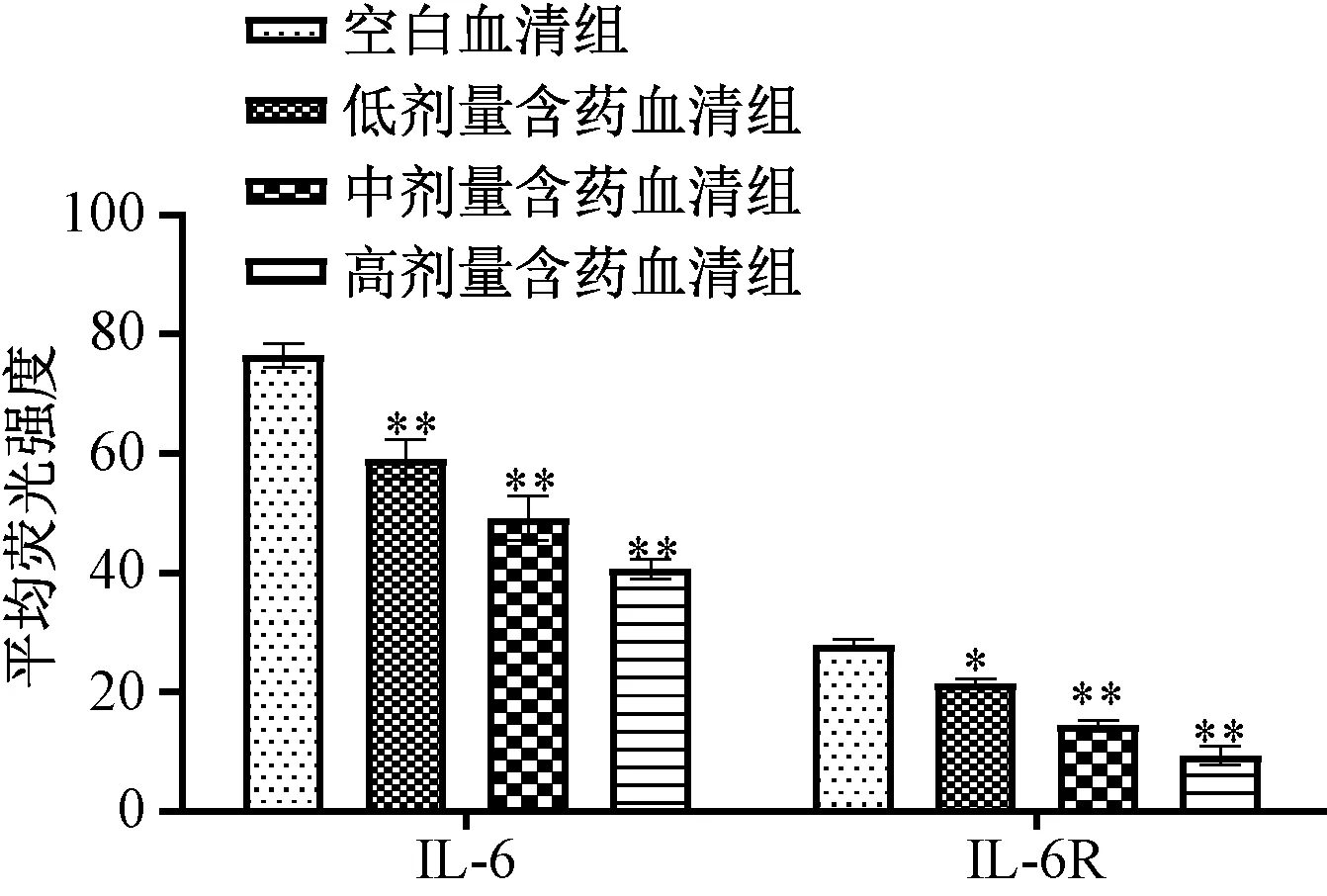
图6 miR-155 agomir 诱导前含药血清对IL-6、IL-6R 蛋白表达的影响
课题组前期研究发现,温阳化浊通络方可阻止系统性硬化病皮肤成纤维细胞周期由G1期进入S 期,下调凋亡抑制蛋白survivin、细胞周期蛋白cyclin D1 mRNA 及蛋白表达,具有促凋亡、抑制增殖作用,从而发挥其抗纤维化作用[15];Ebrahimiyan 等[16]发现,系统性硬化病患者外周血T 细胞中survivin 表达增高与成纤维细胞凋亡受抑、自身免疫反应和纤维化密切相关,miR-150-5p、miR-16-5p、miR-485-5p 与survivin 变异体(survivin-ΔEx3、survivin-2B、survivin-3B 等) 总表达呈负相关;Sandhu 等[17]发现,miR-155 高表达与B 细胞中cyclin D1、IL-6 表达增高密切相关,进而使B 细胞异常增殖,凋亡受到抑制,以上结果表明miR-155 及其他miR、IL-6 都可能参与了对survivin、cyclin D1 的调控,从而促进系统性硬化病进展。miR-155 可通过调节Th17 细胞的增殖、分化、发育来介导自身免疫炎症反应;在CD4+T 淋巴细胞分化为Th17 细胞的过程中,IL-6首先与其受体IL-6R 结合,激活非受体型蛋白酪氨酸激酶,进一步启动Th17 细胞因子IL-17 A/F 等反向相关基因表达[6],故抑制Th17 细胞异常增殖,靶向调控miR-155、IL-6 或IL-6R 是治疗系统性硬化病的有效措施之一。
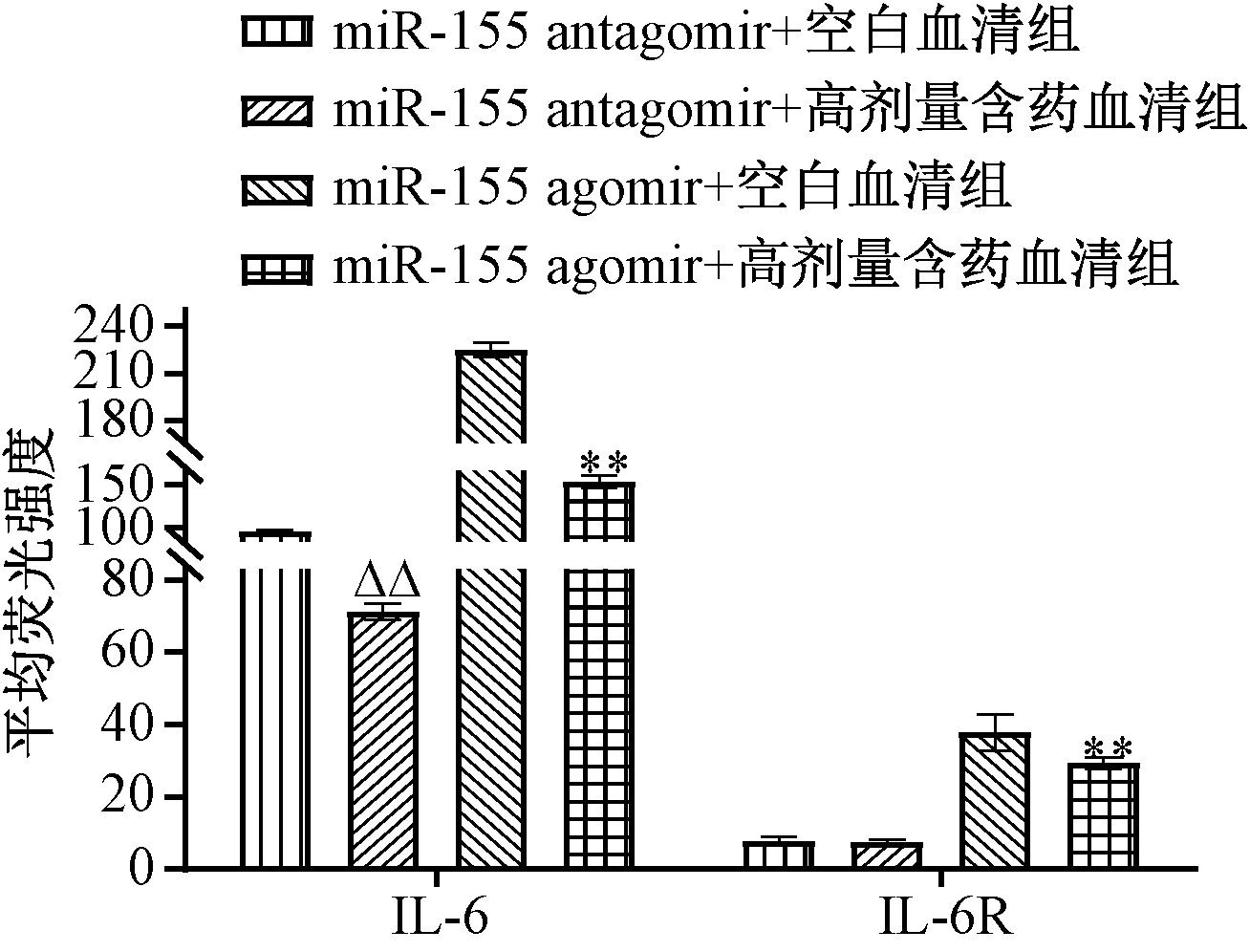
图7 miR-155 agomir 诱导后含药血清对IL-6、IL-6R 蛋白表达的影响
miR 是一种不编码蛋白质的内源性小分子RNA,通过完全或非完全互补于靶基因的3′-非编码区域(UTR),在转录后水平降解靶mRNA 或阻碍其翻译,参与调节各种生物过程,包括促进免疫细胞的分化成熟、抗体产生、炎性介质释放、参与炎症信号通路等[18]。Antagomir 是根据miR成熟体序列设计,经过特殊标记与化学修饰的单链小RNA,通过与细胞内的成熟miR 强竞争性结合,阻止miR与其靶基因mRNA 的互补配对,抑制miR 发挥作用;Agomir 是经过特殊标记和化学修饰的双链小RNA,通过模拟内源性的miRNA 来调节靶基因的生物学功能,本实验通过miR-155 antagomir、agomir 分别阻断、模拟miR-155 表达,探讨温阳化浊通络方含药血清是否通过miR-155 靶向调控IL-6 和IL-6R 的表达。结果表明,miR-155 antagomir阻断miR-155 表达后,虽然IL-6、IL-6R mRNA 和蛋白表达均受到抑制,但含药血清仍能降低IL-6 mRNA 和蛋白表达,表明对IL-6 的抑制可能部分地通过抑制miR-155 实现。而含药血清对IL-6R 的抑制作用可能通过直接抑制miR-155实现,这与miR 数据库Targetscan 预测IL-6R 是miR-155 靶基因一致。
综上所述,温阳化浊通络方可剂量依赖性地抑制Th17细胞的增殖和miR-155 表达,从而发挥对系统性硬化病的免疫治疗作用,其机制可能与抑制IL-6、IL-6R mRNA 和蛋白表达有关,而对IL-6R 的抑制作用可能与靶向调控miR-155 表达有关,但该方是否存在其他调控IL-6、IL-6R 通路的机制尚不明确,仍需作进一步研究来证实。

