BNS和BNS366小麦雄性不育与内源激素的关系
刘海英,冯必得,茹振钢,陈向东,黄培新,邢晨涛,潘茵茵,甄俊琦
1河南师范大学生命科学学院,河南新乡 453007;2河南科技学院小麦中心,河南新乡 453003
0 引言
【研究意义】BNS为光照辅助的温敏型小麦雄性不育系[1],在河南新乡地区于9月23日至10月17日播种,可致彻底雄性不育,在11月18日以后播种则雄性育性恢复为完全可育状态[2],BNS366由BNS与常规小麦品种郑麦366饱和回交选育而成,其育性转换规律与BNS一致[3],目前,已利用BNS和BNS366筛选出小麦强优势杂交组合[4-5],在小麦二系法杂交制种中具有重要的应用价值,研究BNS和BNS366花粉败育的生理机制,对防控不同年际异常气温可能引起的育性波动、小麦幼穗发育过程中的栽培管理等具有重要的理论参考意义。【前人研究进展】发育中的BNS和 BNS366幼穗对低温敏感,前人对其低温敏感期的研究结果基本一致,均集中在小花原基分化期至四分体期之间,尤其是雌雄蕊原基分化期至四分体期之间[1,6-8],其花粉败育的关键期为单核靠边期[2,9-10]。雄性不育的发生与植物内源激素的变化有密切的关系[11-12]。柏斌等[13]研究发现,随着低温时间的延长,水稻光温敏不育系(叶片中 IAA、GA的含量及GA/ABA比值下降幅度较大)的雄性不育程度也较大。汤继华等[14]指出在小花分化期和性器官形成期,玉米温敏核雄性不育系琼6Qms叶片和花药组织中的IAA含量较低。与在可育播期播种相比,在不育播期播种的小麦温敏不育系C412S、C050S、C010S和C49S幼穗和花药中IAA、GA、ABA和茉莉酸(jasmonic acid,JA)含量不足,ZR含量过剩,常规对照品种在播种期间的变化不大[15-16]。张自刚等[17]发现,在四分体期至三核期,与BNS可育幼穗相比,单核期不育幼穗中的IAA、GA3和ZR含量较低,ABA含量较高,三核期不育幼穗的ABA和ZR含量较高,GA3含量则较低;IAA/GA3、ABA/GA3值较高,IAA/ABA值较低。张艳玉等[18]指出,在雌雄蕊分化期至三核期,与 BNS可育株相比,不育株叶片、幼穗和花药的IAA、ABA和GA含量(在大部分时期)均较低;IAA/ABA、IAA/GA和ABA/GA激素比例浮动较大。【本研究切入点】比较BNS不育株和可育株小孢子发育过程中内源激素的变化已有报道,但涉及 BNS系列不同品系,且以常规对照品种,尤其是其近等基因系为对照的内源激素规律性变化仍缺乏研究。【拟解决的关键问题】本研究在大田条件下,选用温敏雄性不育系BNS和BNS366为材料,分别以常规小麦品种矮抗58和郑麦366(BNS366的近等基因系)为对照,于10月10日(正常秋季播种)和12月2日(晚播)播种,通过对雌雄蕊原基分化期至三核期的叶片,雌雄蕊原基分化期至四分体的幼穗、单核中位期至三核期的花药中内源激素变化共性特征的分析,研究正常秋季播种条件下,春季低温对BNS系列小麦小孢子发育的调控作用,深入认识内源激素调控其花粉败育的作用机制,为其花粉育性调控提供理论依据。
1 材料与方法
1.1 试验设计
试验于2018—2019年在河南师范大学小麦试验田进行,试验地为砂质壤土,0—30 cm土层的有机质含量为 10.9 g·kg-1,全氮含量为 0.78 g·kg-1,碱解氮含量为 60.5 mg·kg-1,有效磷含量为 31.2 mg·kg-1,速效钾含量为 92.2 mg·kg-1。播种前施入大豆饼肥6 000 kg·hm-2,史丹利三安复合肥(18-18-18)折合为纯氮 100 kg·hm-2、P2O5100 kg·hm-2和 K2O 100 kg·hm-2,拔节期追施纯氮 100 kg·hm-2,栽培管理措施同大田。
采用随机区组设计,品种组合为主区,播期为副区。试验设2个试验组,分别为矮抗58/BNS试验组(对照品种矮抗58和温敏小麦雄性不育系BNS,前者为常规小麦品种,分别以1和2表示)和郑麦366/BNS366试验组(对照品种郑麦366和温敏小麦雄性不育系BNS,前者为BNS366的近等基因系,分别以3和4表示),种子均由河南科技学院小麦中心提供。均设置正常秋季播种(2018年10月10日播种)和晚播(2018年12月2日)2个播期。试验小区面积4.5 m2(小区长3 m,宽1.5 m,种植6行,行距0.25 m,株距0.1 m,30株/行),随机区组排列,重复3次。
1.2 测定项目及方法
1.2.1 花粉育性鉴定 在小麦开花期上午 9:00—10:00,随机选取10株,并取其主茎穗置于FAA(即福尔马林-醋酸-酒精液,由50%酒精90 mL、冰醋酸5 mL、福尔马林5 mL配制而成)固定液中,0.034×105Pa抽真空30 min,4℃固定24 h,用70%乙醇置换固定液30 min后,转入70%乙醇中保存备用。参照刘海英等[10]方法进行 I2-KI法染色、制片、观察和花粉育性统计。
可育花粉率=可育花粉数/花粉总数×100%。花粉育性统计结果取平均值。参照陈佳娜等[19]不育花粉率分级标准判断花粉不育程度,在本试验条件下,需将不育花粉率换算为花粉可育率相应参考数值后,再辅助进行花粉不育程度判断。
以花粉可育率-Δ(%)判断在正常秋季播种条件下,与晚播相比,花粉可育率提高的程度。花粉可育率-Δ(%)=[(正常秋季播种条件下花粉可育率-晚播条件下花粉可育率)/晚播条件下花粉可育率]×100%。由不同材料2个播期下花粉可育率计算求得,3次重复,取平均值。
1.2.2 自交结实率测定 在小麦抽穗后开花前各随机取10株套硫酸纸袋,每株套主茎穗,成熟期按国内法、国际法调查和统计自交结实率,取平均值。结实率计算公式[20]分别为:
结实率(%)=(每小穗基部两朵小花结实数/小穗数×2)×100%(国内法);
结实率(%)=(穗粒数/小穗数×2)×100%(国际法)。
1.2.3 内源激素含量测定 参照于振文[21]、崔金梅等[22]方法确定小麦穗分化时期的标准,并结合田间形态和显微观察确定发育时期,在雌雄蕊原基分化期(Ⅰ:幼穗长度0.3 cm以下,植株基部第一节间伸长约1.0 cm;显微观察可见幼穗中部小穗基部第1位小花中央出现3个半球状雄蕊原基突起,中间出现一雌蕊原基突起,其他时期均取此部位进行有关花器官观察)、药隔期(Ⅱ:幼穗长度0.8—1.0 cm,旗叶抽出倒二叶叶鞘一半;显微观察可见雄蕊原基出现纵沟)、四分体期(Ⅲ:正常秋季播种条件下幼穗长度7.0—8.0 cm,晚播条件下幼穗长度4.0—5.5 cm,旗叶与倒二叶叶枕距2.0—4.0 cm,茎秆中部略膨胀;显微观察可见四分体)、单核中位期(Ⅳ:花药乳白色长度为1—2 mm,显微观察可见单核花粉粒,细胞核居中)、单核靠边期(Ⅴ:花药浅绿色,长度约为 3 mm,穗芒伸出旗叶鞘1.0 cm;显微观察可见单核花粉粒,细胞核位于萌发孔对侧)、二核期(Ⅵ:花药绿色,长度大约 4 mm,穗抽出旗叶鞘一半,也叫“露脸期”或“抽穗期”;DAPI法染色显微观察可见 2个细胞核位于萌发孔对侧)和三核期(Ⅶ:花药黄色,长度约为5 mm,穗刚完全抽出旗叶鞘;DAPI法染色显微观察可见3个细胞核,一个较大为营养核,另外2个较小为点状精核位于营养核附近)等7个时期的上午9:00—10:00取样,时期判定的可靠程度为高度可靠,具体取样日期和取样期间的温度分别见表1和图1。在7个时期取主茎功能叶(四分体期之前为最新展开叶,四分体期之后为旗叶);在雌雄蕊原基分化期和药隔期取主茎及大分蘖幼穗(每单株取1个主茎穗和2个最大的分蘖穗);在四分体期取主茎及大分蘖幼穗中部小穗(分别去除上部和下部各6个小穗后剩余的中部小穗);在小孢子发育的4个时期(单核中位期、单核靠边期、二核期和三核期)剥取主茎及大分蘖幼穗中部小穗第1、2位小花的花药,样品充分混匀后称重,液氮冷冻30 min后转入-80℃保存备用。采用间接酶联免疫(enzyme linked immunosorbent assay,ELISA)法测定生长素(吲哚-3-乙酸,indole-3-acetic acid,IAA)、赤霉素(赤霉酸,gibberellin acid,GA)、玉米素核苷(zeatin riboside,ZR)、脱落酸(abscisic acid,ABA)、油菜素内酯(brassinolide,BR)和茉莉酸甲酯(methyl jasmonate,MeJA)6种内源激素含量,试验所用试剂盒由中国农业大学作物化控室提供,每样品测定3次,取平均值。
以内源激素含量-Δ(%)判断在正常秋季播种条件下,与晚播相比,激素含量提高的程度。
内源激素含量-Δ(%)=[(正常秋季播种条件下激素含量—晚播条件下激素含量)/晚播条件下激素含量]×100%。由不同材料同时期 2个播期下激素含量计算求得,3次重复,取平均值。
1.2.4 数据统计与分析 用SPSS19.0统计分析软件对数据进行方差分析和显著性检验,采用S-N-K法进行多重比较,采用独立样本T-检验进行2组数据差异性分析,用Excel 2016进行数据处理及作图。
2 结果
2.1 发育进程与温度分析
由表1和图1可知,BNS和BNS366与常规对照品种发育阶段基本吻合,不同之处在于二者比常规对照品种在 2个播期条件下发育进程均略快。BNS和BNS366正常秋季播种条件下,在雌雄蕊原基分化期取样,即在3月5日,日平均温度为11.9℃,但之后连续5 d,日平均温度均低于11.4℃;在晚播条件下,于雌雄蕊原基分化期取样,即在3月20日,日平均温度为17.5℃,且在此之前连续5 d,温度在14.2—18.4℃,其中3 d均高于15.9℃。

表1 不同材料不同发育时期具体取样日期Table 1 The exact sampling dates of different materials in different development stages (month/day)
2.2 温敏核不育小麦和常规对照材料的育性表现
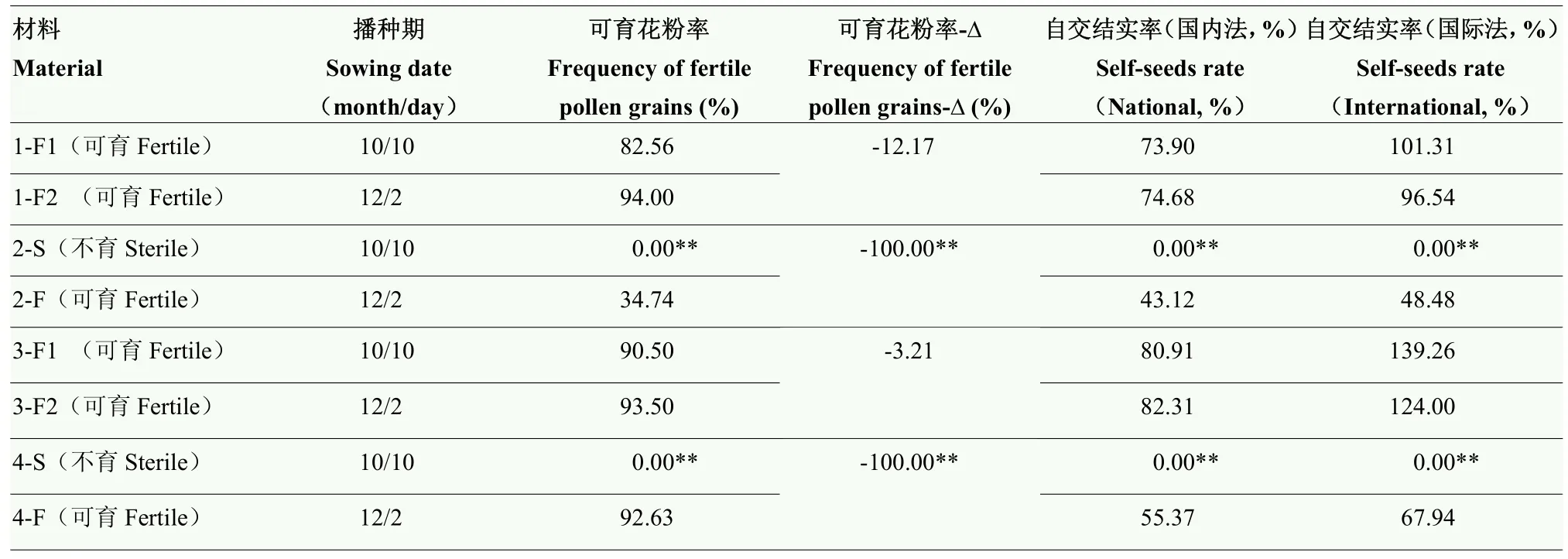
表2 小麦育性表现Table 2 Fertility performance of wheat
由试验材料育性表现观察分析结果(图2和表2)可知,10月 10日播种的温敏核不育小麦 BNS和BNS366花粉均达到全不育水平(花粉可育率为0),自交结实率均为0,表现完全不育;12月2日播种的温敏核不育小麦BNS和BNS366花粉分别达到低不育(花粉可育率31%—50%)和正常可育(花粉可育率>50%)水平,国内法和国际法自交结实率为43.12%—67.94%,表现正常可育,与10月10日播种的BNS和BNS366相比,12月2日播种的小麦育性提高。而同期播种的对照矮抗58和郑麦366花粉均达到正常可育水平,国内法自交结实率为73.90%—82.31%,国际法自交结实率为96.54%—139.26%,播种期间育性表达稳定,差异不显著。BNS和BNS366分别与矮抗58和郑麦366相比,正常秋季播种条件下比晚播条件下花粉可育率提高百分率(花粉可育率-Δ)均极显著降低。因此10月10日播种的BNS和BNS366材料样本后期表现不育,分别用BNS-S和BNS366-S表示,12月2日播种的BNS和BNS366材料样本后期表现可育,分别用BNS-F和BNS366-F表示。在上述2个播期播种的矮抗58和郑麦366材料样本后期均表现可育,分别用矮抗58-F1、矮抗58-F2、郑麦366-F1和郑麦366-F2表示。矮抗58和郑麦366可分别作为BNS和BNS366的常规对照品种,进行后续内源激素含量动态变化的分析。
2.3 温敏核不育小麦和常规对照材料内源激素含量的动态变化
2.3.1 温敏核不育小麦和常规对照材料 IAA含量的动态变化 小麦叶片中IAA含量(表3)基本呈“W”形变化趋势。晚播条件下,BNS和BNS366与常规对照品种相比无规律性差异。与晚播相比,正常秋季播种对2个常规对照品种在整个小麦幼穗发育过程中具有普遍的升高效应(在单核靠边期对郑麦366-F1具有降低效应除外);对BNS-S和BNS366-S在雌雄蕊原基分化期和药隔期具有升高效应,对BNS-S在四分体期和单核靠边期具有降低效应,对BNS366-S在单核中位期、二核期和三核期具有升高效应。分别与矮抗58IAA-Δ和郑麦 366IAA-Δ(Δ为正常秋季播种条件下比晚播条件下激素含量提高百分率,下同)相比,BNSIAA-Δ在四分体期、单核靠边期和三核期较低,BNS366IAA-Δ在雌雄蕊原基分化期较低,在单核中位期和单核靠边期较高,表明BNS-S和BNS366-S叶片中IAA含量在幼穗发育早期阶段,分别在四分体期和雌雄蕊原基分化期,均存在不足现象(下文中有关激素含量的盈亏状况的判断,均按此逻辑推理)。2个试验组小麦叶片IAA含量与可育花粉率在二核期显著负相关;IAA-Δ与可育花粉率-Δ之间均无显著相关关系。
小麦幼穗中IAA含量(表3)呈逐渐下降的变化趋势。晚播条件下,BNS和BNS366与常规对照品种相比无规律性差异。正常秋季播种条件下,小麦幼穗中 IAA 含量一般较高。分别与矮抗 58IAA-Δ和郑麦366IAA-Δ相比,BNSIAA-Δ在雌雄蕊原基分化期较高,BNS366IAA-Δ在雌雄蕊原基分化期较低,表明BNS-S和BNS366-S幼穗中IAA含量无一致盈亏特征。2个试验组小麦幼穗IAA含量与可育花粉率,IAA-Δ与可育花粉率-Δ之间均无显著相关关系。
小麦花药中IAA含量(表3)呈逐渐上升(矮抗58/BNS试验组)或先下降再上升(郑麦366/BNS366试验组,最低点出现在单核靠边期)的变化趋势。晚播条件下,与常规对照品种相比,BNS-F和BNS366-F花药中IAA含量在二核期和三核期均较低。与晚播相比,正常秋季播种对花药中IAA含量的影响表现为:对矮抗 58-F1在单核中位期和单核靠边期,对郑麦366-F1在单核靠边期和三核期具有提高效应,对二者在二核期均有降低效应;对BNS-S在单核靠边期和二核期,对BNS366-S在二核期和三核期均具有升高效应,对 BNS-S在三核期具有降低效应。分别与矮抗58IAA-Δ和郑麦 366IAA-Δ相比,BNSIAA-Δ在单核中位期和三核期较低,在二核期较高,BNS366IAA-Δ在单核靠边期较低,在二核期较高,表明 BNS-S和BNS366-S花药中IAA含量分别在较早的单核中位期和单核靠边期不足,在较晚的二核期均有盈余。2个试验组小麦花药IAA含量与可育花粉率,IAA-Δ与可育花粉率-Δ之间均无显著相关关系。

表3 小麦幼穗发育过程中IAA含量的动态变化Table 3 Dynamic changes of IAA content during developmental stages of wheat young panicle (ng·g-1 FW)
2.3.2 温敏核不育小麦和常规对照材料GA含量的动态变化 小麦叶片中GA含量(表 4)在晚播条件下呈逐渐增加的变化趋势,在早播条件下则为单峰或双峰曲线变化。晚播条件下,与常规对照品种相比,BNS-F叶片中GA含量无规律性差异,BNS366-F在雌雄蕊原基分化期较高,在四分体期至二核期较低,2组试验材料之间未发现一致的差异特征。与晚播相比,正常秋季播种条件下小麦叶片GA含量一般较高;对矮抗58-F1在单核中位期和二核期具有降低效应,对郑麦366-F1在单核靠边期之后无显著影响;对BNS-S在单核靠边期具有降低效应,对BNS-S和BNS366-S在雌雄蕊原基分化期、二核期和三核期均无显著影响。分别与矮抗58GA-Δ和郑麦366GA-Δ相比,BNSGA-Δ在单核中位期和三核期较高,在单核靠边期则较低,BNS366GA-Δ在雌雄蕊原基分化期较低,在四分体期和单核靠边期较高,表明BNS-S和BNS366-S叶片中GA含量无一致盈亏特征。2个试验组小麦叶片中GA含量与可育花粉率,GA-Δ与可育花粉率-Δ之间均无显著相关关系。
不同小麦材料幼穗中GA含量(表4)动态变化趋势不一致。晚播条件下,与常规对照品种相比,BNS-F(2-F)在雌雄蕊原基分化期和四分体期较高,BNS366-F无规律性差异。与晚播相比,正常秋季播种对矮抗58-F1和郑麦366-F1幼穗中GA含量均具有升高效应;对 BNS-S在雌雄原基分化期具有降低效应,在药隔期具有升高效应,对BNS366-S具有升高效应。分别与矮抗 58GA-Δ和郑麦 366GA-Δ相比,BNSGA-Δ在雌雄蕊原基分化期至四分体期均较低,BNS366GA-Δ在雌雄蕊原基分化期较高,在四分体期则较低,表明BNS-S和BNS366-S幼穗中GA含量在四分体期中不足。2个试验组小麦幼穗中GA含量与可育花粉率,GA-Δ与可育花粉率-Δ之间均无显著相关关系。

表4 小麦幼穗发育过程中GA含量的动态变化Table 4 Dynamic changes of GA content during developmental stages of wheat young panicle (ng·g-1 FW)
小麦花药中GA含量(表4)呈单峰曲线基本变化趋势。晚播条件下,与常规对照品种相比,BNS-F在单核中位期和三核期较高,BNS366-F在单核中位期较高,在二核期较低。与晚播相比,正常秋季播种对矮抗58-F1无显著影响,对郑麦366-F1在二核期具有降低效应;对BNS-S在单核中位期,BNS366-S在单核中位期和二核期具有降低效应,对BNS366-S在单核靠边期具有升高效应。分别与矮抗 58GA-Δ和郑麦 366GA-Δ相比,BNSGA-Δ和 BNS366GA-Δ均在单核中位期较低,为负值,表明BNS-S和BNS366-S花药中GA含量在单核中位期不足。2个试验组小麦花药中GA含量与可育花粉率无显著相关关系。GA-Δ与可育花粉率-Δ在单核中位期显著正相关,GA-Δ与可育花粉率-Δ在单核靠边期显著负相关。
2.3.3 温敏核不育小麦和常规对照材料ZR含量的动态变化 小麦叶片中ZR含量(表5)变化基本处于波动状态中。晚播条件下,BNS和BNS366与常规对照品种相比,BNS-F在四分体期和单核中位期较低,在单核靠边期较高,BNS366-F在雌雄蕊原基分化期、药隔期和二核期较低,在单核靠边期较高。与晚播相比,正常秋季播种对矮抗58-F1在雌雄蕊原基分化期、药隔期和单核中位期具有降低效应,在四分体期和单核靠边期具有升高效应,对郑麦366-F1在雌雄蕊原基分化期具有降低效应,在三核期具有升高效应;对BNS-S在雌雄蕊原基分化期和单核靠边期具有降低效应,在四分体期、二核期和三核期具有升高效应,对BNS366-S在药隔期和三核期具有升高效应。分别与矮抗 58ZR-Δ和郑麦 366ZR-Δ相比,BNSZR-Δ在单核中位期和二核期较高,在单核靠边期则较低,BNS366ZR-Δ在药隔期较高,在三核期较低,表明BNS-S和BNS366-S叶片中ZR含量无一致盈亏特征。2个试验组小麦叶片中ZR含量与可育花粉率,ZR-Δ与可育花粉率-Δ之间均无显著相关关系。
不同小麦材料幼穗中ZR含量(表5)动态变化趋势不一致。晚播条件下,与常规对照品种相比,BNS-F在雌雄蕊原基分化期较低,在药隔期较高,BNS366-F在药隔期较低,二者变化不一致。与晚播相比,正常秋季播种对矮抗58-F1和郑麦366-F1在雌雄蕊原基分化期幼穗中ZR含量具有升高效应,在药隔期具有降低效应;对 BNS-S在雌雄蕊原基分化期具有升高效应,对BNS-S在药隔期和四分体期,BNS366-S在雌雄蕊原基分化期具有降低效应。分别与矮抗 58ZR-Δ和郑麦366ZR-Δ相比,BNSZR-Δ在药隔期和四分体期较低,BNS366ZR-Δ在雌雄蕊原基分化期较低,在药隔期较高,表明BNS-S和BNS366-S幼穗中ZR含量无一致盈亏特征。2个试验组小麦幼穗中ZR含量与可育花粉率,ZR-Δ与可育花粉率-Δ之间均无显著相关关系。
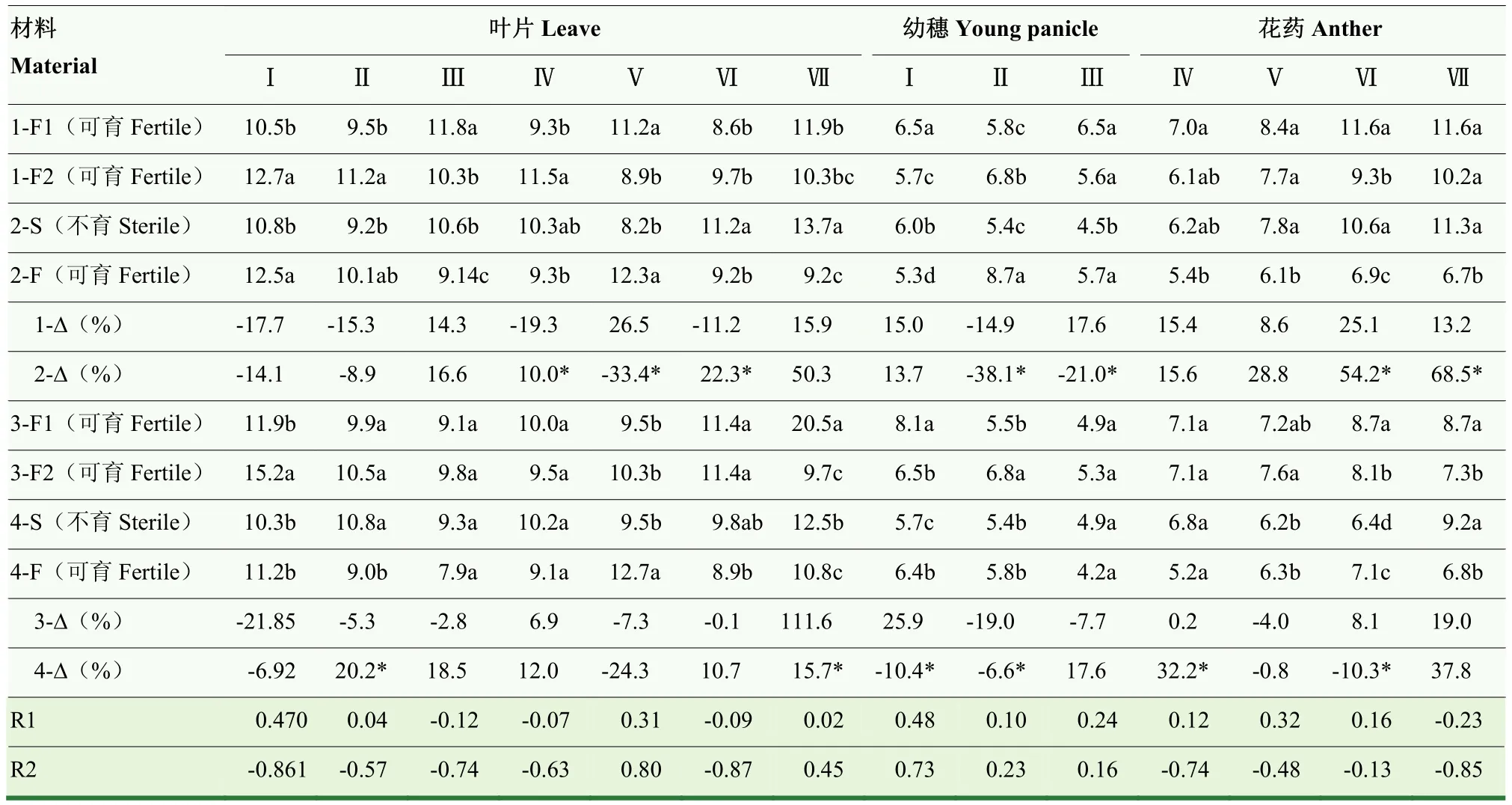
表5 小麦幼穗发育过程中ZR含量的动态变化Table 5 Dynamic changes of ZR content during developmental stages of wheat young panicle (ng·g-1 FW)
小麦花药中ZR含量(表5)均呈先逐渐上升,至二核期之后继续上升、维持平稳变化或略有下降的基本变化趋势。晚播条件下,与常规对照品种相比,BNS-F在单核靠边期之后均较低,BNS366-F在单核靠边期和二核期较低。与晚播相比,正常秋季播种对矮抗58-F1在二核期,对郑麦366-F1在二核期和三核期均具有升高效应;对BNS-S在单核靠边期之后具有升高效应,对BNS366-S在二核期具有降低效应,在三核期具有升高效应。分别与矮抗 58ZR-Δ和郑麦366ZR-Δ相比,BNSZR-Δ在二核期和三核期较高,BNS366ZR-Δ在单核中位期较高,在二核期较低,表明BNS-S和BNS366-S花药中ZR含量无一致盈亏特征。2个试验组小麦花药中 ZR含量与可育花粉率,ZR-Δ与可育花粉率-Δ之间均无显著相关关系。
2.3.4 温敏核不育小麦和常规对照材料 ABA含量的动态变化 不同小麦材料叶片中ABA含量(表6)变化趋势不一致,矮抗 58/BNS试验组和郑麦366/BNS366试验组均呈单峰曲线基本变化趋势,郑麦366材料组呈双峰曲线基本变化趋势。晚播条件下,BNS和BNS366与常规对照品种相比,叶片中ABA含量无规律性差异。与晚播相比,正常秋季播种对矮抗58-F1无规律性影响,对郑麦366-F1在药隔期具有升高效应,在四分体期和单核靠边期具有降低效应;对 BNS-S在雌雄蕊原基分化期和四分体期具有降低效应,在单核靠边期和三核期具有升高效应,对BNS366-S在雌雄蕊原基分化期、药隔期、单核靠边期、二核期和三核期具有升高效应,在单核中位期具有降低效应。分别与矮抗58ABA-Δ和郑麦366ABA-Δ相比,BNSABA-Δ在雌雄蕊原基分化期和四分体期较低,BNS366ABA-Δ在雌雄蕊原基分化期、二核期和三核期较高,表明BNS-S和BNS366-S叶片中ABA含量无一致盈亏特征。2个试验组小麦叶片中ABA含量与花粉可育率,ABA-Δ与花粉可育率-Δ之间均无显著相关关系。
不同小麦材料幼穗中ABA含量(表6)动态变化趋势不一致。晚播条件下,与常规对照品种相比,在雌雄蕊原基分化期BNS-F较低,BNS366-F较高,二者在四分体期均较高。与晚播相比,正常秋季播种对矮抗58-F1在雌雄蕊原基分化期和四分体期,对郑麦366-F1在雌雄蕊原基分化期、药隔期和四分体期均具有升高效应;对BNS-S和BNS366-S在雌雄蕊原基分化期具有升高效应,对BNS366-S在四分体期具有降低效应。分别与矮抗58ABA-Δ和郑麦366ABA-Δ相比,BNSABA-Δ与矮抗58ABA-Δ相比差异不显著,在四分体期数值虽然较小,但仍未达到显著水平,BNS366ABA-Δ在雌雄蕊原基分化期较高,在四分体期较低,表明BNS-S和BNS366-S幼穗中ABA含量分别在四分体期存在偏低倾向或确定存在不足现象。2个试验组小麦幼穗中 ABA含量与花粉可育率无显著相关关系,ABA-Δ与花粉可育率-Δ在四分体期显著正相关。
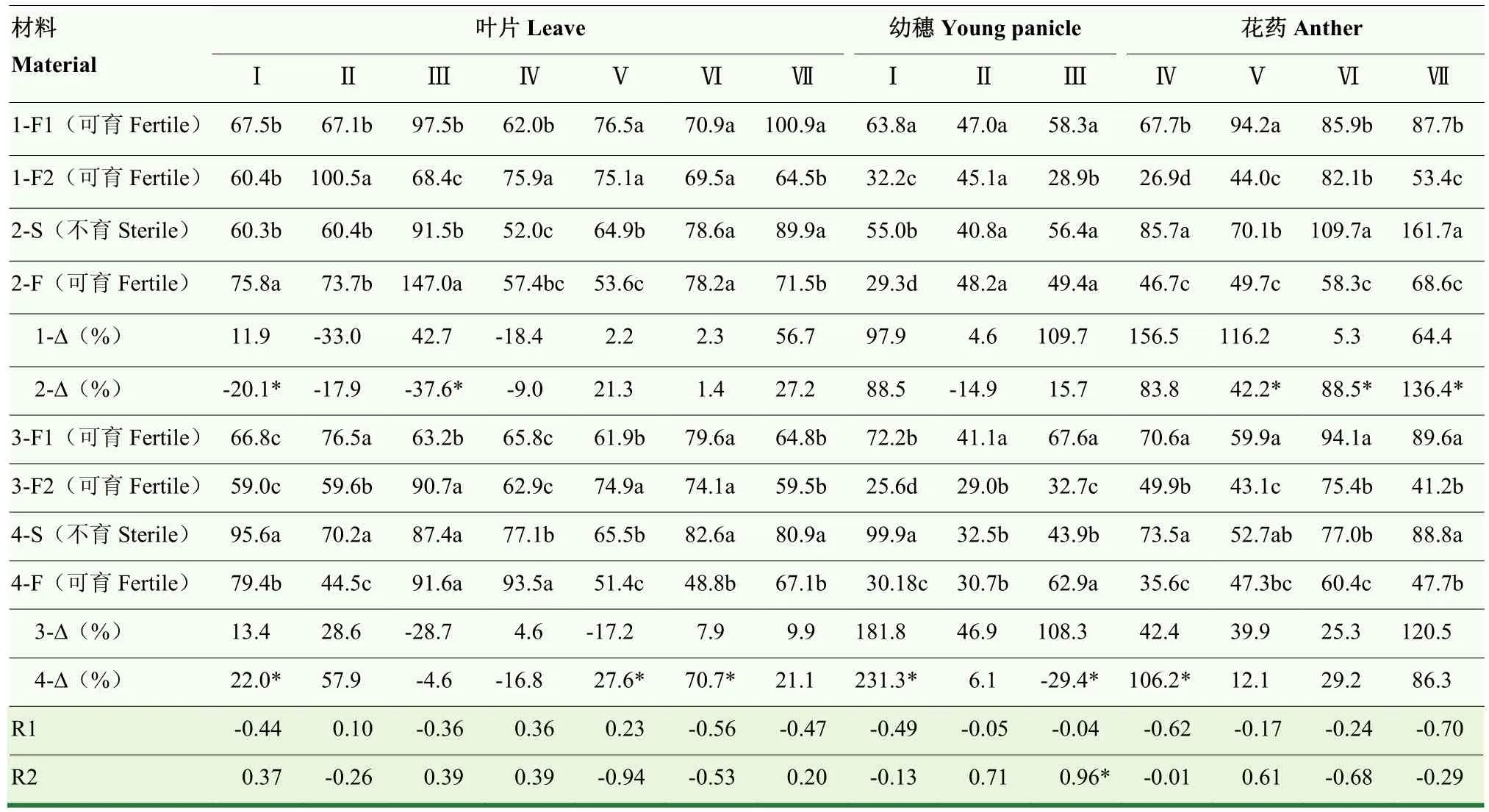
表6 小麦幼穗发育过程中ABA含量的动态变化Table 6 Dynamic changes of ABA content during developmental stages of wheat young panicle (ng·g-1 FW)
不同小麦材料花药中ABA含量(表6)变化趋势不一致,矮抗58-F1和矮抗58-F2呈单峰曲线变化,峰值分别出现在单核靠边期和二核期;BNS-S和BNS-F持续上升;郑麦 366-F1、郑麦 366-F2和BNS366-F均呈单峰曲线变化且峰值出现在二核期,BNS366-S呈先下降再上升变化,最低值出现在单核靠边期。晚播条件下,与常规对照品种相比,BNS-F在单核中位期较高,BNS366-F则较低,二者在二核期均较低。与晚播相比,正常秋季播种对小麦花药中ABA含量具有升高效应。分别与矮抗 58ABA-Δ和郑麦 366ABA-Δ相比,BNSABA-Δ在单核靠边期较低,在二核期和三核期较高,BNS366ABA-Δ在单核中位期较高,表明BNS-S和BNS366-S花药中ABA含量无一致盈亏特征。2个试验组小麦花药中ABA含量与花粉可育率,ABA-Δ与花粉可育率-Δ之间均无显著相关关系。
2.3.5 温敏核不育小麦和常规对照材料BR含量的动态变化 小麦叶片中 BR含量(表 7)呈先下降再升高再下降的基本变化趋势。晚播条件下,与常规对照品种相比,BNS-F在雌雄蕊原基分化期、四分体期和二核期均较高,在单核中位期较低,BNS366-F在药隔期和四分体期均较高。与晚播相比,正常秋季播种对矮抗 58-F1在二核期具有升高效应,对矮抗 58-F1在药隔期,对郑麦366-F1在药隔期、四分体期和三核期具有降低效应;对BNS-S在雌雄蕊原基分化期、单核中位期和单核靠边期具有升高效应,对 BNS366-S在雌雄蕊原基分化期和单核中位期具有升高效应,对二者在药隔期和四分体期具有降低效应。分别与矮抗58BR-Δ和郑麦 366BR-Δ相比,BNSBR-Δ在药隔期、四分体期和二核期均较低,在单核中位期较高,BNS366BR-Δ在雌雄蕊原基分化期和三核期均较高,表明BNS-S和BNS366-S叶片中BR含量无一致盈亏特征。2个试验组小麦叶片中BR含量与花粉可育率在雌雄蕊原基分化期显著负相关;BR-Δ与花粉可育率-Δ之间无显著相关关系。
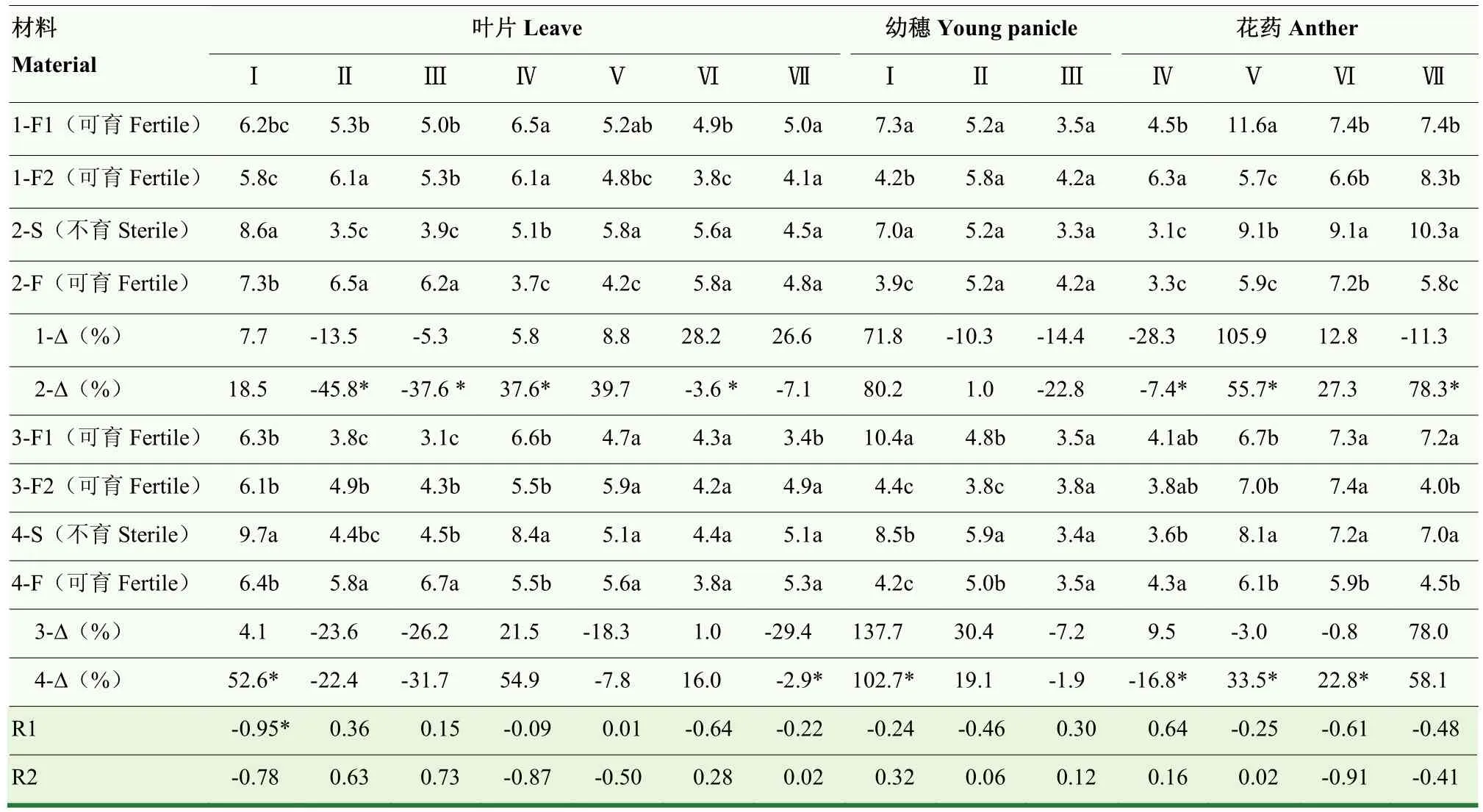
表7 小麦幼穗发育过程中BR含量的动态变化Table 7 Dynamic changes of BR content during developmental stages of wheat young panicle (ng·g-1 FW)
不同小麦材料幼穗中BR含量(表 7)动态变化趋势不一致,先上升再下降或持续下降。晚播条件下,与常规对照品种相比,BNS-F幼穗中BR含量在雌雄蕊原基分化期较低,BNS366-F在药隔期较高。与晚播相比,正常秋季播种对不同材料在雌雄蕊原基分化期均有升高效应,对郑麦366-F1和BNS366-S在二核期也具有升高效应。BNSBR-Δ与矮抗 58BR-Δ相比差异不显著,与郑麦 366BR-Δ相比,BNS366BR-Δ在雌雄蕊原基分化期较低,表明BNS-S和BNS366-S幼穗中 BR含量无一致盈亏特征。2个试验组小麦幼穗中BR含量与花粉可育率、BR-Δ与花粉可育率-Δ之间均无显著相关关系。
小麦花药中 BR含量(表 7)呈单峰曲线变化或逐渐上升变化趋势,不同播期不同材料之间不一致。晚播条件下,与常规对照品种相比,BNS-F在单核中位期和三核期较低,BNS366-F在二核期较低。与晚播相比,正常秋季播种对矮抗58-F1在单核中位期具有降低效应,对矮抗 58-F1在单核靠边期和郑麦366-F1在三核期具有升高效应;对 BNS-S和BNS366-S在单核靠边期、二核期和三核期均具有升高效应,对BNS366-S在单核中位期具有降低效应。分别与矮抗58BR-Δ和郑麦366ABR-Δ相比,BNSBR-Δ在单核中位期和三核期(Ⅶ)较高,在单核靠边期较低,BNS366BR-Δ在单核中位期较低,在单核靠边期和二核期较高,表明BNS-S和BNS366-S花药中BR含量无一致盈亏特征。2个试验组小麦花药中BR含量与花粉可育率、BR-Δ与花粉可育率-Δ之间均无显著相关关系。
2.3.6 温敏核不育小麦和常规对照材料MeJA含量的动态变化 不同小麦材料叶片中MeJA含量(表8)变化趋势不一致,在药隔期之前和二核期之后剧烈上升或下降,除矮抗58-F1在四分体期,BNS366-F在四分体期和单核中位期较高外,在药隔期至单核靠边期变化相对平稳。晚播条件下,与常规对照品种相比,BNS-F在雌雄蕊原基分化期、二核期和三核期均较高,BNS366-F在药隔期和二核期较低,在四分体期和单核中位期较高。与晚播相比,正常秋季播种对矮抗58-F1在雌雄蕊原基分化期、四分体期和单核中位期具有升高效应,在三核期具有降低效应,对郑麦366-F1在雌雄蕊原基分化期具有升高效应,在单核靠边期、二核期和三核期具有降低效应;对BNS-S在雌雄蕊原基分化期具有升高效应,在药隔期、四分体期、单核中位期、二核期和三核期均具有降低效应,对BNS366-S在雌雄蕊原基分化期、药隔期和单核靠边期具有升高效应,在四分体期、单核中位期、二核期和三核期具有降低效应。分别与矮抗58MeJA-Δ和郑麦366A MeJA-Δ相比,BNSMeJA-Δ在雌雄蕊原基分化期、药隔期、四分体期、单核靠边期和三核期均较低,BNS366 MeJA-Δ在雌雄蕊原基分化期、四分体期、单核中位期和三核期均较低,在单核靠边期和二核期较高,表明BNS-S和BNS366-S叶片中MeJA含量在整个幼穗发育过程中普遍不足,尤其是在雌雄蕊原基分化期、四分体期,分别在单核靠边期和单核中位期、三核期,二者表现一致。2个试验组小麦叶片中MeJA含量与花粉可育率、MeJA-Δ与花粉可育率-Δ之间均无显著相关关系。
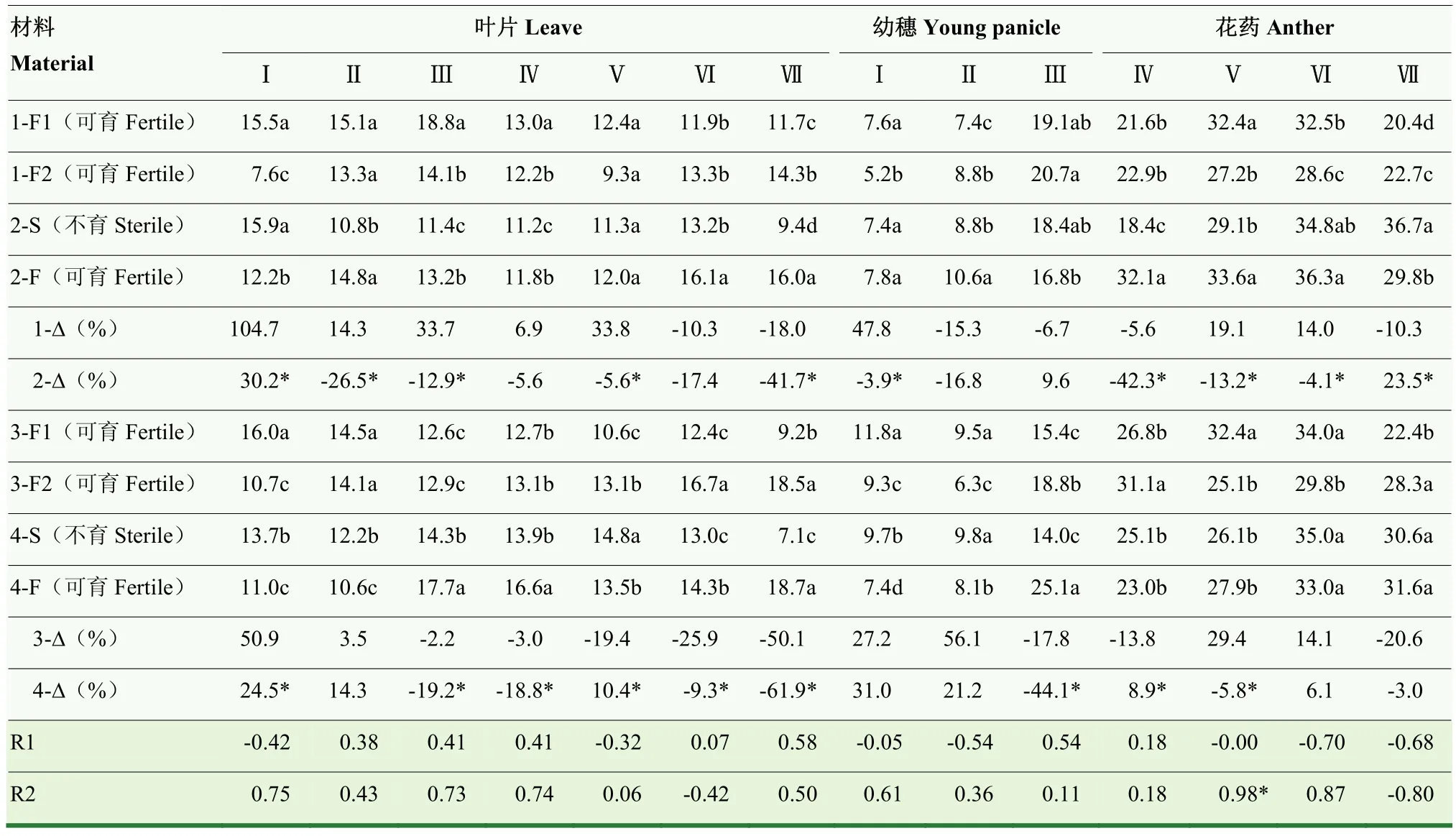
表8 小麦幼穗发育过程中MeJA含量的动态变化Table 8 Dynamic changes of MeJA content during developmental stages of wheat young panicle (ng·g-1 FW)
小麦幼穗中MeJA含量(表8)呈先小幅上升或下降,或平稳变化,然后再剧烈上升的变化趋势。晚播条件下,与常规对照品种相比,BNS-F在雌雄蕊原基分化期和药隔期较高,在四分体期较低,BNS366-F在雌雄蕊原基分化期较低,在药隔期和四分体期较高。与晚播相比,正常秋季播种对矮抗58-F1在雌雄蕊原基分化期具有升高效应,在药隔期具有降低效应,对郑麦 366-F1在雌雄蕊原基分化期和药隔期具有升高效应,在四分体期具有降低效应;对BNS-S在药隔期具有降低效应,对BNS366-S在雌雄蕊原基分化期和药隔期具有升高效应,在四分体期具有降低效应。分别与矮抗 58MeJA-Δ和郑麦 366A MeJA-Δ相比,BNSMeJA-Δ在雌雄蕊原基分化期较低,BNS366 MeJA-Δ在四分体期较低,表明 BNS-S和 BNS366-S幼穗中MeJA含量均存在不足现象,分别出现在雌雄蕊原基分化期和四分体期。2个试验组小麦幼穗中MeJA含量与花粉可育率、MeJA-Δ与花粉可育率-Δ之间均无显著相关关系。
小麦花药中MeJA含量(表8)呈单峰曲线基本变化趋势,峰值一般出现在二核期。晚播条件下,与常规对照品种相比,BNS-F在单核中位期至三核期均较高,BNS366-F在单核中位期较低,在二核期较高。与晚播相比,正常秋季播种对矮抗58-F1在单核靠边期和二核期具有升高效应,在三核期具有降低效应,对郑麦 366-F1在单核靠边期和二核期具有升高效应,在单核中位期和三核期具有降低效应;对BNS-S在单核中位期和单核靠边期具有降低效应,在三核期具有升高效应,对BNS366-S无显著影响。分别与矮抗 58MeJA-Δ和郑麦 366A MeJA-Δ相比,BNSMeJA-Δ在单核中位期、单核靠边期和二核期均较低,在三核期则较高,BNS366 MeJA -Δ在单核中位期较高,在单核靠边期较低,表明BNS-S和BNS366-S花药中MeJA含量变化均在单核靠边期不足。2个试验组小麦花药中MeJA含量与花粉可育率无显著相关关系;MeJA-Δ与花粉可育率-Δ在单核靠边期显著正相关,这与BNS-S和BNS366-S在单核靠边期MeJA含量存在不足现象相吻合。
3 讨论
3.1 发育进程与温度分析
在本试验条件下,BNS和BNS366在正常秋季播种条件下,在雌雄蕊原基分化期日平均温度为11.9℃,略高于11.4℃,但之后连续5 d,日平均温度均在 11.4℃之下;在晚播条件下,在雌雄蕊原基分化期日平均温度为17.5℃,且在此之前连续5 d,温度在14.2—18.4℃,其中3 d均高于15.9℃。前人研究指出,BNS温度敏感期为小花原基分化期至雌雄蕊分化期,日平均温度7.4—11.4℃时,不育,高于 11.4℃时,育性转换;春播 BNS的同期温度为15.9℃,可育[1]。因而本试验条件下,2个试验组在2个播期条件下,次年春季均能在合适的发育时期遭遇合适的温度诱导,能够基本满足不同材料育性表现的温度要求。
3.2 温敏核不育小麦和常规对照材料的育性表现
本研究结果显示,在10月10日正常秋季播种条件下,BNS和BNS366均不育,在12月2日播种条件下,二者均可育;2个试验组的常规对照品种矮抗58和郑麦366在2个播期条件下均可育。前人研究指出,在豫北地区9月23日-10月17日播种BNS稳定表现彻底不育,可以用于生产杂交种;11月18日以后播种均表现完全可育,可以自交繁殖不育系种子[7]。以矮抗58为对照,BNS在秋季播种时表现随播期推迟呈现不育-育性转换-可育的育性转换规律,矮抗58在不同播期间变化不大[1]。BNS366在长沙随播种期的推迟,表现育性转换特征。9月23日—10月17日播种不育,10月25日播种育性转换,12月4日播种可育[3]。本研究结果与上述报道所述现象基本一致,表明本试验设置的不同材料的育性差异能够表现出来,为后续内源激素含量动态变化研究建立的试验模型安全可靠。
3.3 内源激素与雄性不育的关系
3.3.1 IAA与雄性不育的关系 本研究选用矮抗58/BNS试验组和郑麦366/BNS366 2个试验组开展研究,结果存在相似之处,主要原因可能在于 BNS和BNS366均有相同的不育基因;2个试验组结果也存在不同之处,原因可能在于矮抗 58/BNS试验组材料遗传背景差异较大,郑麦 366/BNS366试验组材料为近等基因系(除了不育基因不同之外,其他遗传背景一致),在矮抗 58/BNS试验组发现的现象,在郑麦366/BNS366试验组消除了遗传背景差异的条件下,会出现新的特征,后者结果更可信,本文主要针对2个试验组结果中内源激素的共同盈亏特征展开讨论(下同)。本研究结果显示,BNS-S和BNS366-S叶片中IAA含量分别在四分体期和雌雄蕊原基分化期,均存在不足现象;BNS-S和 BNS366-S花药中 IAA含量分别在单核中位期和单核靠边期不足(表3),这可能与二者雄性不育的发生有关。在上述 IAA含量特征差异点,IAA含量与可育花粉率,IAA-Δ与可育花粉率-Δ之间均无显著相关性,表明 BNS和BNS366雄性不育的发生与小孢子发育早期叶片和花药中 IAA含量不足有关,但二者之间关系可能比较复杂,没有显著的直线相关性,下文中类似情况均按此逻辑理解。
前人研究结果普通认为IAA含量的不足与雄性不育的发生有关。细胞质雄性不育小麦[23]、榨菜[24]和烟草[25];隐性细胞核不育西瓜[26];光敏核不育水稻[13]和玉米[14]不育系叶片、幼穗和花药组织中IAA含量均低于可育系。随低温时间延长,幼穗分化Ⅴ期时(约剑叶开始抽出时),叶片IAA下降幅度较大的水稻光温敏不育系,雄性不育程度也较大[13]。与在可育播期播种相比,在不育播期播种的小麦温敏不育系C412S、C050S、C010S(减数分裂期)和C49S(花粉母细胞期至三核期)幼穗和花药中IAA含量不足,常规对照品种在播期间的变化不大[15-16]。在四分体期至三核期,与BNS可育幼穗相比,单核期不育幼穗中IAA含量较低[17]。在雌雄蕊分化期至三核期,与BNS可育株相比,不育株叶片、幼穗和花药IAA均较低[18]。本研究结果与上述结论基本一致。
本研究结果还显示,BNS-S和BNS366-S花药中IAA含量在较晚的二核期均有盈余(表3),这与上述结论不一致,这可能与不同作物的生理特点及不同研究的试验体系均有关系,本研究与已有BNS研究结果不一致的主要原因可能在于,本研究采用 2种BNS系列不育系,设置了常规品种为对照,尤其是以近等基因系为对照,分别计算不同材料在正季秋播条件下比在晚播条件下内源激素含量升高或降低的百分比(Δ)为参比,以2种BNS系列材料在晚播条件下形成的可育株为基准,分析 BNS-S和BNS366-S分别比BNS-F和BNS366-F内源激素含量升高或降低的百分比的大小,以此判断其中内源激素含量的盈余或不足,并归纳出2种BNS系列材料之间的相似之处,排除了不同播期下即使常规品种也会出现的无关干扰所致(下同)。已有研究指出,BNS和BNS366花粉败育的关键期为单核靠边期[2,9-10],在本试验条件下,BNS-S和BNS366-S花药中IAA含量在二核期盈余可能是二者雄性不育的结果,而不可能是二者雄性不育发生的原因,对此尚待进一步研究。
3.3.2 GA与雄性不育的关系 本研究结果显示,BNS-S和BNS366-S叶片中GA的含量无一致盈亏特征(表4),因此,叶片中GA含量变化与二者雄性不育的发生之间关系不密切。张艳玉等[18]发现,BNS在正常秋季播种和晚播条件下,分别形成不育株和可育株,与可育株相比,BNS不育株叶片GA含量在雌雄蕊分化期不足,在减数分裂期和单核期盈余,这与本试验条件下,与晚播相比,正常秋季播种条件下BNS-S在药隔期、四分体期和单核中位期均较高,在单核靠边期较低的研究结果基本吻合,在此基础上,本研究增加了常规对照品种矮抗58在2个播期下的叶片中 GA的含量比较,比较了 BNSGA-Δ和矮抗 58 GA-Δ的差异,发现上述正常秋播条件下,BNS和矮抗58在药隔期和四分体期叶片中IAA含量均存在升高的现象,二者之间差异不显著,BNSGA-Δ在单核中位期和三核期较高,在单核靠边期则较低,此结果在郑麦366/BNS366试验组不能重现,因此,本研究表明叶片中GA含量与雄性不育发生存在密切关系的证据不充分。
本研究还发现,幼穗中 GA含量在四分体期不足;花药中GA含量在单核中位期不足(表4),可能与二者雄性不育的发生均有关系。前人研究表明,花器官GA含量对植物的育性转换具有不同的影响。DUCA等[27]在向日葵发育早期外施 GA3,导致可育株花序雄性不育。但是,在其他禾本科作物中,关于GA对雄性不育研究与本研究的结论类似。在温敏雄性不育小麦幼穗和花药中,GA含量的降低与植物雄性不育的发生有关。张自刚等[17]和张艳玉等[18]以BNS不育株和可育株为材料,发现在BNS幼穗发育的雌雄蕊分化期至三核期,不育株中 GA的含量较低。杨海燕[15]和 ZHANG等[16]以常规对照品种为对照,分别在小麦温敏不育系 C412S、C050S、C010S和C49S的不育播期和可育播期播种,与可育株相比,在不育播期播种的小麦温敏不育系不育株C49S幼穗和花药中GA含量不足,常规对照品种在播期间的变化不大。高温条件下,水稻栽培品种汕优63和特优559花粉中GA含量降低,小花败育率升高[28]。GA含量不足不利于各种水解酶的合成,削弱了花药发育所需物质保障[29]。
3.3.3 ZR与雄性不育的关系 本研究显示BNS-S和BNS366-S叶片、幼穗和花药中ZR含量均无一致盈亏特征(表5),表明BNS和BNS366雄性不育的发生与幼穗和花药中ZR含量变化之间关系均不密切。与在可育播期播种相比,在不育播期播种的小麦温敏不育系C412S、C050S、C010S和C49S减数分裂期至单核期幼穗和花药中ZR含量过剩,常规对照品种在播期间的变化不大[15-16]。张自刚等[17]发现,在四分体期至三核期,与BNS可育幼穗相比,单核期不育幼穗中ZR含量较低,三核期不育幼穗ZR含量较高。高含量的ZR即可以抑制或阻止抗氰呼吸途径,又可以部分抑制细胞色素途径,从而降低植物花药的总呼吸强度[30]。本研究与上述结果均不一致,这与本研究采用 BNS和BNS3662个BNS系列不育系,分别设置常规对照品种,尤其是BNS366以其近等基因系郑麦366为对照,两组试验均设置正常秋季播种和晚播2个播期,对试验体系进行了扩充完善有关,本研究以两组试验结果的共同特征判断BNS和BNS366雄性不育发生的内源激素含量变化方面的原因,结果的准确性也得到进一步提高,是对BNS系列雄性不育系花粉败育生理基础理论认识的扩展和提升。
3.3.4 ABA与雄性不育的关系 本研究显示 BNS-S和 BNS366-S叶片中 ABA含量无一致盈亏特征;BNS-S和BNS366-S幼穗中ABA含量分别在四分体期存在偏低倾向或确定存在不足现象;BNS-S和BNS366-S花药中ABA含量无一致盈亏特征(表6);其中,四分体期幼穗中ABA存在偏低倾向或不足可能与二者雄性不育的发生关系密切。张爱民等[23]指出,与恢复系和杂种 F1相比,T型小麦细胞质雄性不育系花粉败育时期花药中ABA含量较高。相反的,赵玉锦等[31]指出在光温敏水稻雄性不育系农垦 58S中内源ABA含量在叶片、花粉母细胞期幼穗、单核期颖花和扬花期花药中均较低,是导致其花粉败育的重要原因。与在可育播期播种相比,在不育播期播种的小麦温敏不育系 C412S、C050S、C010S和C49S幼穗和花药中ABA含量不足,常规对照品种在播期间的变化不大[15-16]。张艳玉等[18]指出,与BNS可育株相比,不育株ABA含量在叶片(药隔期和减数分裂期)、幼穗(单核期之前,尤其是减数分裂期)和花药中(单核期和二核期)均较低。本研究结果与上述T型小麦细胞质雄性不育系研究结果不一致,但与光温敏水稻、小麦雄性不育系研究结果类似。ABA是一种重要的植物抗逆激素,其含量不足对光温敏水稻雄性不育系农垦 58S抗逆能力起降低效应,并降低其花药组织中ATP含量,最终导致花药败育[31]。张自刚等[17]和张艳玉等[18]试验发现,与BNS可育株相比,不育株ABA含量在二核期和三核期幼穗中较高,这与本试验条件下,矮抗58/BNS试验组结果相一致,但这种现象在郑麦366/BNS366试验组,试验材料为一对近等基因系条件下不能重现,因此,本研究认为在 2个试验组间无一致盈亏特征,BNS不育株ABA含量在二核期和三核期幼穗中较高与雄性不育发生之间的关系不能确定,对此仍需进一步研究。
3.3.5 BR与雄性不育的关系 本研究显示BNS-S和BNS366-S叶片、幼穗和花药中BR含量均无一致盈亏特征(表7),表明二者雄性不育的发生与叶片、幼穗和花药中BR含量关系不密切。BR对雄性器官发育具有重要的调控作用[32]。YE等[33]对拟南芥花粉发育关键基因表达研究发现,BR缺陷及不敏感株系中绒毡层和小孢子发育异常,是雄性不育的主要原因。但王永琦等[26]对西瓜雄性不育系Se18内源激素含量变化分析发现,从花粉母细胞期至花粉成熟期,不育雄花蕾中 BR含量在单—双核小孢子期高于可育株,其他时期低于可育株,叶片中BR含量低于可育株,与本研究结论均不一致,表明BNS和BNS366雄性不育可能通过 BR含量变化之外的其他途径发生。
3.3.6 MeJA与雄性不育的关系 本研究显示BNS-S和BNS366-S叶片中MeJA含量在整个幼穗发育过程中普遍不足,尤其是在雌雄蕊原基分化期、四分体期,分别在单核靠边期和单核中位期、在三核期,二者表现一致;二者幼穗中MeJA含量均存在不足现象,分别出现在雌雄蕊原基分化期和四分体期;花药中MeJA含量变化均在单核靠边期不足(表8);这可能与二者雄性不育的发生关系密切。已有针对MeJA与植物雄性不育的关系研究尚不多见。杨海燕[15]指出,与在可育播期播种相比,在不育播期播种的小麦温敏不育系C412S四份体期和单核中位期幼穗中JA含量不足。拟南芥雄性不育dadl突变体花药不能正常的裂开,并且茉莉酸含量低、花丝的伸长受到抑制、其他发育延迟。当对其施加外源茉莉酸时,恢复正常[34]。本研究与上述研究的结论类似。1 mmol·L-1MeJA喷施小麦幼苗叶面后,可以提高叶片及分蘖节冷响应基因的表达量,JA对CBF途径冷响应基因的调节与低温胁迫下冬小麦的强抗寒性有关[35]。因此,MeJA含量的不足不利于植物抗冷性的维持和提高,在正常秋播种条件下,已有研究中 C412S[34]和本研究中BNS和BNS366叶片、幼穗和花药中均存在的MeJA含量的不足,可能是其雄性不育发生的重要原因。茉莉酸及其甲酯为主的茉莉酸类物质,可以作为与损伤相关的植物激素和信号分子,参与植物的防御反应;也可以促进呼吸作用和衰老[36]。前人研究发现有13个转录因子作用于雄花的发育,其中MYB21和 MYB24受茉莉酸调控[37]。本研究结果与上述结论基本一致。由于BNS和BNS366花粉败育的关键期为单核靠边期[2,9-10],本研究结果在 BNS-S和BNS366-S单核靠边期之前相关MeJA含量在不同器官中的不足,可能是二者雄性不育发生的原因,在三核期叶片中 MeJA含量的不足可能是前期亏缺现象的延续,也可能是雄性不育发生的结果,对此尚待进一步研究。
4 结论
正常秋季播种条件下,BNS和BNS366叶片(四分体期和雌雄蕊原基分化期)和花药中(BNS-S在单核中位期,BNS366-S在单核靠边期)的 IAA、幼穗(四分体期)和花药中的(单核中位期)GA、幼穗中的(四分体期,BNS-S存在偏低倾向,BNS366-S不足)ABA含量不足;尤其是叶片(雌雄蕊原基分化期、四分体期、单核靠边期-BNS或单核中位期-BNS366)、幼穗和花药中(单核靠边期)MeJA的含量不足,可能促进了二者雄性不育的发生。

