兔斯氏艾美耳球虫感染模型及巢式PCR诊断方法的建立
温福利
(联勤保障部队第九〇〇医院基础医学实验室,福州 350025)
兔球虫病(rabbit coccidiosis)是由兔球虫寄生于肠道或胆管引起的一种感染性寄生虫病[1]。兔球虫共有11种,其中斯氏艾美耳球虫(Eimeria stiedai,E.stiedai) 是唯一寄生于肝胆管上皮细胞的兔球虫,可导致严重的肝球虫病[2]。兔球虫病在临床中以肠型和肝型球虫混合感染为主,经过裂殖生殖和配子生殖的E.stiedai卵囊到肠腔后与肠型球虫一起随粪便排出[3]。巢式PCR是一种成熟的核酸扩增技术,通过内引物和外引物的双重基因扩增,可特异地鉴定是否存在E.stiedai感染。在科学实验中,因E.stiedai寄生部位的特殊性,较易获取纯种卵囊。本研究通过建立兔E.stiedai感染模型可获取更多卵囊,利用临床剖检、显微镜观察、血液生化检查和病理组织学检查等方法对建立的模型进行鉴定。
1 材料与方法
1.1 实验动物
普通级雄性新西兰兔9只,40~45日龄,平均体质量为0.84 kg,购自福建省连江玉华山自然生态农业试验场 [SCXK(闽)2014-0001],有抗球虫药物治疗记录。实验兔饲养于联勤保障部队第九〇〇医院普通环境[SYXK(闽)2018-0005],动物实验符合相关伦理要求并给予人道关怀。
1.2 主要仪器与试剂
Catalyst One 全自动生化分析仪为美国IDEXX Laboratories公司产品;EG1150H石蜡包埋机、RM2245半自动轮转式切片机、ST5020多功能染色机、CV5030全自动化玻片盖片机和DM2000生物显微镜均为德国Leica公司产品;ABI Veriti PCR仪为美国Applied Biosystems公司产品。植物基因组DNA快速抽提试剂盒和DNA扩增相关试剂为生工生物工程(上海)股份有限公司产品;PCR反应扩增仪为美国Bio-Rad公司产品;DYY-6C型稳压稳流电泳仪为北京六一生物科技有限公司产品;FR980凝胶成像系统为上海复日科技有限公司产品。E.stiedai由中国农业大学索勋课题组提供。
1.3 兔E.stiedai感染模型的建立
将约5×104个E.stiedai通过灌胃法注入实验组新西兰兔体内,21 d后对实验兔进行观察,剖检肝脏病变。取病变肝脏的一小块结节病灶,加适量0.9%NaCl溶液(即生理盐水)进行压片镜检,拍照后测量虫卵长度。采集耳缘静脉血液于绿色头盖标记的肝素锂采血管中,进行血液生化检查。同时,分别取实验组和对照组一小块肝脏组织(1 cm×1 cm×0.5 cm),置于体积分数为10%的甲醛溶液中固定24 h。梯度乙醇脱水后二甲苯透明,常规石腊包埋,切片后进行HE染色,中性树胶封固后,显微镜下观察。
1.4 血液生化检查
采用全自动生化分析仪对感染后实验兔的血糖(GLU)、尿素(UREA)、肌酐(CREA)、血尿素氮/肌酐比(BUN/CREA)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLOB)、白蛋白/球蛋白比(ALB/GLOB)、丙氨酸转氨酶(ALT)、碱性磷酸酶(ALKP)各项血液生化项目进行检查。
1.5 巢式PCR检测方法的建立
1.5.1 卵囊收集 将含有白色结节病灶的肝脏剪成小块并置于搅拌机中搅拌均匀,加入5倍0.25%胰蛋白酶,置于37 ℃振荡器150 r/min振荡1 h,消化后肝脏组织分别用1层、2层和4层纱布进行多次过滤,滤液用饱和盐水漂浮法收集卵囊。以鸡柔嫩艾美耳球虫(E.tenella)、兔巨型艾美耳球虫(E.maxima)和兔大型艾美耳球虫(E.magna)为阴性对照,双蒸水为空白对照。
1.5.2 DNA提取与质粒构建 将1×106个卵囊和2 000个卵囊分别置于含磁珠的振荡器振荡20 min,然后按照植物基因组DNA快速抽提试剂盒说明提取DNA,-20 ℃保存。将2 000个E.stiedai卵囊的DNA稀释成1个、5个、10个、25个和50个卵囊的DNA模板。E.stiedai的重组质粒构建于前期实验,拷贝数为1.41×1013,质粒梯度稀释后用于敏感性和重复性实验。
1.5.3 巢式PCR方法的建立 根据E.stiedai的ITS1基因序列,用软件Premier 5.0设计第一轮PCR的引物,正向引物序列为5'-TTGGGTGGGTTTTCTGTGCC-3',反向引物序列为5'-CGCGAGCCAAGACATCCATT-3'。配制25 µL的反应体系:上下游引物(10 µmol/L)、DNA 模板和dNTP(10 mmol/L)均是0.5 µL,Taq buffer(10×)2.5 µL,Taq DNA 聚合酶(5 U/µL)0.2 µL,MgCl2(25 mmol/L)2 µL,不足部分用双蒸水补充。反应程序:95℃预变性3 min;95℃变性30s,57 ℃退火30 s,72 ℃延伸30 s,连续30个循环;72 ℃修复延伸8 min。
第二轮PCR引物的正向序列为5'-GGTTCGGTCACCTCTGCATT-3',反向序列为5'-CAGCACCATCATCCACAGGA-3'。配制25 µL的反应体系:以第一轮106倍稀释质粒的PCR产物为模板,进行再次梯度稀释,其余成分的加入量与第一轮反应体系相同,不足部分用双蒸水补充。退火温度提高至60℃,连续25个循环,反应程序与第一轮扩增相同。用1.5%琼脂糖凝胶电泳检测PCR产物。运用Image-pro Plus 6.0软件对组内3次重复性实验结果进行半定量分析。
2 结果
2.1 临床剖检
实验组兔食欲降低,腹围明显增大(图1A)。解剖后见肝脏肿大明显,肝脏表面和实质布满白色和淡黄色结节,胆囊和胆管肿大,胆汁呈淡绿色,感染严重的病兔胆汁呈淡黄色(图 1B)。
2.2 血液生化检查
GLOB含量偏高, CREA和ALKP含量偏低(表1),其余检测指标均在全自动生化分析仪提供的兔血液生化检查参考值范围内。

图 1 斯氏艾美耳球虫感染兔的临床剖检Figure 1 Clinical biopsy of Eimeria stiedai infected rabbits
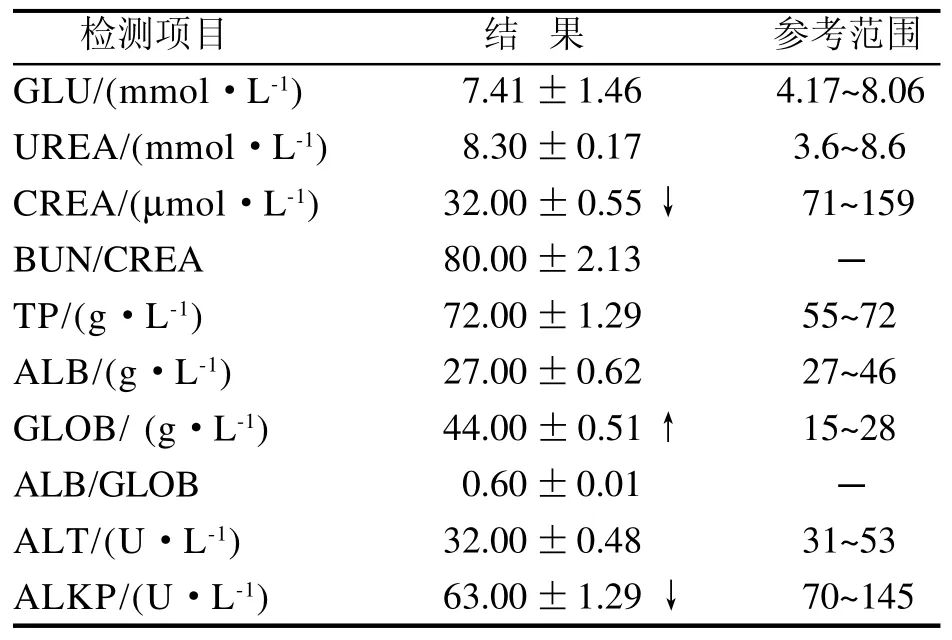
表 1 斯氏艾美耳球虫感染的兔血液生化检测Table 1 Blood biochemistry of Eimeria stiedai infected rabbits
2.3 显微镜观察
E.stiedai呈长椭圆形,借助于显微镜及其计算机辅助系统对虫卵形态特征进行观察鉴定。取肝脏结节和胆管上皮进行压片镜检,可见大量未孢子化E.stiedai虫卵,未孢子化卵囊大小为36.26µm×19.73 µm(图2A)。将卵囊进行分离培养,镜下孢子化卵囊大小为34.35 µm×18.32µm,卵囊内孢子囊呈卵圆形,有斯氏体(图2B)。
2.4 病理组织学检查
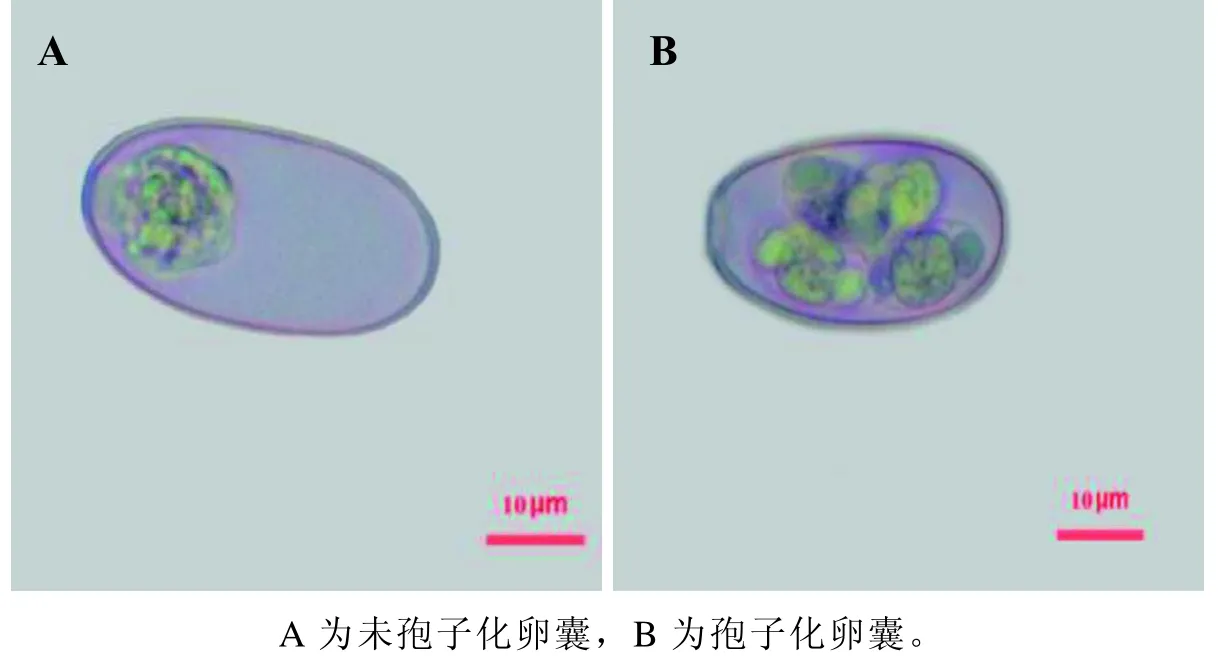
图 2 斯氏艾美耳球虫感染兔卵囊的显微镜观察(×400)Figure 2 Microscopic observation on oocyst of Eimeria stiedai infected rabbits (×400)
HE组织染色结果显示,健康肝组织细胞排列紧密,未见E.stiedai虫卵(图3A)。实验兔肝组织HE染色后,镜下可见肝脏组织结节含大量E.stiedai虫卵,虫卵在10倍目镜下呈空泡样(图3B)。肝胆管上皮增生,组织内出现大量被切成纵横等不同断面的兔E.stiedai虫卵(图3C)。40倍目镜下,可见胆管内虫卵呈椭圆形,粉红色(图3D)。
2.5 巢式PCR检测方法
建立的E. stiedai巢式PCR检测方法可扩增出特异性片段,最低检测限为1个卵囊DNA样本,重组质粒最低检测限为1010倍稀释的质粒,拷贝数为1.14×103。以E.maxima、E.magna、E.tenella的DNA样本为阴性对照组,以双蒸水为空白对照组,两组均未扩增出条带(图4)。分析组内3次重复性实验结果表明,变异性系数<5%,重复性较好(表2)。
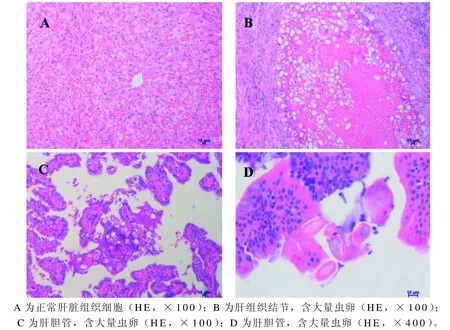
图 3 斯氏艾美耳球虫感染兔肝组织病理学检查Figure 3 Pathological observation on the liver of Eimeria stiedai infected rabbits

图 4 巢式PCR检测斯氏艾美耳球虫卵囊DNAFigure 4 Detection of oocyst DNA of Eimeria stiedai by nested PCR
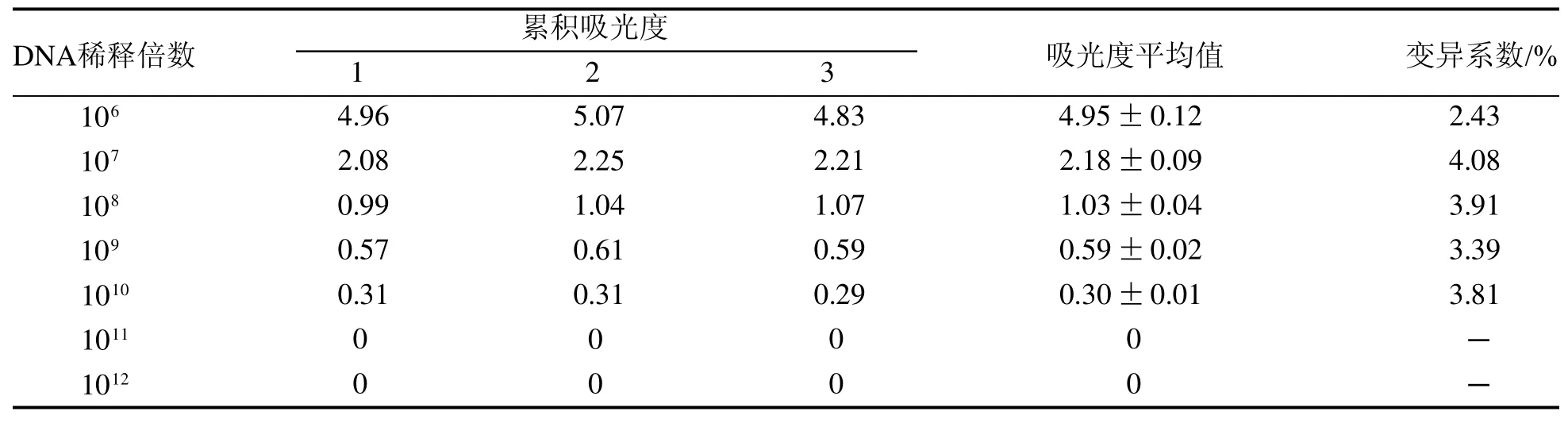
表 2 巢式PCR组内重复性实验Table 2 Intra-group repeatability test of nested PCR
3 讨论
实验兔在医学、生命科学等领域发挥重要作用,已广泛应用于肝癌、肝移植、脂肪肝、肝硬化等相关基础研究[4-6]。兔球虫病危害较大,耐过球虫病的实验兔肝损伤难以修复,并将长期携带虫卵,成为隐性传染源。本实验通过解剖感染E.stiedai的实验兔发现,与健康肝组织相比,实验组肝脏肿大1.5~2倍,肝质量增加4~5倍,肝脏表面和实质布满结节和少量钙化灶;镜下病理切片可见大量粉红色的虫卵,形状和大小与E.stiedai相符,初步鉴定建模成功。
GLOB是机体抵抗病毒、寄生虫等病原入侵的重要指标,它可反映肝脏的病变程度[7]。本实验对感染E.stiedai的新西兰兔进行血液生化检查发现,GLOB含量显著上升,辅助验证了E.stiedai成功感染。CREA和ALKP指标偏低可能与球虫感染后引起的贫血有关系。肝脏是代谢过程中的一个重要器官,ALT是反映肝细胞受损的灵敏指标。本实验未见ALT升高,可能是与感染后肝衰竭,正常细胞减少,导致释放到血液中的转氨酶减少有关。
兔球虫种类有11种,以混合感染为主,在兔粪样中经常可以检测到肠型和肝型球虫卵囊。目前,主要通过显微镜观察孢子化后卵囊的形态进行鉴定,该方法的准确性有待提高。PCR技术已广泛应用于兔球虫的检测。温福利等[8]建立了E.stiedai的荧光定量PCR检测方法。闫文朝等[9]克隆了E.stiedai完整的ITS1-5.8sRNA-ITS2基因序列,建立了PCR检测方法,最低检测限为50个卵囊的DNA。许家园等[10]对兔肠型艾美耳球虫(E.intestinalis)、黄艾美耳球虫(E.flavesce)、E.magna进行了ITS序列测定,结果表明ITS序列种内同源性高于种间同源性,可用于3种球虫的分子标志。梁子平等[11]根据兔球虫ITS1序列分别设计了针对11种兔艾美耳球虫的特异性引物,建立了兔艾美耳球虫多重PCR检测方法。宫鹏涛等[12]建立了用于11种兔艾美耳球虫的巢式PCR检测试剂盒。本研究通过建立的E.stiedai感染模型收集了足够卵囊,并根据ITS1序列设计了两对特异性引物,该方法的最低检测限为1个卵囊DNA样本,重组质粒最低检测限为1010倍稀释的质粒,说明该方法的灵敏度高。阴性对照和空白对照结果表明特异性较好,组内3次重复性实验的变异性系数<5%,说明重复性较好。后期将应用该方法对实验兔生产和使用单位进行E. stiedai检测。
本实验成功建立了兔E. stiedai巢式PCR检测方法,有助于进一步补充和完善E.stiedai的分子生物学检测方法,更好地保障实验兔的供应质量和相关科学实验结果的准确性。

