MiR-125b在甲状腺癌患者中的表达及其意义
姚彩云 冯 蕾 范震霆
甲状腺癌占内分泌恶性肿瘤的90%,严重危害患者的健康。近年来,虽然手术已成为治疗甲状腺癌的有效手段,但仍有患者反复发作[1]。微小RNA(miRNA)是长度约22 nt的内源性单链非编码RNA,其在细胞增殖、粘附和分化等多种生物过程中起重要作用。据估计,miRNAs可靶向超过1/3的人类基因[2]。越来越多的证据表明,大量miRNAs可能参与了癌症过程,一些miRNAs的过表达可能抑制肿瘤基因的表达,相反另一些miRNAs的下调则可能会导致肿瘤发展[3]。例如,miR-146、miR-221和miR-222在甲状腺肿瘤组织中表达增加11至19倍,与甲状腺外侵袭或癌症的发生有关[4]。 miR-218-2及其宿主基因SLIT3的下调可促进甲状腺癌的侵袭和进展[5]。之前的研究报道miR-125b可通过靶向PIK3CD来抑制甲状腺未分化癌细胞的迁移和侵袭[6]。然而,miR-125b与顺铂(用于治疗对放射性碘无反应的甲状腺癌)间的相互作用及机制还尚未完全阐明。本研究旨在探讨miR-125b在经超声诊断的甲状腺癌患者中的表达及其对甲状腺癌顺铂敏感性的影响及机制。
1 材料与方法
1.1 甲状腺癌组织采集
选取2017年7月至2019年2月陕西省康复医院病理科采集并保存的甲状腺乳头状癌组织及其配对的癌旁组织各20例。所有患者均经陕西省康复医院影像科二维超声多切面探查甲状腺病灶的部位、数目、大小、边界、内部回声、钙化、后方回声及颈部淋巴结肿大等情况,彩色多普勒超声观察肿瘤内部和周围血管分布。超声表现疑似甲状腺乳头状癌后,在超声引导下穿刺活检,经病理确诊。外科手术切除甲状腺癌组织及邻近的癌旁组织,送至病理科于-80 ℃储存至实时荧光定量PCR检测。
1.2 细胞培养及分组
人甲状腺乳头状癌细胞系MDA-T32购自美国ATCC公司,将细胞接种于含有10%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2饱和湿度环境中常规培养、传代。取对数生长期的细胞经消化后按5×103个细胞/孔的密度接种于6孔板,将细胞分为3组:对照组、阴性对照组和miR-125b组,每组各4孔。常规培养至细胞汇合度达到85%以上时,进行细胞转染。
1.3 细胞转染
对照组不处理,阴性对照组采用脂质体3000转染无义序列,miR-125b组采用脂质体3000转染miR-125b mimics,严格按照说明书操作。miR-125b mimic序列为:上游:5'-UCCCUGAGACCCUAACUUGUGA-3',下游:5'-ACAAGUUAGGGUCUCAGGGAUU-3'。miR-125b mimic序列由上海生工公司设计及合成,脂质体3000购自大连Takara公司。采用实时荧光定量PCR检测转染效果。
1.4 实时荧光定量PCR
采用RNeasy Mini试剂盒从组织样本及转染48 h后的细胞中提取总RNA,以RNA为模板采用NCode miRNA First-Stand cDNA Synthesis Kit试剂盒反转录合成第一链cDNA。实时荧光定量PCR扩增的反应体系(10 μl)为:1 μl cDNA、1 μl 2.5 μmol上下游引物混合物、5 μl SYBR Green qPCR SuperMix和3 μl双蒸水。根据2-△△Ct计算目的基因的相对表达量。U6为内参。
1.5 顺铂敏感性分析
采用MTT法检测各组细胞对顺铂的敏感性。将转染48 h后的细胞重新以5×103个细胞/孔的密度接种于96孔板中,每孔100 μl。设只含有培养基的空白对照。采用0、15、30、60、120 μg/ml 的顺铂干预48 h,换液,每孔加入30 μl MTT试剂,孵育4 h后弃去培养基,加入100 μl DMSO,在酶标仪上于570 nm处读取吸光值(A)。细胞活性(%)= (A测试孔-A空白孔)/ A空白孔×100%。
1.6 Western Blot
采用RIPA试剂从组织样本及转染48 h后的细胞中提取总RNA,蛋白定量用BCA试剂盒。将20 μg的总蛋白加入上样缓冲液中,用10% SDS-PAGE凝胶分离总蛋白,之后将总蛋白转染至PVDF膜上,用5%胎牛血清封闭45 min,孵育一抗,4 ℃孵育过夜,孵育二抗,室温摇床孵育1 h,采用电化学发光试剂ECL于暗室发光。用Image J软件统计分析目的条带。内参为GAPDH。
1.7 统计学分析
2 结果
2.1 MiR-125b在甲状腺癌组织及甲状腺癌细胞系中的表达
与癌旁组织[(0.81±0.13)%]对比,甲状腺癌组织中miR-125b mRNA的表达[(0.35±0.07)%]显著降低(t=13.722,P<0.05)。与对照组[(0.65±0.11)%]相比,miR-125b组细胞中miR-125b mRNA的表达[(1.49±0.24)%]显著增加(t=29.557,P<0.05),阴性对照组miR-125b mRNA的表达[(0.68±0.15)%]无显著变化。
2.2 MiR-125b对甲状腺癌中Foxp3的影响
应用Targetscan软件(www.targetscan.org/vert_72/)预测,发现miR-125b可与Foxp3 3’UTR的519-525位点结合。如表1所示,与癌旁组织对比,甲状腺癌组织中Foxp3蛋白表达显著增加(P<0.05)。与对照组相比,miR-125b组细胞中Foxp3蛋白表达显著降低(P<0.05),阴性对照组Foxp3蛋白表达无显著变化(P>0.05)。

表1 各组Foxp3蛋白表达的对比
2.3 MiR-125b过表达对甲状腺癌顺铂敏感性的影响
如图1所示,与对照组相比,在顺铂浓度为30 μg/ml时,miR-125b组细胞活性显著降低(P<0.05)。在顺铂浓度为0、15、60、120 μg/ml时,各组间细胞活性的对比无显著差异。
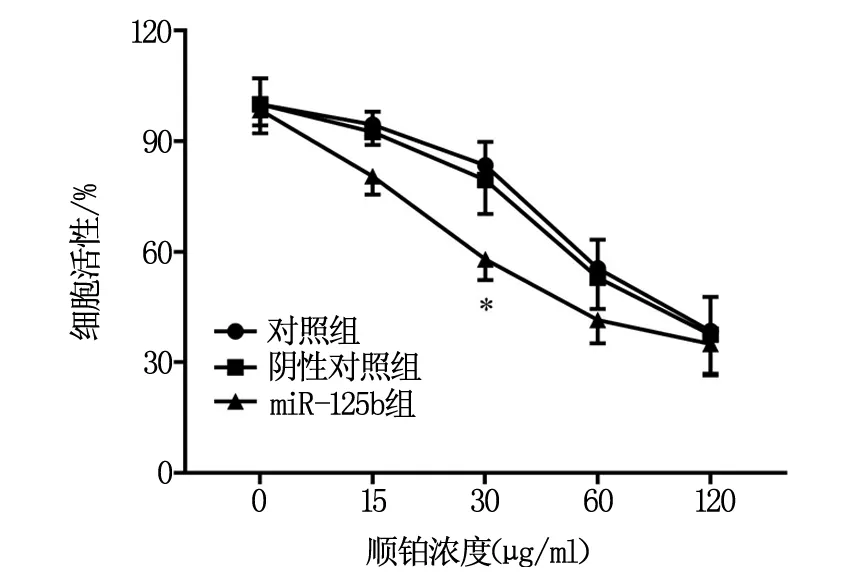
图1 各组细胞对顺铂的敏感性对比
2.4 MiR-125b对甲状腺癌中自噬的影响
如表2所示,与癌旁组织对比,甲状腺癌组织中LC 3I蛋白的表达无显著变化,而LC 3II蛋白的表达显著增加(P<0.05)。与对照组相比,miR-125b组细胞中LC 3II蛋白的表达显著降低(P<0.05),阴性对照组LC 3II蛋白的表达无显著变化。各组细胞中LC 3I蛋白的表达对比无显著差异(P>0.05)。

表2 各组织中LC 3Ⅰ和LC 3Ⅱ蛋白表达比较
3 讨论
miR-125b首次是在急性淋巴细胞白血病和骨髓增生异常中发现的,在细胞分化、增殖和凋亡中起重要作用。Klusmann等发现miR-125b可以降低MUC1癌蛋白的表达,促进白血病中DNA损伤剂诱导的细胞凋亡[7],提示miR-125b可能作为肿瘤抑制性miRNA发挥作用。研究表明,由于miR-125b下调可促进肿瘤细胞的迁移和增殖,因此其也可作为胆囊癌和结直肠癌的肿瘤抑制因子[8-9]。仅有少量几篇关于miR-125b和甲状腺癌的报道,大都是在甲状腺未分化癌(ATC)中,虽然我们没有ATC的甲状腺组织样本来证实这一发现(一部分原因是因为ATC是罕见肿瘤,另一部分原因是因为ATC通常不能手术,因此很少被切除),但这些报道均显示miR-125b在ATC中表达降低[10]。而本研究在甲状腺乳头状癌组织中也得到了类似的结果,与癌旁组织对比,甲状腺癌组织中miR-125b mRNA的表达显著降低,表明miR-125b在甲状腺乳头状癌中可能起肿瘤抑制因子的作用。
越来越多的研究表明Foxp3是调节性T细胞的典型生物标志物,可在包括甲状腺癌细胞等多种实体肿瘤细胞中表达[11]。但是诱导癌细胞中Foxp3表达的机制仍然未能彻底阐明。本研究中,我们通过对比Foxp3蛋白在甲状腺癌组织及癌旁组织中的表达发现,与癌旁组织对比,甲状腺癌组织中Foxp3蛋白的表达显著增加,提示Foxp3蛋白在甲状腺乳头状癌中可能是肿瘤促进蛋白,似乎与miR-125b的作用相反。因此我们推测miR-125b可能直接靶向Foxp3基因并调控其表达,为了验证这一推测,首先我们采用生物信息学Targetscan软件预测发现miR-125b可与Foxp3 3’UTR的519-525位点结合。接下来我们将miR-125b mimics转染入人甲状腺乳头状癌细胞系中,检测miR-125b过表达对Foxp3蛋白的影响,结果显示,与对照组相比,miR-125b组细胞中Foxp3蛋白的表达显著降低,结合生物信息学的结果预测可证实我们之前的推测,miR-125b可直接靶向Foxp3 3’UTR的519-525位点结合,并抑制Foxp3蛋白的表达。
近期的研究表明Foxp3与膀胱癌的顺铂耐药有关[12]。为了确定在甲状腺癌中miR-125b下调和Foxp3上调的治疗意义,首先,我们进行了miR-125b对甲状腺癌细胞顺铂敏感性的实验。细胞增殖结果显示,与对照组相比,在顺铂浓度为30 μg/ml时,miR-125b组细胞活性显著降低。而在顺铂浓度为0、15、60、120 μg/ml时,各组间细胞活性的对比无显著差异。这些结果提示miR-125b过表达可显著增强化疗药顺铂在甲状腺癌细胞中的效力。其次,对于自噬的研究也显示,与癌旁组织对比,甲状腺癌组织中LC 3II蛋白的表达显著增加。与对照组相比,miR-125b组细胞中LC 3II蛋白的表达显著降低。LC 3II是哺乳动物自噬标记蛋白,是观察自噬激活公认的生物学标记物[13]。这些结果表明,在甲状腺癌组织中细胞自噬的活性增加,而miR-125b过表达可抑制甲状腺癌中自噬的激活。因此miR-125b抑制自噬活性可能是其增强甲状腺癌细胞对顺铂敏感性的原因之一。自噬不仅参与维持细胞自我稳态,还与肿瘤的发生发展及肿瘤耐药密切相关[14]。研究表明,miR-9可通过抑制自噬增强非小细胞肺癌A549细胞对顺铂的敏感性[15]。因此miR-125b抑制自噬活性是其增加甲状腺癌细胞对顺铂敏感性的机制之一。
总之,本研究揭示了miR-125b在甲状腺癌中下调,miR-125b介导的Foxp3下调可抑制自噬,并增强甲状腺癌细胞对顺铂的敏感性,这表明miR-125b在甲状腺癌化疗中具有治疗意义。

