林木与病原菌分子互作机制研究进展
田呈明,王笑连, 余 璐,韩 珠
(北京林业大学林学院,省部共建森林培育与保护教育部重点实验室,北京 100083)
自植物出现在陆地上以来,微生物便作为重要的选择压力参与塑造植物的进化。对于植物-病原微生物来说,二者更是处于长期的“军备竞赛”状态,植物通过激活免疫系统来抑制和防卫病原菌,病原菌也不断发展出新的“武器”去反抑制或躲避植物的防卫反应。因此,植物-病原菌互相的选择压力也构成了所谓的植物-病原菌互作体系。基于基因对基因学说,早期的研究主要集中在植物抗病基因以及病原菌致病基因功能方面,不断揭示植物与病原菌互作过程中的关键分子及其信号通路,促进植物免疫与病原菌致病机理的研究越来越深入与清晰。进入21世纪以来,生物信息学及基因组学手段,VIGS/HIGS与CRISPR/Cas9等技术的不断革新和突破,为传统分子操作困难生物的互作研究提供了强大的工具,推进植物-病原菌互作的分子机制研究进入快速发展的黄金时期。与此同时,木本植物与病原菌的互作研究也逐渐发展起来,并不断有新的理论、新的方法和新的突破涌现。尤其从病原菌基因组学和转录组学分析、致病关键基因筛选与功能鉴定、效应蛋白作用机制、致病信号转导、次生代谢产物等方面揭示病原菌的致病机制,进而探索林木免疫受体作用机制、免疫信号转导、免疫与生长平衡机制、抗病基因的分离鉴定、RNAi (RNA interference)以及分子抗病育种等。笔者从植物-病原菌分子互作的现状出发,综述了国内外林木-病原菌分子互作机制研究的热点,并提出未来的发展趋势。
1 植物与病原菌互作研究的基本问题
植物与病原菌互作机制的研究非常广泛,尤其是真菌、细菌和卵菌等[1-3]病原菌与寄主植物互作研究已发展出许多模型和理论,阐释了植物-微生物互作过程中,植物如何通过免疫受体识别病原微生物进而诱发寄主的抗病反应,以及病原微生物利用效应蛋白来抑制寄主免疫反应以成功侵染寄主的分子机制(图1),逐步形成了新的植物-病原“分子互作”的概念[4]。
植物免疫机制研究的最终目的是应用于分子抗病育种。激活植物的免疫系统主要通过模式识别受体(pattern recognition receptors, PRRs)和抗病蛋白(resistance protein, R)等免疫受体完成。PRRs可直接识别病原菌分泌到胞外的病原相关分子模式(pathogen associated molecular patterns, PAMPs)或质外体效应蛋白 (apoplastic effector),进而激活病原相关分子模式触发式免疫(PAMPs triggered immunity, PTI)。 最近研究发现PRRs可通过招募多种多样的共受体 (coreceptor)来增强识别PAMPs的效率[5-7]。PRRs激发的PTI作为植物第1层免疫防卫反应,其强度较低,因此植物为了能够更加准确调控PRRs或PRRs的共受体,通过释放免疫原多肽物质——植物细胞激素(phytocytokines)来辅助调节免疫反应,从而使PTI反应更加精确[8]。由此可见,虽然植物不具备脊椎动物的获得性免疫(adaptive immunity),但其存在着精确高效的先天免疫机制。例如,一些植物共生菌也会刺激宿主的第1层免疫反应,类似于病原菌触发的PTI免疫反应[9]。当共生细菌存在时,植物会主动降低PRRs表达水平和MAMPs识别敏感度,从而使共生细菌达到适合的生存条件,使其充分发挥对宿主植物的有益作用[10]。植物抗病蛋白主要通过识别胞内效应蛋白(cytoplasmic effector)来激活效应蛋白触发式免疫(effector triggered immunity, ETI)。70%的R蛋白都是受体类蛋白 (nucleotide-binding domain and leucine-rich repeat receptors, NLRs)。除了少部分NLRs可直接与效应蛋白结合来激活免疫反应,大量的NLRs通过感知效应蛋白诱导的空间变化(steric alteration)或寄主蛋白翻译后修饰来激活ETI免疫。不仅PRRs具有共受体蛋白,NLRs同样能招募共受体(helper NLRs, hNLRs)来帮助识别效应蛋白[11-12],hNLRs还对下游抗病信号的传递起到关键作用[13]。同时强力的活性氧迸发(reactive oxygen species burst)、胼胝体沉积(callose deposition)、超敏坏死(hypersensitive resistance, HR),以及抗病基因表达等免疫反应均需要PRRs与NLRs的共同激活才能完成[14]。在应对病原菌侵入时,植物中PRRs与NLRs分化出相互协作的关系,未来如何更好地认识免疫受体将是植物抗病育种的重要一环。
植物免疫系统中关键抗病基因的克隆及其抗性机制的解析是抗病分子育种的重要基础。近年来已经有小麦抗条锈病(Pucciniastriiformis)基因YrU1[15]、玉米抗纹枯病(Rhizoctoniasolani)基因ZmFBL41[16]、小麦全生育期持久抗性的主效抗病基因Xa4、小麦主效抗赤霉病 (Fusariumgraminearum)基因Fhb7[17]以及多病害抗病基因NPR1[18]等数百个抗病基因不断在各种作物中被成功克隆。同时,植物分子抗病育种技术的发展也迎来了许多新技术与突破。诸如根癌农杆菌介导的Fast-TrACC(fast-treated agrobacterium coculture)技术可快速获得稳定遗传的转基因植物[19]。碳纳米管技术使得RNA可结合在纳米粒子上转入受体植物材料,从而利用SiRNA沉默目标基因[14]。高深宽比碳纳米管[high-aspect-ratio carbon nanotube (CNT) nanoparticles]技术,可将目标DNA导入大范围的植物中去,大大消除了寄主限制[20]。抗病育种领域虽利好消息不断,但仍面临广谱抗病基因抗性的持久性、抗性与产量之间的拮抗性制约。因此,除了寻找新的广谱抗病基因,协调植物生长、适应与抗病性的关系外,利用新型的转基因技术或者载体介导材料高效稳定地获取目标分子改造植株,是未来提高抗病育种快速性、简便性、革新性和灵活性的重要途径。
在病原菌中,由于效应蛋白既能被R蛋白识别触发植物免疫成为无毒基因(avirulence gene),也能通过修饰躲避识别成为毒性基因(virulence gene),使得效应蛋白成为病原菌致病的关键性武器和植物免疫的靶标。通常在获得微生物基因组或转录组后,使用生物信息学方法,根据效应蛋白的一般特征分析筛选获得候选效应蛋白,并通过试验手段加以证实[21]。效应蛋白作用方式主要包括:①抑制或躲避植物PTI或ETI。如LysM效应蛋白可通过结合几丁质寡糖来抑制几丁质触发的植物免疫[22-23]。水稻白叶枯病菌(Xanthomonasoryzae)的RXLR效应蛋白采用失活同源物来躲避寄主葡聚糖酶抑制剂蛋白的识别从而躲避PTI[24]。②抑制RNAi。病毒能通过产生病毒RNA沉默抑制剂(viral suppressors of RNA silencing,VSRs)来对抗植物的RNA沉默体系,细菌、真菌和卵菌也广泛利用效应蛋白来抑制寄主植物的RNA沉默体系以促进病原菌侵染[25-28]。③操纵植物微生物群落。一些病原菌效应蛋白具有植物性毒素和抗菌活性,既影响宿主植物也干扰微生物群落[29];另外一些效应蛋白高度特异,能通过靶向破坏植物相关进程,如通过局部养分剥夺,进而影响植物与有益微生物的正常互作关系;效应蛋白也可以招募微生物协同互作,以抵御竞争性微生物或直接帮助其定殖宿主植物[30]。
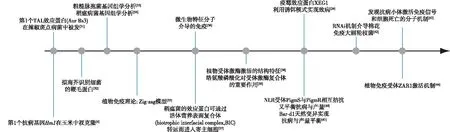
图1 植物-病原菌互作研究各个时期的重要进展Fig.1 The timeline of important advancements in the history of plant-pathogen interaction
2 林木与病原菌互作的分子机制
传统木本植物病害研究多集中在病原菌鉴定、检测,病害流行和防治等方面,其与病原菌之间相互作用的分子机制研究相对较少。然而,随着林木分子育种的不断发展,以及许多新兴技术的出现,近年来有关林木与病原菌互作分子机制的研究也取得了较为显著的进步,为林木病害防控提供了理论支撑。林木-病原菌互作的理论基础以及发展模式与作物(模式植物)-病原菌互作体系十分类似,但是林木与病原菌的互作机制方面还有种种壁垒需要突破。
2.1 病原菌侵染寄主的分子机制
病原菌侵染寄主的分子机制研究以致病关键基因克隆及其功能调控网络为核心。随着许多林木病原菌,尤其是胶孢炭疽菌(Colletotrichumgloeosporioides)、大丽轮枝菌(Verticilliumdahliae)、苹果腐烂病菌(Valsamali或Cytosporamali)以及核盘菌(Sclerotiniasclerotiorum)等病原真菌的遗传转化体系的成功建立,利用基因敲除与回补、突变体生物学表型分析等手段探究病原菌侵染结构发育与致病力相关的关键基因得以实现,尤其以丝裂原激活蛋白激酶MAPK(mitogen-activated protein kinase)信号通路以及转录因子的功能研究较为深入。附着胞是许多病原真菌的直接侵入结构,与致病性密切相关。在杨树炭疽病菌(C.gloeosporioides)中,敲除致病相关MAPK(pathogenic MAPKs)Mk1后突变体附着胞完全无法形成,导致致病力的丧失[45]。杉木炭疽病菌(C.gloeosporioides)在敲除细胞壁完整性相关的Slt2 MAPK中Mps1及其上游Mck1与Mkk1基因后,各突变体无法形成附着胞,导致致病力丧失[46]。
病原菌可以通过侵染结构直接侵入寄主,也能够产生水解酶类破坏寄主的组织,以及产生毒素等次生代谢物攻击宿主植物。例如病原菌Alternariaalternata可以产生寄主专化性毒素——ACT毒素改变寄主细胞膜通透性,引起电解质渗漏,也可作为效应蛋白诱导寄主发生脂质过氧化产生大量活性氧(reactive oxygen species , ROS)[47],并最终导致寄主细胞死亡[48]。这些毒素相关基因的缺失突变株均不合成ACT毒素,且致病力明显下降[49-51]。丁香假单胞杆菌猕猴桃致病变种(Pseudomonassyringaepv.actinidiae, Psa)通过积累菜豆毒素以减少精氨酸的合成,并最终致猕猴桃叶片出现感病症状[52-54]。
在林木病原菌中,对细胞壁水解酶组成的进化与功能研究取得了诸多进展。鳄梨炭疽病菌(C.gloeosporioides)果胶酸裂解酶基因pelB的缺失导致突变体果胶裂解酶和果胶酸裂解酶均显著减少,使其致病性降低[55-56]。杨树腐烂病菌(Cytosporachrysosperma)的草酸合成相关基因可能通过改变草酸的合成来影响病原菌的致病性[57]。苹果腐烂病菌(V.mali)在致病过程中通过分泌多种细胞壁水解酶来降解寄主细胞壁,促进其侵染。因此学者们在V.mali中开展了大量水解酶类的研究工作。例如,编码木聚糖酶基因Endo-β-1、4-xylanaseVmXyl1在V.mali致病过程中显著上调表达,并且苹果树枝提取物也可以刺激VmXyl1的表达,其敲除突变体中Endo-β-1、4-xylanase活性明显下降,致病性减弱[58]。在敲除VmVeA与VmVelB后,突变体致病性明显下降。此外,突变体中果胶酶相关基因表达明显下降,但是纤维素酶、半纤维素酶与木质酶相关基因的表达并没有受影响。说明VmVeA与VmVelB特异地影响突变体果胶酶产生,从而调控其致病性[59]。VmPmk1敲除后对于活性氧胁迫与细胞壁胁迫更加敏感,并且VmPmk1在调控致病性中发挥关键作用,在侵染过程中,许多编码细胞壁降解酶基因的表达量在VmPmk1突变体中明显下降,包括果胶酶(pectinase genes)、半纤维素酶(hemi-cellulase genes)与纤维素酶(cellulase genes)。利用免疫金沉淀进一步证实了VmPmk1突变体在侵染苹果枝条时对果胶的降解能力出现明显下降,说明病原真菌细胞壁降解能力在其致病中的关键作用[60]。V.mali侵染能够造成韧皮部组织坏死水解,虽然木质部也被侵染,但是并没有腐烂,说明V.mali很可能针对不同部位分泌不同的细胞壁降解酶。在许多子囊病原菌中,铜离子自由基氧化酶家族是一类重要的木质素降解酶家族。但是在Valsamali与V.pyri中没有出现此类家族基因,且编码纤维素酶与半纤维素酶的基因数量与作物病原菌如Magnaportheoryzae、Colletotrichumgraminicola相比出现明显地减少。因此,V.mali与V.pyri虽然能够侵染到苹果和梨树的木质部,但是由于其缺乏相应的木质素降解酶,导致无法降解木质部。同时,由于主要从伤口侵入,其编码角质酶基因的数量相较于需要直接穿透叶片角质层病原菌也明显下降。V.mali在侵染过程中编码果胶酶的基因出现了大量的上调表达[61]。
2.2 病原菌活性氧解毒的分子机制
林木的过敏性坏死(hypeisensitive response,HR)可有效抵御腐生菌及活体营养型病原菌定殖,但却有助于死体营养型真菌的生存。死体营养型病原真菌链格孢(A.alternata)进化出由多通路协作实现对寄主ROS的解毒机制,其中关键的组分包括转录因子AaAP1,信号转导基因AaHOG1、AaSKN7、AaHSK1,及NADPH 氧化酶(Nox)、非核糖体多肽合成酶(NPS) 与谷胱甘肽过氧化物酶(GSH-Px)的多基因级联等。在外界刺激下,细胞质膜蛋白Nox产生的H2O2成为ROS 解毒系统的核心。首先,Nox可以通过诱导YAP1半胱氨酸残基之间二硫键的形成从而引起其蛋白构相改变,进而激活YAP1。另一方面Nox通过磷酸化激活SKN7及SSK1等转录因子,这些转录因子继而调控HOG1。激活后的YAP1与HOG1在细胞核内调控大量ROS相关基因的表达,实现对寄主ROS的解毒。例如通过诱导铁载体的生物合成,将铁匮乏条件下摄取的足量铁贡献给抗氧化酶CAT、SOD,进而通过酶解机制介导ROS解毒;或通过GPx3的激活诱导GSH-Px合成,酶解还原“毒性”ROS为无毒羟基化合物。SKN7可能通过与YAP1及其他因子互作继而参与非铁载体介导的铁吸收系统,调控 CAT、SOD活性解毒ROS,但SKN7和SSK1在ROS解毒方面不依赖HSK1调控,其具体的上游元件仍未知[62-68]。此外,在杨树炭疽病菌中,转录因子CgAp1调控氧化胁迫应答以及侵入过程中ROS的清除,小G蛋白CgCdc42同样调控侵入过程中寄主ROS的清除,其均对致病性起了重要调控作用[69-70]。在杧果炭疽菌(C.gloeosporioides)中,漆酶LAC1在其侵染杧果过程中表达量提高,促进了杧果胶孢炭疽菌的致病力[71]。在黄栌枯萎病菌(V.dahliae)中,转录因子VdAtf1、VdYap1以及VdSkn7在活性氮胁迫响应中发挥不同的功能,并且对其微菌核的形成以及致病力发挥了关键作用[72]。因此,研究林木病原菌对寄主ROS拮抗的相关基因功能是解析林木病原菌致病机制的重要途径之一。
2.3 病原菌效应蛋白
病原菌为了成功侵入并定殖于寄主植物,通过分泌效应蛋白作为入侵的“武器”。已知的林木病原菌效应蛋白的作用机制主要有:①躲避寄主免疫识别;②调控寄主植物基因的转录;③与寄主靶标蛋白互作;④对靶向寄主R基因进行免疫调节;⑤靶向操纵寄主激素信号;⑥靶向操纵宿主蛋白质。效应蛋白作为植物病理学研究热点之一,近年来在林木病原细菌、卵菌以及真菌中取得了一些重要进展。
近年来Guillen等[73-74]通过杨树基因组、锈菌基因组和转录组的生物信息学分析预测了杨树-栅锈菌候选效应蛋白,并在细菌与卵菌侵染拟南芥过程中表达候选效应蛋白,通过观察其促进病原菌侵染与否来判断效应蛋白研究是否作为候选激发子。刘霞等[75]构建了山田胶锈菌(Gymnosporangiumyamadae)和亚洲胶锈菌(G.asiaticm)的吸器获取技术体系,并通过转录组测序预测了候选效应蛋白[76]。橡胶树白粉病菌(OidiumheveaeB.A.Steinmann)基因组分析预测了141个经典分泌型效应蛋白及非经典型效应蛋白,其中对1个非经典型效应蛋白OH_0367的表达分析发现,其在白粉菌侵染阶段上调表达,并且可以抑制植物水杨酸的合成从而促进病原菌致病[77]。综上所述,效应蛋白研究是深入理解植物-病原菌互作的重要切入点,但是相较于有关卵菌、稻瘟菌、镰刀菌、黑粉菌等农作物病原菌较为深入的研究,林木病原真菌的效应蛋白研究还处于起步阶段。
3 林木-病原菌基因组与转录组学
寄主与病原菌在长期的互作与进化过程中,在分子水平形成了复杂的互作网络,单个基因功能的研究不足以全面揭示二者互作的分子机制。基因组与转录组数据分析对于研究寄主与病原菌的互作关系十分必要。目前大量树种,包括巨桉(Eucalyptusgrandis)、橄榄(Oleaeuropaea)、板栗(Castaneamollissima)、黑松(Pinuscontorta)、马尾松(Pinusmassoniana)、白蜡树(Fraxinusspp.)、橡胶树(Heveabrasiliensis)、茶树(Camelliasinesis)、杨梅(Myricarubra)、山苍子(Litseacubeba)、毛果杨(Populustrichocarpa)等已经完成了全基因组测序[78-79],为许多重要林木的组学研究提供了基础条件。如毛果杨表面受体多基因家族LRR-RLPs与杨树中小分子未知功能类蛋白SPUFs出现频繁的关联性,转录组学数据显示1对LRR-RLPs和SPUFs蛋白在杨树伤口反应中同步表达,并且两个基因在启动子区域存在约300个氨基酸长度序列的同源性,为杨树免疫过程中配体-受体成对调控的研究提供了新的思路[80]。部分林木病原菌的效应蛋白被预测,如对山田胶锈菌和亚州胶锈菌的比较转录组学分析,最终分别预测34个和7个候选效应蛋白[81]。挪威云杉[Piceaabies(L.) Karst.]根腐病菌(Heterobasidionparviporum)15个菌株的比较基因组学分析预测了病原菌致病相关基因及候选效应蛋白[82]。对杨树黑斑病发病区域的杨树无性系NL895进行混合转录组测序,分析得到杨树-黑斑病菌互作相关的768个病原真菌基因以及54个杨树基因。这些基因间的关系可以分为3类:真菌单基因与杨树多个基因具有关联性;杨树单基因与真菌多个基因具有关联性;其他相关关联性较低基因。其中真菌金属蛋白酶M6-08342与10个杨树基因具有明显关联性,并包含两个抗病相关基因[83]。对苹果白粉病菌(Podosphaeraleucotricha)不同侵染时期的叶片中与植物激素相关的信号通路及植物真菌互作相关基因的表达模式进行了分析,筛选获得了部分苹果抗白粉病的候选基因[84]。在茶白星病侵染茶叶过程中,利用转录组学分析得到2 180条差异表达基因,并且鉴定了部分关键上调表达基因,如细胞色素基因P450、Hsp90.1、Hsp70及TT4等基因[85]。基于全基因组序列对核桃细菌性黑斑病菌(Xanthomonascampestrispv.juglandis)7个菌株进行分析,预测得到520个分泌蛋白,有效地缩小了对其外泌蛋白的研究范围[86]。马文博等[87]对引起柑橘黄龙病的韧皮杆菌属(CandidatusLiberibacter)的36个菌株的基因组进行了分析,揭示了各个菌株间的系统发育以及致病力分化关系,并且预测了包括Sec转位通道(Sec translocon)依赖的关键毒力相关效应蛋白。基因组与转录组学研究不仅可以分析林木-病原菌互作过程的关键基因,同时还能对同属间各病原菌致病力分化进行分析。
4 林木免疫分子机制
4.1 林木识别病原菌及信号转导机制
林木依赖先天免疫系统识别 “异己”(non-self),发起对入侵生物的攻击指令,包括林木对保守的病原菌相关分子模式(PAMPs)的识别和林木免疫受体对病原菌效应蛋白的识别。
林木通过细胞表面的PRRs对保守的PAMPs进行识别,进而激活PTI免疫[88]。不同基因型柑橘对溃疡病菌(Xanthomonascitrissp. Xcc)的免疫反应与病原分子模式(PAMP: flg22)相关。在Xflg22识别初期,抗病金桔(Fortunellamargarita)中各类防卫基因的表达有显著性的升高,而感病品种邓肯葡萄柚(Citrusparadisi)中该类基因没有被诱导表达,反映出Xflg22能够在抗性基因型柑橘品种中启动强力的PTI[89]。
植物中抗病基因(resistance gene,R gene)编码的抗病蛋白可识别效应蛋白,进而激活ETI 免疫。在苹果基因组中已经鉴定出868个R基因,这些基因对许多病原物有效,如抗苹果黑星病的Vf基因,它们编码的蛋白能识别病原效应蛋白并激活防御反应,表现为感染部位的局部过敏性坏死[90]。
MAPK级联在植物先天免疫应答不同生物胁迫中发挥着重要作用,是植物对病原物产生抗性的关键[91]。在林木中关于MAPK信号途径的研究虽不如模式植物中的透彻,但是相关工作也逐渐开展起来。柑橘CsMAP9-like蛋白在柑橘抵抗褐斑病中发挥了重要作用[92]。白粉菌侵染葡萄后,寄主VvMPK1和VvMPK10基因分别在病原菌侵染12和48 h后显著上调表达,而VvMPK9基因的表达量随着侵染时间的延长而增加,推测其与抗病有关[93-94]。
信号传递最终会作用于转录因子调控进而调控一系列转录过程。植物中的多个转录因子家族的众多成员参与了对生物、非生物胁迫的响应,目前发现与植物防卫反应有关的转录因子家族主要有ERF蛋白、NAC蛋白、WRKY蛋白和MYB蛋白等[95]。WRKY蛋白作为植物所特有的转录因子,是近年新发现的新型锌指结构转录调控因子,与部分病程相关基因(pathogenesis-related,PR)表达显著相关,在植物-病原菌互作中发挥重要作用[96-97]。小黑杨PsnWRKY70基因能响应叶枯病菌侵染。苹果MdWRKY33-1、MdWRKY40b基因的表达与病程相关基因MdPRs表达或抗性调控相关。湖北海棠MhWRKY1基因在调节水杨酸(SA)介导的系统获得性抗性(SAR)中起关键作用,导入该基因的苹果对白粉病的抗性增强[98-100]。柑橘CsBZIP40基因通过调节SA途径影响柑橘抗性,其表达水平与柑橘溃疡病的抗性呈正相关[101]。
泛素连接酶通过泛素化修饰调控靶蛋白的降解、转运和功能变化,是控制免疫信号转导的重要调控因子。我国学者发现了水稻和拟南芥的多个E3泛素连接酶在植物免疫调控中的功能和作用机理。在木本植物中,苹果BTB-BACK结构域的E3泛素连接酶蛋白POZ/BTB CONTAINING-PROTEIN 1(MdPOB1) 通过泛素化降解U-box结构域的E3泛素连接酶MdPUB29抑制苹果对B.dothidea的防御能力,但MdPUB29是苹果轮纹病抗性的正调控因子[102-106]。
4.2 林木病程相关蛋白对病原菌的防御机制
植物病程相关蛋白PRs 在健康的植物中不表达或者表达量很低,当受到病原物或其他刺激后会大量表达。PR蛋白有17个家族,且常表现为β-1、3-内葡聚糖酶、几丁质酶等多个家族共同作用,以限制病原菌的生长和蔓延。一些家族如PR-8 家族成员具有溶解酵素活性,直接作用于细菌;而防御素(PR-12)、抗菌肽(PR-13)、部分脂质转移蛋白(PR-14)、PR-1和类甜蛋白PR-5都有广谱抗细菌和真菌活性[107]。林木通过引入抗菌肽基因可有效控制病原菌侵入。如将人工合成抗菌肽Shiva A和天蚕抗菌肽Cecropin B基因同时引入锦橙(C.sinensis),得到的转基因植株对Xanthomonascitrisubsp.citriXcc的抗性显著提高。黑星病菌(Venturiainaequalis)能诱导苹果叶片中PR-2、PR-5和PR-8的表达发挥抗菌功能[90]。但是目前对PR蛋白在植物抗逆过程中的功能及其调控机制的了解还远远不够。
4.3 林木次生代谢产物介导的防御反应
林木防御反应相关的次生代谢产物植保素(Phytoalexin, PA)能有效地抵御各种生物胁迫。Wang等[108]发现耐病葡萄柚杂交种Jackson和感病葡萄柚Marsh在次生代谢上存在显著差异。其中除了萜烯合成酶相关基因(CiClev10014707,Ciclev10017785)在耐黄龙病的Jackson中下调表达外,涉及类萜生物合成的β-丙氨酸合酶(Ciclev10033766、Ciclev10033930、Ciclev10033377)、环阿屯醇合酶(Ciclev 10010416)和LIJ梨醇C合酶(Ciclev 10031967)均显著上调[108]。Zhong等[109]通过数字基因表达谱分析比较了接种黄龙病菌13周和26周的碰柑,发现参与类黄酮、苯丙素、木质素、类异戊二烯和生物碱代谢的次生代谢相关基因的表达大部分在接种黄龙病菌13周下调,但大多在接种黄龙病菌26周时上调。
4.4 林木分子抗病育种研究
目前许多植物抗病研究的重点集中在广谱抗病基因的鉴定,或者同时聚合多个抗病基因来达到扩展植物抗病谱的范围。由于林木培育周期长,多基因聚合抗病可能是防止抗病性丢失的重要方向。对于林木抗病育种,林木转基因技术也提供了良好的解决途径。在板栗疫病研究中,Charles Maynard团队成功开发了板栗的转化体系,并且鉴定了多个板栗抗疫病的候选基因[110-111]。板栗转基因植株表达草酸氧化酶OxO(oxalate oxidase)对板栗疫病具有良好抗性[112-113]。在转基因杂交杨树表达OxO可以提高杨树对病原真菌Septoriamusiva的抗性[114]。随着Cross kingdom micro RNA与寄主诱导的基因沉默技术(HIGS)的发展,为林木的抗病分子研究开拓了一条新的途径。众多研究表明HIGS对多种植物病原真菌Fusariumverticillioides、F.graminearum、F.oxysporum,以及Blumeriagraminis、Pucciniatriticina都有着很好的抑制效果[115-117]。在大丽轮枝菌中,VdH1基因缺失后突变体致病性显著下降,HIGS靶向植物病原真菌关键基因可有效提高棉花对于大丽轮枝菌的抗性[118]。同时棉花可通过miRNA来抑制大丽轮枝菌致病基因的表达,从而抑制病原菌侵入[119]。毛果杨和毛白杨处于干旱状态时miR472上调表达,在高盐分处理的胡杨中下调表达,表明miR472可能靶向杨树NBS-LRR的转录,从而提高了杨树抗病能力;同时当miR472过表达后对杨树腐烂病菌(C.chrysosperma)表现高度抗性[120]。苹果在抵御叶斑病真菌(Glomerellacingulata或Colletotrichumgloeosporioides)侵染时,Md-miR156ab和Md-miR395分别靶向转录因子MDWRKyn1和MDWRKY26,从而影响苹果对叶斑病的抗性[121]。Md-miRln20 通过抑制Md-TN1-GLS的表达调控苹果对G.cingulata的抗病性[122]。当然,HIGS技术还在发展完善的过程中,例如HIGS的靶标位点一般只是目标基因的小部分序列,容易造成同源非靶标基因的沉默。HIGS有一定的寄主-病原体系限制,不能保证其在各个系统中均有高效的沉默效率,也无法像基因敲除一样完全阻断目标基因的表达,而只能抑制其表达。目前HIGS还没有应用于林木抗病研究中,在林木-病原菌互作体系的应用难度或问题还有待探索和解决,但是基于microRNA以及HIGS技术,其所表现出的简便性与抗病潜力对于今后的林木分子抗病研究有重要意义。
在木本植物中,利用CRISPR技术体系的基因组定点编辑研究在杨树中率先开展。2015年,美国估治亚大学的Zhou等[123]首次利用CRISPR/Cas9系统,在毛白杨(Populustomentosa)中实现了木质素合成关键酶基因的定点编辑。紧接着,国内研究人员也实现了CRISPR/Cas9对毛白杨多个靶基因的敲除,并且获得多基因突变植株[124-125]。此外,国内外目前对茶树[Camelliasinensis(L.) O. Ktze.]、甜橙[Citrussinensis(L.) Osbeck]、苹果(Maluspumila)也实现了CRISPR/Cas9的靶向敲除突变[126-128]。但在真菌中,由于其同源重组率极低、高效遗传转化体系的缺乏、启动子和有效筛选标记的缺乏等原因, CRISPR/Cas9的应用还主要集中在酵母、霉菌、稻瘟菌、玉米黑粉菌、尖孢镰刀菌以及蕈菌等真菌中[129-132],并且在应用过程中出现的脱靶、编辑效率低以及突变体筛选工作量大等问题也亟待解决[133]。
因此,对于林木抗病分子育种还局限在传统抗病育种领域内,对于许多新兴方向和技术的突破和应用还十分欠缺,未来如何突破技术壁垒是推进林木抗病分子研究的关键。
5 林木与内生真菌、外生真菌互作研究热点
在自然界中,内生真菌及外生真菌如何与林木的免疫系统“和平共处”,其依赖的分子机制可以帮助人们从免疫水平揭开共生的分子机制,并为林木-病原菌互作研究提供新的方向或思路。
按照“内共生理论”,许多林木内生真菌可以产生与其宿主相同或相似的代谢产物。因此,从林木内生真菌中筛选和提取有宿主药理活性的物质,许多新型药物拓展研发途径,并成为重要的研究方向[134-135],也获得了很多内生菌资源[136-138],并筛选出了能高产紫杉烷类物质的菌种[139]。然而大量研究表明内生真菌还与林木抗病虫害相关。Arnold等[140]研究发现可可树(Theobromacacao)接种叶片优势内生真菌菌群可有效减少由棕榈疫霉(Phytophthorapalmivora)引起的危害。袁秀英等[141]开展了美洲黑杨杂种无性系NL-80351杨、美洲黑杨无性系和欧美杨休眠芽、叶片、树皮和枝条等组织内生真菌分离培养和鉴定工作,发现某些菌株对杨树烂皮病菌(Cytosporasp.)有一定的拮抗作用。Busby等[142]在控制实验中发现接种杨树叶片内生葡萄穗霉(Stachybotryssp.)、深绿木霉(Trichodermaatroviride)、黑细基格孢(Ulocladiumatrum)和狭截盘多毛孢(Truncatellaangustata)等菌株可增强毛果杨对杨栅锈菌的抗性,其抗病机制可能与内生菌诱导林木抗病相关基因的表达有关。
菌根真菌与植物会发生物种间的基因转移,从而促进演化历程。Wang等[143]对苔藓MACRO2基因进行了沉默及过表达,揭示了来自菌根类真菌的该基因影响了宿主的表观修饰与发育。菌根真菌与植物间基因转移很可能是陆生植物性状产生与演化的重要因素。在农作物与模式植物中,有关共生菌与植物之间适应性的分子机制,以及植物与病原菌、共生菌的免疫识别差异的机制均有大量研究[9, 144-145]。林木共生菌的研究主要集中在共生菌的次生代谢产物,及其对植物抗病性、胁迫抗性影响等领域,对于内生真菌、外生真菌与林木的分子互作机制研究还十分匮乏,而外生真菌与林木的互作在对大尺度景观以及生态系统的稳定性等具有很大的研究潜力。因此探索共生真菌与植物、林木之间互作分子机制,对揭示植物进化与适应性形成的分子基础具有重要意义。
6 结 语
自然界中植物与微生物、病原菌具有极为复杂的关系,许多植物-病原菌互作所涉及生理过程的分子机制尚有待探究。对于植物-微生物或者植物-病原菌的互作理论,普遍接受二者“军备竞赛”的关系,代表性互作模式都是基于“基因对基因”学说、“警戒”假说以及“诱饵”假说不断发展而来。例如近年一些科学家大胆引入中国传统哲学思想中的“阴阳”概念,来阐释二者协调发展而又相生相克的关系[146]。因此随着互作机制研究的不断深入,理论与假说不断完善和补充,许多哲学概念或者社会学理论也可以与互作模式理论结合起来。随着经济的飞速发展,生物及生态领域获得越来越多的关注和资源分配。相较于农作物领域对于经济的重要性,林业更偏重于其对于生态的重要性,相应地林业病害相较于农作物病害虽造成较少的经济损失,但其对于生态环境及绿色发展造成严重及深远的影响。笔者对林木-病原菌未来的研究方向展望如下:
1)应充分利用CRISPR/Cas 9等基因编辑技术的快速高效等优点,对林木与病原菌互作中的关键基因的功能进行解析。
2)目前基因组、转录组、蛋白组和代谢组的测序和分析手段日趋成熟,组学大数据的深度挖掘是未来林木与病原菌互作组学研究突破的关键。
3)林木的抗病育种受到其生长周期长、遗传操作困难等因素的限制,生产上缺少高效的转基因抗病材料,利用HIGS等新技术和分子操作工具将是解决林木抗病材料分子育种的关键。
林木病理学研究不仅要跟上植物学、微生物学领域互作研究的热点和前沿,林木-病原菌互作也需要根据实际需要探索特色研究方向。

