洪泽湖湿地植被类型对土壤有机碳粒径分布及微生物群落结构特征的影响
季 淮,韩建刚,李萍萍,朱咏莉,郭俨辉,郝达平,崔 皓
(1.南京林业大学生物与环境学院,江苏 南京 210037;2.淮阴工学院生命科学与食品工程学院,江苏 淮安 223003;3.南京林业大学,南方现代林业协同创新中心,江苏 南京 210037;4.江苏洪泽湖湿地生态系统国家定位观测研究站,江苏 洪泽 223100;5.江苏省水文水资源勘测局淮安分局,江苏 淮安 223005)
湿地生态系统是生态系统中重要组成部分,水陆交界的环境促进各种元素快速循环转化,尤其在全球碳循环中扮演重要角色[1-2]。湿地生态系统中土壤有机碳周转变化引发碳源/汇的改变进而对全球气候变化起重要影响[3],湿地植被类型对土壤有机碳周转与稳定的影响及其机制,已成为当前研究热点[4-5]。土壤物理组分因其在外界环境变化中响应明显,且在表征土壤有机碳原状结构方面具有优势,被很多学者应用于植被类型变化对土壤有机碳影响的研究中[6-7]。有研究发现,土壤小粒径组分对有机碳的物理保护程度高于大粒径土壤组分的,而土壤小粒径组分中有机碳的化学结构比大粒径土壤组分的稳定性更强[8];当植被类型改变时会导致各粒径组分土壤有机碳理化特征的变化[9-10]。另外,植被类型的变化同样影响土壤内微生物与环境间的物质和能量交换,而研究微生物与土壤粒径组分之间的关系,可以深入了解微生物在土壤有机碳变化过程中的作用。相关研究发现,不同粒径组分的化学组成与分解其中有机质的微生物群落结构表现出显著相关性[11],而微生物既为土壤粒径组分有机碳的聚合作用提供动力,又受土壤粒径组分大小影响[12]。随着高通量测序等基因技术在土壤微生物群落结构分析中的运用,土壤样品中微生物种群的差异可以进一步被揭示[13]。
目前,湿地自然植被与人工植被下各粒径组分土壤有机碳含量与土壤微生物群落结构的动态规律尚无定论[14]。洪泽湖是中国第四大淡水湖,淮河是其水量补给的主要来源[15]。洪泽湖与淮河交汇区位于暖温带与北亚热带的过渡地带,有着特定的水文状况和气候条件,这对该区域湿地土壤的有机碳含量和组成及微生物群落结构有一定影响。笔者研究该湿地不同植被覆盖下土壤有机碳物理组分与微生物群落结构的特征,分析植被覆盖与土壤有机碳组成、微生物群落结构的关系,为合理开发利用、恢复和保护湿地生态功能提供依据。
1 材料与方法
1.1 试验地概况
洪泽湖位于江苏省北部(118.453°~118.691°E,33.165°~33.187°N),区域为季风气候,日照率52%,年平均气温14.8 ℃,平均水温15.6 ℃,年降水量926.7 mm。冬夏两季水量变化大,变差系数达0.8。研究地点为洪泽湖河湖交汇区的淮河主河道入湖口,由于泥沙淤积,湖床不断淤积抬高,形成了大面积的滩涂湿地[16]。研究区域滩涂湿地的植被类型(图1),由自然覆被类型的湖草(Carexspp.)滩、芦苇(Phragmitescommunis)滩和人工柳树(Salix×jangsuensis‘799’)林、欧美杨(Populuseuramevicana‘I -214’)林组成,其中杨树、柳树为当地林场于1989—1991年将原来的自然覆被类型改造为模拟当地典型植被由湖向内陆进行正向演替的人工林。

图1 洪泽湖湿地植被类型下土壤的取样位置Fig.1 The sampling location under different vegetation types in Hongze Lake Wetland
1.2 土样采集与理化分析
于2018年12月25日(洪泽湖枯水期)进行采样,在研究区域建立3个样地,样地之间相距5 km,每个样地包括4种植被类型。每个植被类型均设大小为20 m×20 m 的样方,各个样方按照“S”形布点法,采用直径50 mm柱状土壤取样器收集表层(0~20 cm)土壤,将样本放入聚乙烯塑料袋中。取回的样本当天尽快带回实验室,将土壤样品置于 -80 ℃环境下保存。其后,各个样方的样本分别混合均匀,共得到12个样品。每个样品一部分用于化学指标测试和不同粒径土壤组分的分离,并于室内风干;还有一部分新鲜土壤保存于-80 ℃冰箱中用于土壤微生物DNA提取和微生物群落的测定。参照文献[7]进行土壤理化指标测定,土壤总氮(TN)采用半微量凯氏定氮法[GB 7173—1987土壤全氮测定法(半微量开氏法)]测定,土壤有机碳(SOC)采用重铬酸钾氧化-外加热法(GB 9834—1988土壤有机质测定法)测定;土壤pH采用电位法(HJ 962—2018土壤pH的测定电位法)测定;土壤电导率(EC)采用电极法(HJ 802—2016土壤电导率的测定电极法)测定;土壤含水量采用烘干法(NY/T52—1987土壤水分测定法)测定。
1.3 土壤粒径组分分离及粒径组分有机碳测定
不同粒径土壤颗粒有机碳组分的分离,采用Stemmer等[17]的粒径分离法。土壤粒径组分主要根据土壤粒径的大小按照< 2 μm、≥2~63 μm、≥63~200 μm、≥200~2 000 μm分组。称取20 g风干土装入100 mL干净的离心管中,加80 mL超纯水,充分混匀后静置2 min,设重复5组。采用超声波细胞粉碎仪将土壤不同粒径分离,仪器参数设定为:超声总时3 min,超声1 s,间歇2 s,功率为45 W。待设定好参数,将变幅杆探头(φ6)插入到悬浊液中,使探头低于液面2 cm进行工作。土壤超声粒径分离完成后,将悬浮液过 200 μm 筛,用超纯水冲洗留在筛面上的颗粒物,待过筛的冲洗液接近澄清,再将筛面上的土壤粒径组分(≥200~2 000 μm)反冲洗到 1 L 的烧杯中。将反冲洗液移入100 mL 干净离心管,离心转速设置1 500 r/min共离心5 min,得到的土壤颗粒即为土壤粒径≥200~2 000 μm 的组分。将刚过200 μm 筛面下的冲洗液继续过63 μm筛,重复冲洗、反冲洗和离心等3个步骤,即可得到土壤粒径 ≥63~200 μm 组分。再将刚过63 μm筛面下的冲洗液移入到100 mL 干净离心管,离心转速设置1 500 r/min离心5 min,离心得到的土壤颗粒即为土壤粒径≥2~63 μm的组分。将离心后的悬浮液移入到新的离心管中,离心转速设置5 000 r/min离心5 min,得到的土壤颗粒即为土壤粒径< 2 μm的组分。分离出的组分经过液氮冷冻干燥机冷冻贮存备用。土壤不同粒径组分有机碳的测定采用重铬酸钾滴定法(GB 9834—1988土壤有机质测定法)。
1.4 细菌 16S rRNA、真菌ITS rRNA基因测序
从冰箱中取出10 g土壤样品解冻,利用DNA提取试剂盒(D3096-01,Omega Inc.,USA)进行DNA提取。对16S RNA基因的V3-V4 高可变区片段和ITS rDNA基因序列的ITS1-ITS2片段进行 PCR扩增,引物序列分别为319F(5′-ACTCCTACGGGAGGCAGCAG-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)和fITS7(5′-GTGARTCATCGAATCTTTG-3′),ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。每个样本3个重复,同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测[18]。PCR产物送联川生物技术公司进行测序。
1.5 数据处理
采用Excel 2013、SPSS 20.0、R for Window 3.5.1、MEV 2.0、CANOCO 5.0软件进行数据处理和统计分析,采用单因素方差分析(One-way ANOVA)和多重比较(Duncan法,显著性水平设置为0.05)比较不同数据组间的差异,采用聚类分析方法对微生物种间关系进行分析,采用冗余分析方法(redundancy analysis,RDA) 对微生物门类的丰度与各粒径组分土壤有机碳分布及其他理化性质之间的关系进行分析。
2 结果与分析
2.1 不同植被类型土壤性质、有机碳含量及各粒径组分有机碳分布特征
经测定,洪泽湖湿地各植被类型下浅表层(0~10 cm)土壤基本理化性质见表1。杨树林和柳树林土壤总有机碳、总氮含量均显著高于湖草滩和芦苇滩的(P<0.05),杨树林和柳树林土壤含水率显著低于湖草滩的(P<0.05)。
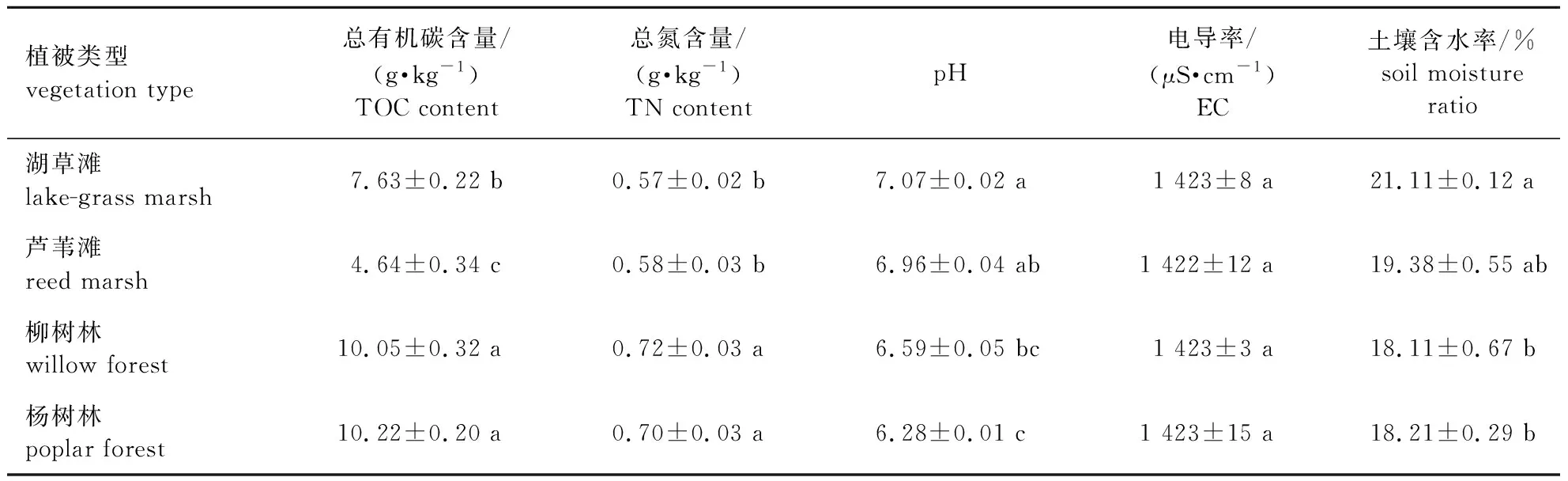
表1 洪泽湖湿地各植被类型下土壤(0~10 cm)理化性质
不同植被类型下的土壤粒径组分分布情况见表2。可以看出,各样地土壤粒径≥200~2 000 μm组分质量分布最少(2.40%~5.34%)。土壤粒径≥2~63 μm和≥63~200 μm组分质量分布(分别为30.07%~41.47%,24.95%~46.77%)显著高于其他粒径组分。芦苇滩土壤粒径<2 μm组分质量分布最少(15.64%), 但土壤粒径≥63~200 μm组分质量分布(46.77%)显著高于其他样地。总体上,各样地的土壤粒径质量分布的数值呈现两头小中间大趋势。
经测定发现(图2),除土壤粒径≥2~63 μm组分外,各植被类型下其他粒径组分的有机碳含量大小顺序基本为柳树林>杨树林>湖草滩>芦苇滩(图2A)。不同植被类型土壤总有机碳含量,杨树林的(10.22 g/kg)和柳树林的(10.05 g/kg)差异不显著,但显著高于湖草滩的(7.63 g/kg)和芦苇滩的(4.64 g/kg)(表1)。土壤粒径≥200~2 000 μm和<2 μm组分的有机碳含量(13.56~28.75 g/kg和11.46~25.84 g/kg)显著高于土壤粒径≥2~63 μm和≥63~200 μm的(3.12~6.00 g/kg和1.16~3.81 g/kg)。不同植被类型土壤粒径组分有机碳的分布比例见图2B,可以看出,粒径<2 μm组分土壤有机碳的分布比例(48.95%~57.95%)显著高于其他粒径组分的。粒径≥200~2 000 μm组分土壤有机碳的分布比例(8.76%~18.43%)低于其他粒径组分的。杨树林和柳树林中粒径<2 μm组分土壤有机碳分布比例均显著高于湖草滩和芦苇滩中的。总体来说,不同粒径组分中有机碳分布比例随粒径的增加而降低。

表2 洪泽湖湿地各植被类型的各土壤粒径组分质量分布
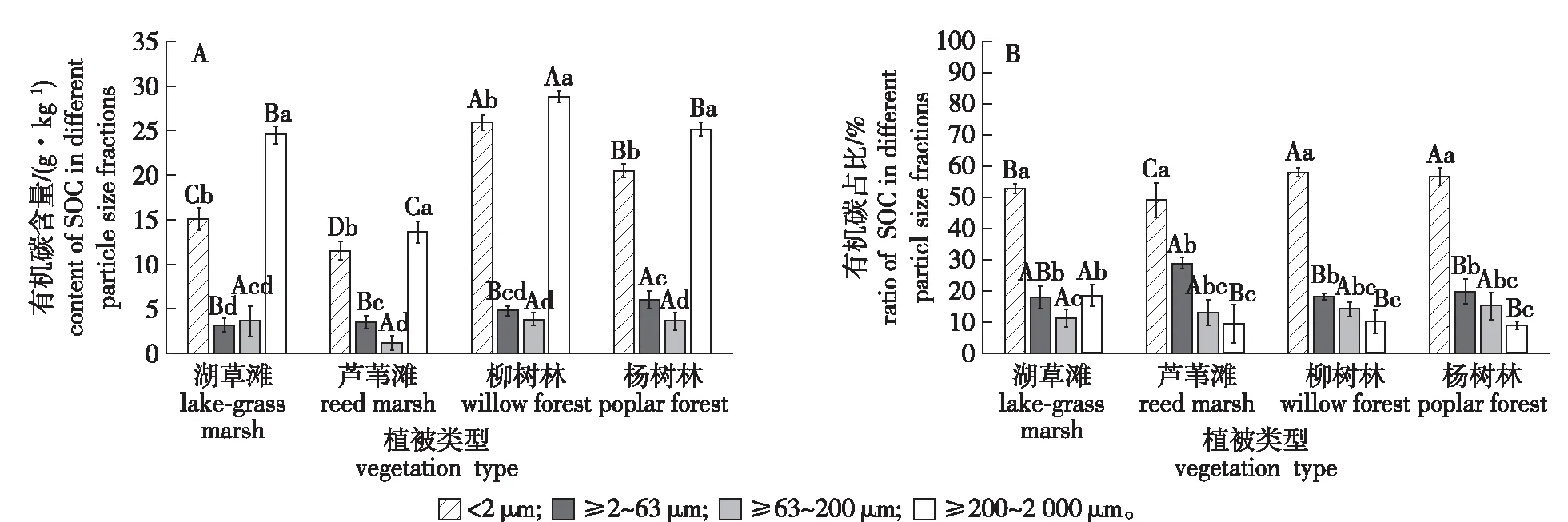
不同大写字母表示相同土壤粒径组分不同植被类型比较差异显著(P<0.05),不同小写字母表示相同植被类型下不同土壤粒径组分比较差异显著(P<0.05)。Different uppercase letters indicate significant differences among soil particle size fractions under different vegetation types (P<0.05), and different lowercase letters indicate significant differences among different soil particle size fractions under the same vegetation type (P<0.05).图2 洪泽湖湿地不同植被类型各粒径组分土壤有机碳含量和分布Fig.2 The content and distribution of soil organic carbon in different particle-size fractions under different vegetation types in Hongze Lake Wetland
2.2 不同植被类型土壤微生物群落结构特征
Alpha多样性可以表示样本中含有的物种数和物种多样性,其中,Observed species 指数表示样品中物种数量;Shannon 指数表示物种 Alpha多样性,Shannon 值越大,说明样本物种多样性越高;Chaol 指数用于估算样本中所含有的OTU 总数,反映了菌群丰度,Chaol越大说明物种越多。对不同植被类型测定发现(表3),湿地土壤细菌群落的Observed species、Shannon和 Chaol指数大小均为:芦苇滩>湖草滩>柳树林>杨树林。真菌群落中,湖草滩、芦苇滩的Observed species和 Chaol指数显著高于柳树林、杨树林的, Shannon指数大小为:芦苇滩>湖草滩>柳树林>杨树林。
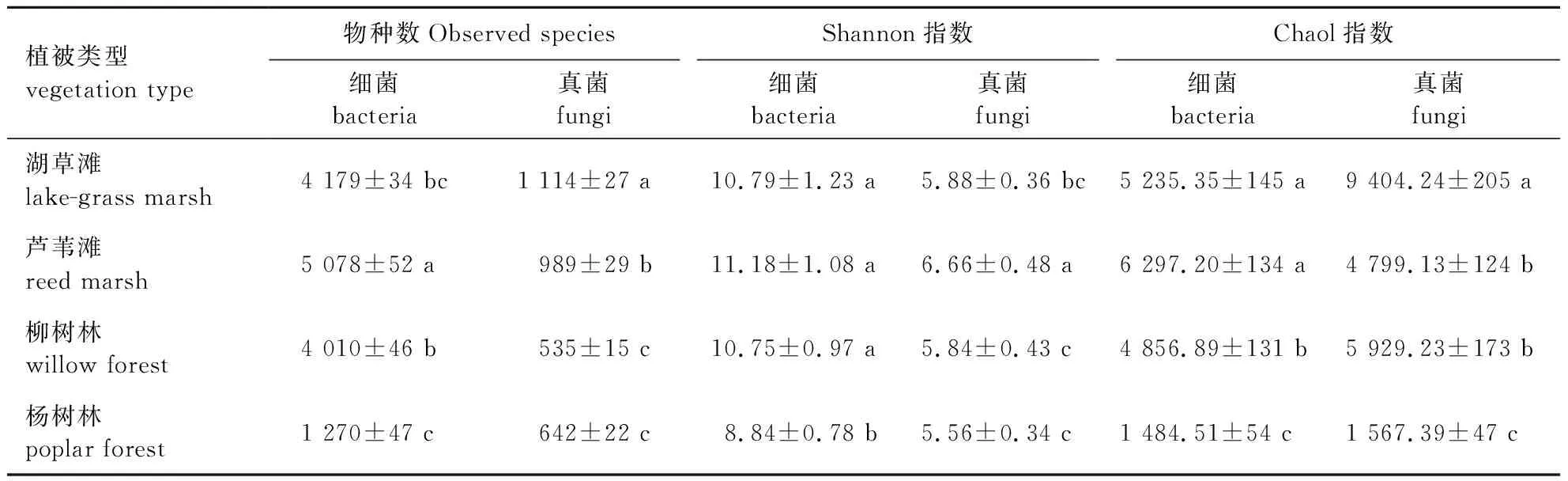
表3 洪泽湖湿地各植被类型土壤细菌/真菌Alpha多样性
经测定发现,4个样地土壤细菌分属48个菌门,在样品中所占比例大于1%的菌门共14个(图3A),除了杨树土壤样品,其他3个土壤样品中细菌的变形菌门(Proteobacteria)是优势门类(31.72%~52.11%)。杨树的酸杆菌门(Acidobacteria)在样品中占更大比例,并成为优势门(35.99%)。芦苇土壤样品的酸杆菌门(Acidobacteria)(9.81%)明显少于其他样地的酸杆菌门。4个样地土壤样品中真菌样品分属10个门,常见真菌门(在样品所占比例大于1%的真菌)共6个(图3B)。其中,子囊菌门(Ascomycota)为绝对优势菌群(55.00%~57.30%)。担子菌门(Basidiomycota)在湖草滩和芦苇滩土壤中相对丰度分别为11.00%、18.80%,在柳树林和杨树林土壤中相对丰度分别为40.2%、39.35%,沿湖面至坡地呈增大趋势。壶菌门(Chytridiomycota)在各植被类型的相对丰度依次为湖草滩(13.8%),芦苇滩(9.1%),柳树林(6.0%)和杨树林(0.2%),沿湖面至坡地呈现减少趋势。壶菌门沿生态演替的趋势从水到陆比例呈现从多到少的趋势(1.1%~13.8%)。
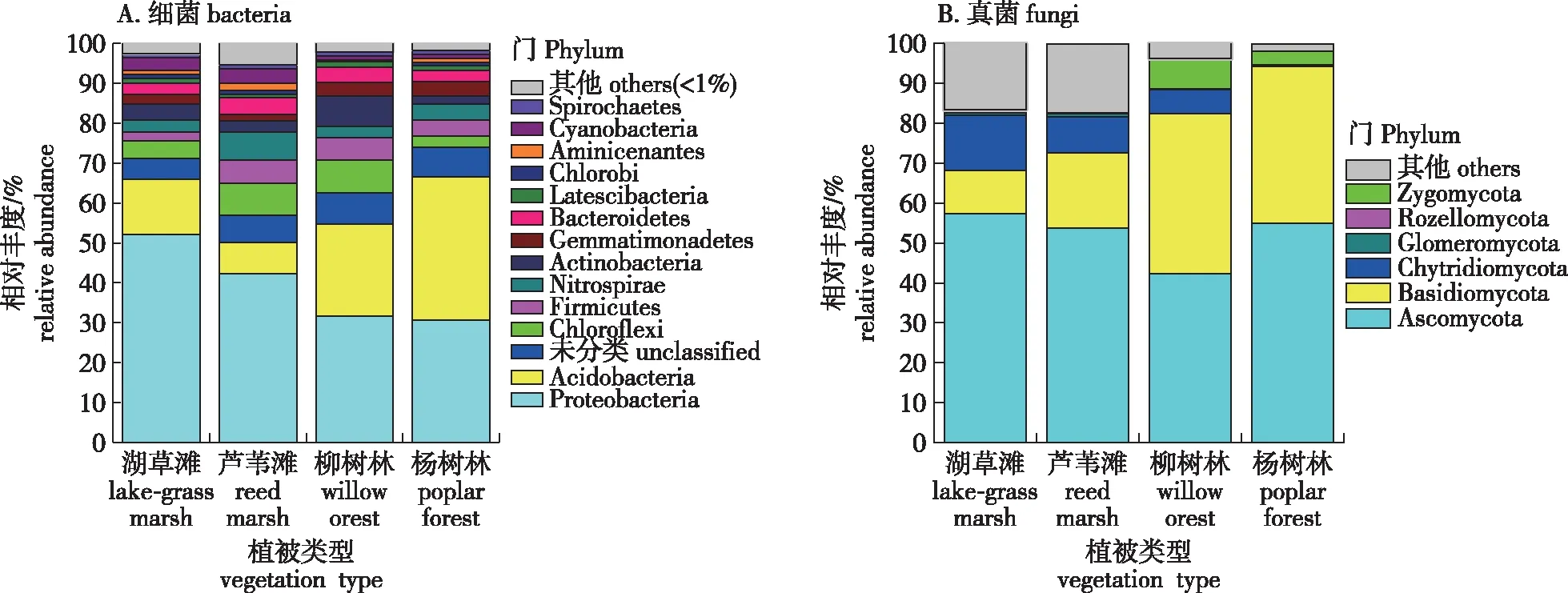
图3 洪泽湖湿地各植被类型土壤细菌/真菌群落门水平上的相对丰度Fig.3 The relative abundance of bacterial communities and fungal communities at Phylum levels underdifferent vegetation types in Hongze Lake Wetland
根据细菌、真菌样本的菌门相对丰度表,将各分类水平相对丰度(>1%)的群落组成数据根据分类单元的丰度分布或样本间的相似程度加以聚类,根据聚类结果对分类单元和样本分别排序,并通过热图加以呈现。通过聚类,可以将高丰度和低丰度的分类单元加以区分,并以颜色梯度及相似程度来反映多个样品在各分类水平上组成的相似性和差异性,结果如图4所示。土壤细菌群落相似性系数最高的是湖草滩和芦苇滩,与杨树林细菌群落土壤细菌群落相似性较远。真菌样本的OTU通过聚类,结果显示不同样地土壤群落主要被分为两大族群:湖草滩和芦苇滩真菌群落自成一族群;杨树林和柳树林真菌群落聚为另一族群。说明与湖草滩和芦苇滩土壤真菌群落相比,杨树林和柳树林土壤真菌群落结构更为相似。
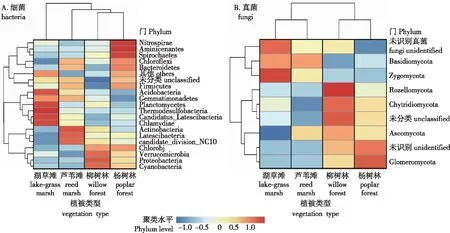
图4 洪泽湖湿地各植被类型土壤细菌/真菌群落门水平上的聚类热图Fig.4 The heatmap of bacterial communities and fungal communities at Phylum levels under different vegetation types in Hongze Lake Wetland
2.3 不同植被类型土壤微生物群落结构与土壤理化性质关系
为揭示洪泽湖湿地土壤微生物群落的影响因子,对洪泽湖湿地土壤微生物群落及土壤环境因子进行 RDA 排序分析,结果见图5。细菌群落结构及土壤环境因子的冗余分析(RDA)见图5A,第1轴和第2轴分别解释细菌群落结构变异的81.9%和14.5%,两轴累计解释量达96.4%。结果表明,检测的土壤环境因子能够很好解释土壤细菌群落结构的变化。Monte Carlo 检验分析发现,土壤粒径<2 μm、≥2~63 μm、≥63~200 μm组分有机碳分布与细菌群落结构分布呈显著正相关(P<0.05),与土壤含水率呈显著负相关(P<0.05)。图5B显示酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)主要受粒径土壤<2 μm、≥2~63 μm、≥63~200 μm组分有机碳影响,受到土壤含水率负影响。丰度较高的变形菌门(Proteobacteria)受到土壤粒径≥200~2 000 μm组分有机碳在全土中含量影响较大。
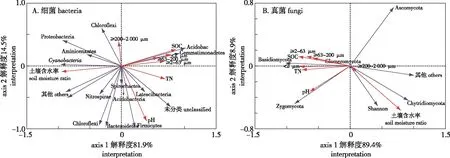
< 2 μm、 ≥2~63 μm、≥63~200 μm、≥200~2 000 μm代表各粒径组分土壤有机碳分布。< 2 μm,≥2-63 μm,≥63-200 μm,≥200-2 000 μm indicate the distribution of soil organic carbon in different particle-size fraction.图5 洪泽湖湿地土壤理化性质与细菌群落结构/真菌群落结构的冗余分析Fig.5 The redundancy analysis between bacterial communities and fungal communities at Phylum levels and soil physicochemical property in Hongze Lake Wetland
真菌群落结构及土壤环境因子的冗余分析(RDA)见图5B。第1轴和第2轴分别解释细菌群落结构变异的89.4%和8.9%,两轴累计解释量达98.3%。结果表明,检测的土壤环境因子能够很好解释土壤细菌群落结构的变化。Monte Carlo 检验分析发现,土壤粒径<2 μm、≥2~63 μm、≥63~200 μm组分有机碳在全土中含量与真菌群落结构呈显著正相关(P<0.05),与土壤含水率呈显著负相关(P<0.05)。图5B显示担子菌门(Basidiomycota)受到土壤粒径<2 μm、≥2~63 μm、≥63~200 μm组分有机碳含量的影响较大,受土壤含水率负影响。
3 讨 论
洪泽湖湿地湖草滩和芦苇滩植被多为草本植物,根系分布在土壤表层,和草原比较相近,这与前人研究发现森林土壤通常含有比草原更丰富的土壤有机碳(SOC)的结论一致[19]。Jobbágy等[20]认为,根系分布会影响有机碳在土壤中的地下垂直分布,而地上的凋落物会最终影响土壤表面和表层有机碳的相对量。从洪泽湖湿地研究区立地条件来看,由于湖草滩和芦苇滩受到水位波动的影响,草本植物凋落物被湖水冲走;杨树与柳树地表部分的凋落物高程相对高一些,所以凋落物不易被湖水冲走。这可能解释了柳树林和杨树林中的表层土壤(0~20 cm)的有机碳含量比湖草滩和芦苇滩土壤的更大的原因。一般情况下,有机碳将优先向细颗粒中积累,当土壤中黏粒含量相对较低,且有机碳源又较丰富时,黏粒结合的有机碳的量达到饱和后,有机碳开始向较大颗粒中的积累增多[8,21]。这与前人的研究结论相似[22-23]。从成土过程来看,土地植被类型的改变在提高土壤有机碳含量同时,也改变了土壤有机碳在不同粒径组分中的分布,这一结果可能导致杨树林和柳树林土壤不同粒径组分质量分布的变化[24]。
土壤丰富的有机碳可能促进几种特定微生物的生长,这些特定微生物的大量生长将限制其他微生物的生长,导致了有机碳丰富的土壤中微生物的种类却不一定多,物种多样性较低[25]。还有研究表明有机碳资源的利用在微生物竞争状态下,有机碳的增加更有利于对有机碳利用能力强的微生物种[26]。同时,土壤有机碳的积累,主要来自于难分解有机碳,可能是因为所积累的难分解有机碳很难被微生物所利用,而易分解有机碳引起微生物之间的竞争,而导致微生物多样性降低[27]。由此推断,有机碳含量并不是限制微生物群落多样性的直接影响因素,而有机碳组分含量可能是微生物多样性的限制因子。以往研究发现土壤含水量和有机碳含量是影响土壤微生物群落结构的主要因子[28-30],许多研究均有类似的结果[25,31-32]。微生物群落结构与土壤含水率呈显著负相关,分析其原因可能是样地土壤含水量越大,其通透性越差,从而导致土壤微生物丰度降低[33]。Li等[34]研究发现当添加新的有机碳源时,酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)中微生物组群与有机碳含量有很好的关联性,也可以解释两个菌门和<200 μm粒径组分土壤有机碳正相关这一现象。在土壤含水量相对较低的情况下,土壤真菌数量会随着土壤有机碳含量的增加而增加;当土壤含水率较高或淹水条件时,土壤含水率的增加才会抑制真菌的生长和繁殖[35-37],可以解释柳树林、杨树林的真菌中担子菌门(Basidiomycota)丰度高于湖草滩和芦苇滩的现象。从以上分析可以看出,粒径<200 μm组分土壤有机碳可能对特定的优势微生物类群分布影响较大。
洪泽湖河湖交汇区经过近30年的人工林种植,有机碳含量增加明显,说明土地利用类型的改变对有机碳含量有较大影响。微生物的种类和多样性并没有随着有机碳的增加而增多,由此可知,增加的有机碳只是增加了特定门类微生物的数量而未增加微生物门类。因此,今后还需要进一步研究各粒径组分土壤有机碳含量及其有效性与粒径组分上特定微生物类群的分布关系,深入分析湿地的植被变化对土壤有机碳的影响。

