UPLC测定经典名方金水六君煎中11种成分
董自亮,李红亮,原欢欢,蒋燕霞,李 娟,禹奇男,吴瑞军,冉亚东,安太勇,覃 瑶,彭世陆,刘世琪,彭 涛,秦少容,罗维早*,王 欣*
1.重庆市中药研究院,重庆 400065
2.太极集团有限公司,重庆 400800
金水六君煎(Jinshui Liujun Decoction,JLD)出自明·张介宾《景岳全书》,为国家中医药管理局2018年公布的《古代经典名方目录(第一批)》的经典名方的第58 首。原文:“当归二钱,熟地三五钱,陈皮一钱半,半夏二钱,茯苓二钱,炙甘草一钱,水二钟,生姜三五七片,煎七八分,食远温服”。方中半夏辛温,能燥湿化痰、和中止呕;陈皮芳香,理气运脾、燥湿化痰;茯苓甘淡,甘能补脾,淡可渗湿,使已聚之湿从小便渗利而去,更添甘草和中益脾,共奏理气健脾、燥湿化痰之效。主治肺肾虚寒、水泛为痰、或年迈阴虚、血气不足、外受风寒、咳嗽呕恶、喘逆多痰等症[1]。近年来对该方的药效学研究较多,但对其化学成分的研究及定量测定报道较少。文献仅报道采用HPLC 对JLD 制剂中陈皮(橙皮苷)、当归(阿魏酸)药材进行定量测定[2-3],以及采用薄层扫描法、紫外分光光度法测定JLD 胶囊中β-谷甾醇和总生物碱的含量[4],但未能全面有效地控制该复方制剂的多种成分。本研究采用UPLC 技术[5-6],首次建立了多波长同时测定JLD 中腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯11 种主要成分的UPLC 方法,此方法简便、快捷、准确,专属性强,同时结合偏最小二乘法-判别分析(PLS-DA)等化学识别模式[7],评价各批次样品之间的质量差异,在此基础上为Hotelling’sT2和DModX 2 种统计量设定了控制限和警戒限,为JLD 物质基准的关键质量属性的研究及其后续现代制剂质量的全面控制提供参考。
1 仪器与材料
1.1 仪器
Agilent 1290-UPLC DAD 检测器,美国Agilent公司;XSE205DU 型电子天平,精密度0.01 mg/0.1 mg,Mettler Toled 公司;LGJ-10FD 型冷冻干燥机,北京松源华兴科技发展有限公司;KQ-500DE 超声波仪,昆山市超声仪器有限公司。
1.2 材料
JLD,实验室自制;对照品腺苷(批号110879-201703,质量分数99.7%)、鸟苷(批号111977-201501,质量分数93.6%)、5-羟甲基糠醛(批号111626-201912,质量分数99.2%)、阿魏酸(批号110773-201915,质量分数99.4%)、甘草苷(批号111610-201908,质量分数95.0%)、毛蕊花糖苷(批号111530-201914,质量分数95.2%)、橙皮苷(批号110721-201818,质量分数96.2%)、甘草酸铵(批号110731-201720,质量分数97.7%)、6-姜辣素(批号111833-201806,质量分数99.9%)、藁本内酯(批号111737-201910,质量分数≥98%),均购于中国食品药品检定研究院;对照品芸香柚皮苷,批号18040301,质量分数99.66%,购自上海诗丹德标准技术服务有限公司。乙腈、磷酸均为色谱纯,北京化标源科技有限公司;实验用水均为二次蒸馏水。
JLD 中各饮片均采自3 个产地,按《中国药典》2015年版一部项下检测均合格。产地、批次等具体信息见表1。经重庆市中药研究院罗维早研究员鉴定,各饮片均符合《中国药典》2015年版一部相关项下的性状规定,鉴定结果地黄为玄参科地黄属植物地黄Rehmannia glutinosaLibosch 的新鲜或干燥块根,当归为伞形科当归属植物当归Angelica sinensis(Oliv.) Diels 的干燥根,陈皮为芸香科柑橘属植物橘Citrus reticulataBlanco 的干燥成熟果皮,半夏为天南星科半夏属植物半夏Pinellia ternata(Thunb.) Breit.的干燥块茎,茯苓为多孔菌科茯苓属真菌茯苓Poria cocos(Schw.) Wolf 的干燥菌核,豆科甘草属植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎,姜科姜属植物姜Zingiber officinaleRose.的新鲜根茎。
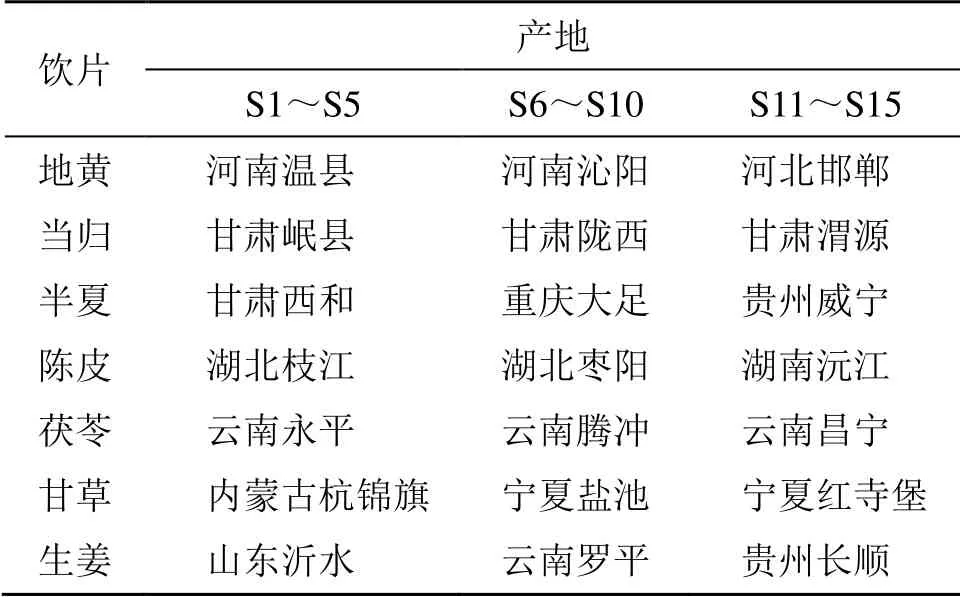
表1 15 批次JLD 样品各批次中所用饮片的产地信息Table 1 Origin information of decoction pieces used in each batch of 15 batches of JLD samples
2 方法与结果
2.1 色谱条件与系统适应性
色谱柱为Acquity UPLC HSS T3 C18柱(100 mm×2.1 mm,1.8 μm);流动相为0.1%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~2 min,100% A;2~7 min,100%~98% A;7~12 min,98% A;12~25 min,98%~90.5% A;25~32 min,90.5%~85.5% A;32~41 min,85.5% A;41~50 min,85.5%~79% A;50~58 min,79%~71% A;58~64 min,71%~44%A;64~70 min,44%~35% A;70~71 min,35%~5% A;72 min,5% A;72~73 min,5%~100% A;体积流量0.3 mL/min;检测波长:248 nm(0~17 min、64~66 min)、330 nm(18~40 min)、281 nm(40~64 min、66~73 min)切换;柱温25 ℃;进样量1.0 μL。各峰分离度均大于1.5。色谱图见图1。
2.2 对照品溶液的制备

图1 空白溶剂 (A)、混合对照品溶液 (B)、供试品溶液 (C)UPLC 图Fig.1 UPLC of blank (A),standard solution (B) and sample solution (C)
精密称取腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯对照品适量,加甲醇溶解后配制成质量浓度分别为40.12、69.16、738.80、39.88、193.80、58.75、164.60、421.80、218.90、134.90、25.20 μg/mL 的混合对照品储备液,保存于4 ℃冰箱中备用。
2.3 供试品溶液的制备
采用随机数表法,分别对熟地黄、当归、陈皮、半夏、茯苓、炙甘草、生姜各15 批饮片进行编号及排序。根据原方记载及本方考证的剂量折算关系,称取一个处方量的JLD(当归7.46 g、熟地黄14.92 g、陈皮5.60 g、半夏7.46 g、茯苓7.46 g、炙甘草3.73 g、生姜15 g),加水400 mL,加热至沸腾转小火,保持沸腾30~60 min,滤过,滤液冷冻干燥(-50 ℃干燥72 h,5 Pa),即得JLD 干粉。
取本品约0.5 g,加70%甲醇15 mL,置于密塞锥形瓶中,精密称定质量,超声提取45 min,放冷,用70%甲醇补足减失的质量,摇匀,滤过,即得供试品溶液。
2.4 方法学考察
2.4.1 线性关系考察 取“2.2”项下混合对照品储备液,分别精密吸取1、2、3、5、10、20 mL 置于25 mL 量瓶中,加甲醇至刻度,摇匀,即得不同质量浓度的混合对照品溶液;按“2.1”项色谱条件进样测定。以对照品的质量为横坐标(X),峰面积积分值为纵坐标(Y),绘制标准曲线,进行线性回归,得到回归方程和相关系数(r),结果见表2。
2.4.2 精密度试验 取“2.4.1”项下混合对照品溶液,按“2.1”项色谱条件连续进样6 次,结果腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯峰面积的RSD 值分别为1.26%、1.45%、1.06%、0.17%、0.95%、1.43%、0.86%、1.24%、0.23%、1.26%、0.95%。11 种成分峰面积的RSD 值均小于2.0%,表明仪器精密度良好。
2.4.3 稳定性试验 取1 份批号为S1 的样品,按“2.3”项下方法制备供试品溶液,分别于第0、6、12、18、24 h 按“2.1”项下色谱条件进行测定。结果腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯峰面积的RSD 值分别为1.92%、2.68%、0.98%、1.18%、0.90%、1.23%、0.51%、1.43%、0.85%、1.55%、0.95%,结果发现11 种成分峰面积的RSD 值均小于3.0%,表明JLD 供试品溶液在24 h 内稳定性良好。

表2 11 种成分的线性回归方程、线性范围、相关系数Table 2 Regression equation,linear range and correlation coefficient of 11 active ingredients
2.4.4 重复性试验 取JLD 样品(批号为S1),按“2.3”项下方法制备6 份供试品溶液,按“2.1”项下色谱条件进样测定。结果腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯质量分数的RSD 值分别为2.88%、1.69%、2.35%、0.95%、0.53%、1.05%、0.56%、1.85%、0.40%、0.36%、1.81%,11 种成分质量分数的RSD 值均小于3.0%,表明该分析方法重复性良好。
2.4.5 加样回收率试验 取已测定含量的JLD样品(批号为S1),称取约0.25 g,精密称取6 份,分别加入约为样品中等量的各对照品,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积并计算各成分质量浓度,计算加样回收率。结果腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯的平均加样回收率分别97.70%、103.15%、100.71%、97.79%、99.74%、102.72%、96.62%、101.43%、102.35%、97.65%、98.11%,RSD 值分别为0.78%、1.67%、1.04%、0.50%、1.60%、0.68%、0.98%、0.56%、0.19%、1.54%、0.23%。
2.5 样品测定
按“2.3”项下样品处理方法,制备15 批供试品溶液,按照“2.1”项下色谱条件进行测定,采用外标法计算JLD 中腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯的质量分数,结果见表3。

表3 15 批JLD 样品中11 种成分测定结果Table 3 Content of 11 components in 15 batches of JLD
2.6 PLS-DA 模型的建立及相关分析
采用 SIMCA 14.1 软件(Umetrics,MKS Instruments Inc.,Sweden)对15 批JLD 样品中的多指标含量测定数据进行主成分分析(PCA)。应用Hotelling’sT2和DModX 2 种控制图对不同批次的样品质量进行监测,进而采用有监督的PLS-DA 模型进行分析。
2.6.1 Hotelling’sT2和 DModX 控制限的建立Hotelling’sT2和DModX 控制图是为了监测不同批次产品而开发的,是2 个互补的多变量分析手段。Hotelling’sT2表示的是每个选定观察点与模型平面中原点的距离,为模型的内部变化度量,代表样品中信息与主成分模型中其他样品差异;DModX 表示数据在变量X空间到主成分模型的距离,为模型外部的数据变化度量,代表样品中未被模型解释的变化。通常认为在控制限度以下的产品为正常批次产品,超出控制限的为异常批次样品。Hotelling’sT2和DModX 统计量作为批间差异性评价指标,两者具有不同的监控作用,互为补充。当发现某个批次超出或控制限时,在贡献图上可以分析批次过程的异常波动受哪些变量的影响[8]。
Hotelling’sT2和DModX 的控制图如图2、3,图中的T2Crit (99%)和DCrit 为控制限,其控制上限分别为14.43 和1.75;T2Crit (95%)为警戒限,上限为8.20。这15 批物质基准样品在控制限之下,均为正常批次产品,在2 张控制图上处于受控状态,这也证明所建立的PCA 模型较好的表征了样品的正常波动。说明这15 批物质基准样品批次质量差异性较好,与相似度评价结果相对应,并且较于相似度阈值解释性更强。
2.6.2 偏最小二乘判别分析(PLS-DA) 为评价不同批次JLD 样品之间的成分含量差异,采用有监督的PLS-DA 模型进行分析[9]。以样品S1~S15 为Y变量,11种成分的含量为X变量,利用SIMCA 14.1软件进行PLS-DA 处理,见图4、5。结果发现在置信区间(95%)内,15 批样品存在一定差异性,根据分布可将样品S1~S15 分为3 类,样品S1~S5为一类,S6~S10 为一类,S11~S15 为一类,表明这11 种成分在评价样品产地之间的质量差异具有重要参考价值。同时,变量重要性投影(VIP)值越大,表明对样品分类贡献较大;其中VIP>1 的有4 种成分,依次为芸香柚皮苷、甘草酸铵、藁本内酯和阿魏酸,说明这4 种成分是影响不同批次样品之间质量差异贡献较大的成分,可作为指导经典名方JLD 物质基准及复方制剂质量控制的关键成分。

图2 15 批JLD 样品Hotelling’s T2 控制图Fig.2 Hotelling’s T2 control chart of 15 batches of JLD

图3 15 批JLD 样品的DModX 控制图Fig.3 DModX control chart of 15 batches of JLD

图4 15 批JLD PLS-DA 的得分Fig.4 PLS-DA score plot of 15 batches of JLD

图5 JLD 中11 种成分的VIP 值Fig.5 VIP value of 11 components of JLD
3 讨论
3.1 指标成分的确定
本研究在《中国药典》对JLD 各药味明确规定的甘草苷、甘草酸、毛蕊花糖苷、橙皮苷、阿魏酸、6-姜辣素等6 个定量指标的基础上增加了与该方药效相关的腺苷、鸟苷、5-羟甲基糠醛、芸香柚皮苷、藁本内酯5 个关键成分的定量控制。地黄为本方君药,其中毛蕊花糖苷、5-羟甲基糠醛等活性成分具有免疫调节、肝脏保护以及神经保护等作用[10]。陈皮的主要活性成分是橙皮苷、芸香柚皮苷、柚皮苷,具有较好的抗氧化能力、抗炎、促胃动力作用、抗肿瘤活性[11-14]。当归中阿魏酸、藁本内酯等活性成分具有抗炎止痛、抗血小板凝聚等活性[15];甘草中的甘草酸、甘草黄酮为生物活性较强的物质,现代药理学研究表明甘草酸具有较强的保肝活性和肾上腺皮质激素样作用,可增强内耳听觉,能够抗炎、抗变态反应、解毒止咳、抗肿瘤等作用。甘草中的甘草苷具有抗溃疡、抗菌、抗炎、解痉、镇痛等作用[16-20]。尿苷、鸟苷、腺苷等核苷类成分能够干扰病毒核酸的合成,通常为中成药抗病毒的活性成分[21]。综合药理作用与色谱分离效果,最终确定该11个成分为指标成分。
3.2 色谱条件的选择
中药复方化学成分较为复杂,选择梯度洗脱能更有利于成分整体信息的获得。考察供试品溶液制备时不同提取溶剂(甲醇、乙醇及水)、不同体积分数(30%、50%、70%、100%)甲醇和水的配比、不同提取时间(30、45、60 min)、提取溶剂体积(10、15、20、25 mL)对JLD 中有效成分的影响,综合考虑各待测成分的色谱峰峰形及分离度,最终选择70%甲醇为JLD 干粉的提取溶剂。
考察了乙腈和甲醇作为有机相对提取效果的影响,结果甲醇作有机相基线漂移,峰形不对称,因此选择乙腈作有机相;为改善峰形,在水相中加入不同浓度的甲酸、乙酸和磷酸,结果表明加入0.1%磷酸时,分离效果好,基线平稳;考察了梯度洗脱和等度洗脱,梯度洗脱时各物质分离度高。
根据对照品预试验初步考察,腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯的最佳吸收波长分别为260、256、285、322、276、330、283、283、252、280、281 nm,由于本研究测定成分较多,成分间波长差异较大,为实现多成分含量同时测定,在综合考察峰形、基线、吸收差异等多项干扰因素下,最终确定最佳的波长切换法对多成分进行含量测定。
3.3 结果分析
本研究在UPLC 多成分含量测定基础上,结合PCA、PLS-DA 等相关化学计量学方法对不同批次JLD 物质基准的质量的批间差异性进行了深入的分析,并在PCA 模型基础上设定了Hotelling’sT2和DModX 控制限,实现对批次物质基准质量进行监测。该15 批物质基准均为正常批次样品,其有效成分含量变化都没有明显的差异,但通过PCA 后可以看出,15 批样品所用原药材产地的差异在多指标成分的含量上予以体现;进一步通过PLS-DA中的VIP值可以判断出,芸香柚皮苷(源于陈皮)、甘草酸铵(源于甘草)、藁本内酯(源于当归)和阿魏酸(源于当归、陈皮)是造成这些差异存在的主要原因,提示对这4 个成分进行质量控制,有利于有效反映JLD 物质基准及其复方制剂的质量变化属性。
最后,本研究以JLD 中腺苷、鸟苷、5-羟甲基糠醛、阿魏酸、甘草苷、毛蕊花糖苷、芸香柚皮苷、橙皮苷、甘草酸铵、6-姜辣素、藁本内酯等11 种主要成分为研究对象,首次建立了UPLC 同时测定JLD 中11 种成分的方法,同时对其提取条件、色谱条件等参数进行了优化,并通过对15 批不同产地的药材进行对比分析,发现了影响JLD 物质基准质量较大的4 种成分。
方法学考察结果表明,所建立的方法满足定量要求,且简单易行,为JLD 的多指标质量控制提供了方法基础,同时也为后续的制剂、药效学研究提供了参考。
利益冲突所有作者均声明不存在利益冲突

