中国家族遗传性肿瘤临床诊疗专家共识(2021年版)(2)—家族遗传性卵巢癌
中国抗癌协会家族遗传性肿瘤专业委员会
卵巢癌是病死率最高的妇科恶性肿瘤[1],10%~15%的卵巢癌(包括输卵管癌和腹膜癌)与遗传因素有关,遗传性卵巢癌综合征(hereditary ovarian cancer syndrome,HOCS)是一种涉及卵巢癌易感性增高的常染色体显性遗传综合征[2]。HOCS 包括遗传性位点特异性卵巢癌综合征(hereditary site specific ovarian cancer syndrome,HSSOCS)、遗传性乳腺癌卵巢癌综合征(hereditary breast and ovarian cancer,HBOC)、林奇综合征(Lynch syndrome,LS)及其他肿瘤综合征伴发遗传性卵巢癌等[3]。HBOC 是指一个家族中有2个一级亲属或1 个一级亲属和1 个二级亲属患乳腺癌或卵巢癌,且具有遗传倾向,主要是由BRCA1或BRCA2突变引起[4]。中国女性人群中,BRCA1/2基因突变频率约为0.38%[5]。HSSOCS 是HBOCS 的变异情况,是指家族中有2 个及2 个以上一级或一级及二级亲属同患卵巢癌。主要是BRCA1/2基因突变,以及同源重组(homologous recombination,HR)通路上的小部分基因突变相关[6]。LS 主要表现为结肠癌并发肠外肿瘤,如卵巢癌、子宫内膜癌、肝癌、胃癌、肾癌等,由DNA 错配修复基因(mismatch repair gene,MMR)突变导致[7]。因此,判断此类疾病需要进行错配修复基因缺陷(deficiency of mismatch repair,dMMR)的检测。其他一些肿瘤综合症可能增加卵巢癌发病风险,包括与胚系LKB1(即STK11)基因突变相关的黑斑息肉综合征(Peutz-Jeghers syndrome,PJS)等[8]。
HOCS 中HBOCS 和HSSOCS 约占90%,LS 约占10%,其他相关HOCS 占不足1%。HOCS 共同特点包括:常染色体显性遗传,平均发病年龄较散发性患者早,可表现为一人罹患多种原发肿瘤,如乳腺癌、结直肠癌、子宫内膜癌等肿瘤,和(或)家族中多人罹患同种或多种原发肿瘤[9]。
1 突变频率、发病风险和临床病理特征
1.1 HBOC/HSSOCS
携带BRCA1基因突变的女性终生卵巢癌发病风险为48.3%,而携带BRCA2基因突变的女性终生卵巢癌发病风险为20.0%[10]。HSSOCS 家庭成员的终身卵巢癌风险约5%[11]。
HBOC 患者卵巢癌平均发病年龄52.4 岁,其中BRCA1突变者的平均发病年龄为49.7 岁,BRCA2突变者平均发病年龄为52.4 岁[12]。携带BRCA1/2致病突变的卵巢癌患者较非携带者预后好,相比于BRCA1突变患者,BRCA2突变患者对化疗反应率更高,预后更好[10]。病理类型以浆液性腺癌多见。
1.2 LS 相关卵巢癌
60%的LS 患者以妇科恶性肿瘤为首发恶性肿瘤,最常见的是子宫内膜癌,其次是卵巢癌。以卵巢癌为首发肿瘤的患者,并发另一种肿瘤的中位时间是5.5年[13],终生并发另一种肿瘤的风险为6%~12%[14]。
LS 相关卵巢癌(Lynch syndrome-associtated ovarian cancer,LSAOC)患者平均年龄约45~46 岁[15],较散发性卵巢癌患者提前15 至20年,不同基因突变携带者(MLH1、MSH2、MSH6和PMS2等)的发病年龄无显著性差异。LSAOC 患者确诊时较少发生转移,82%~84% 的患者均处于Ⅰ期或Ⅱ期,预后相对较好[14]。组织病理学类型通常为子宫内膜样或非浆液性类型[16]。
1.3 PJS 相关卵巢癌
PJS 是以特定部位皮肤黏膜色素斑和胃肠道多发错构瘤息肉为特征的常染色体显性遗传病,绝大多数由STK11基因突变引起。流行病学显示,PJS 患者一生中累积肿瘤发生风险率为37%~93%,卵巢癌发病风险率为21%。PJS 相关卵巢癌患者平均发病年龄为28 岁,其中部分患者发病时不伴有肠息肉[17]。
2 遗传基因检测及风险评估
2.1 基因检测适用人群
基因检测的目的是给卵巢癌患者寻找个体化治疗的靶点,而对于亲属,仅需验证患者的致病突变位点,由此评估患癌风险,明确筛查和预防措施。推荐选择多基因检测,提高致病性基因突变的检测率;接受骨髓移植和(或)近期活动性血液恶性疾病者不推荐通过血液、唾液样本检测,推荐培养成纤维细胞后进行检测;年龄<18 岁者不推荐进行基因检测。
2.1.1 初治上皮性卵巢癌患者BRCAs致病性突变对于初治上皮性卵巢癌患者的一线维持用药具有重要指导意义,由于BRCA1和BRCA2是BRCA-FA途径的一部分,在HR 过程中起到至关重要的作用,BRCAs基因功能缺失将导致同源重组修复缺陷(homologous recombination deficiency,HRD)。除此以外,其他Fanconi 基因同样与卵巢癌的遗传易感风险相关,导致LS 的错配修复基因突变也可预测卵巢癌的患病风险[14]。已明确的11 个相关基因共同构成遗传性卵巢癌相关基因。因此,建议卵巢癌进行多基因检测,检测基因包括BRCA1、BRCA2、RAD51C、RAD51D、BRIP1、NBN、PALB2、STK11、ATM、BARD1、CDH1、CHEK2、CDKN2A、NF1、PTEN、TP53、MSH2、MLH1、MSH6、PMS2、EPCAM[18]。
2.1.2 复发性上皮性卵巢癌患者 复发患者至少包括BRCA1/2和MSI 或DNA 错配修复基因、NTRK的检测;可以酌情考虑进行其他体系的基因检测[19]。
2.1.3 高危人群 对于检出胚系突变的卵巢癌个体,需进一步对其家系进行“逐级检测”,以发现高危个体,从而针对性地开展肿瘤预防与监测工作,降低个体发病、死亡风险及群体发病率。对于具有高危家族史的未患病个体,建议参考美国国家综合癌症网络(NCCN)指南[10]进行卵巢癌风险评估和基因检测。
2.2 检测方法
对于BRCA1/2基因检测,建议选择二代测序(next generation sequencing,NGS)检测DNA 单碱基变异、小片段缺失或插入及甲基化以确定是否存在BRCA1/2胚系突变[20],对于大片段重排,可采用多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)的组合检测。亲属的家系验证可采取Sanger 测序法定点验证[21]。关于检测样本,ASCO 等指南认为患者应先做易感基因的胚系检测,若结果为阴性,再进行肿瘤体系检测。
对于LS 相关分子检测诊断标准及方法,详见中国家族遗传性肿瘤临床诊疗专家共识(2021年版)(4)—结直肠癌部分。
2.3 遗传咨询及风险评估
卵巢癌患者及其亲属,可以通过肿瘤遗传咨询获得诊断、治疗及干预措施等重要信息。HOCS 遗传咨询包括:绘制详细族谱、风险评估、知情同意程序、对患者和家属进行宣教[22]。
HOCS 风险评估的初步工作即收集完整的家族史,采集要点如下:1)一级亲属(兄弟姐妹、父母、子女)有无肿瘤史;2)二级亲属(祖父母、姑姑、叔叔、侄子、侄女及同母异父或同父异母的兄弟姐妹)有无肿瘤史;3)对于每一位罹患肿瘤的亲属,均应记录以下要点:原发性肿瘤类型;原发性肿瘤发病年龄;母系或父系家族史。家系图谱应追溯先证者至少三代亲属。通过对家族三代血亲疾病史的了解,可以对其家族的遗传性卵巢癌易患风险进行评估[23]。
专家组意见:基因检测建议采用包含BRCA1/2在内的panel 二代测序方法,对于检出结果阴性者可联合MLPA 检测BRCA1/2 大片段缺失,基因突变阳性者对其家系逐级检测。
3 临床管理
遗传性卵巢癌的临床管理包括针对患者特殊遗传信息改变的靶向治疗,以及对其他易患肿瘤的预防。对于携带致病突变的成员,则涉及肿瘤的预防和家族阻断两个方面。
3.1 针对携带致病突变的健康者的临床管理方案
3.1.1 筛查 目前,尚无有效的筛查手段可早期识别卵巢癌。经遗传咨询所筛选出的HBOCS 高危人群,若未接受降低风险输卵管-卵巢切除术(risk-reducing salpingo-oophorectomy,RRSO)手术,可考虑从30~35 岁开始,在临床医生的指导下监测血清CA125 和阴道超声。LS 高危人群推荐从30 岁开始每年行筛查和常规检查。对于PJS 人群,建议从18~20 岁开始每年进行1 次妇科检查和宫颈细胞学涂片筛查。
3.1.2 临床干预 对于健康携带者,应在充分的知情同意和遗传咨询后进行适当的临床干预,而对于未发现明确致病性突变或因经济等原因未进行基因检测,但家族遗传倾向明显者,也应当进行充分的遗传咨询并选择适当的临床干预方式。
1)预防性药物治疗:目前尚无可靠的流行病学资料表明药物能有效降低基因突变携带者发生遗传性卵巢癌的风险,但有研究认为口服避孕药(oral contraceptives,OCPs)对预防卵巢癌有一定作用。研究发现使用OCPs 超过5年可能使有家族史的女性罹患卵巢癌的风险减少50%,也可以降低普通人群患卵巢癌的风险,OCPs 预防卵巢癌的保护效用随着用药时间的延长而增加[24]。但OCPs 是否会增加BRCA突变人群乳腺癌的风险尚存争议。因此,推荐BRCA1/2突变无乳腺癌病史的人群口服OCPs,以降低患卵巢癌风险。
甲羟孕酮、OCPs 或左炔诺孕酮宫内缓释系统有可能降低LS 相关子宫内膜癌的发病风险,但预防LS相关卵巢癌的证据尚不充分。
2)降低风险手术:①RRSO 术。RRSO被认为是降低HBOCS 及相关妇科恶性肿瘤发病风险最有效的方法,可降低卵巢癌患者发病率70%~85%,及该人群乳腺癌的肿瘤死亡率和全因死亡率;推荐高危女性在完成生育计划后实施RRSO。RRSO 的时机选择依据患者年龄和基因突变而定,BRCA1突变携带者行RRSO 的年龄为35~40 岁,BRCA2突变携带者为40~45 岁[10](表1)。非BRCA突变人群不能从RRSO受益,保留卵巢者的全因死亡率反而显著降低[25]。因此,不推荐普通人群实施RRSO。实施RRSO 前,应告知患者医源性绝经的常见后遗症,包括血管舒缩症状、骨质疏松症、性欲下降、阴道萎缩干涩症状和心血管疾病等,同时也要告知相应的补救措施的利益与风险[26]。
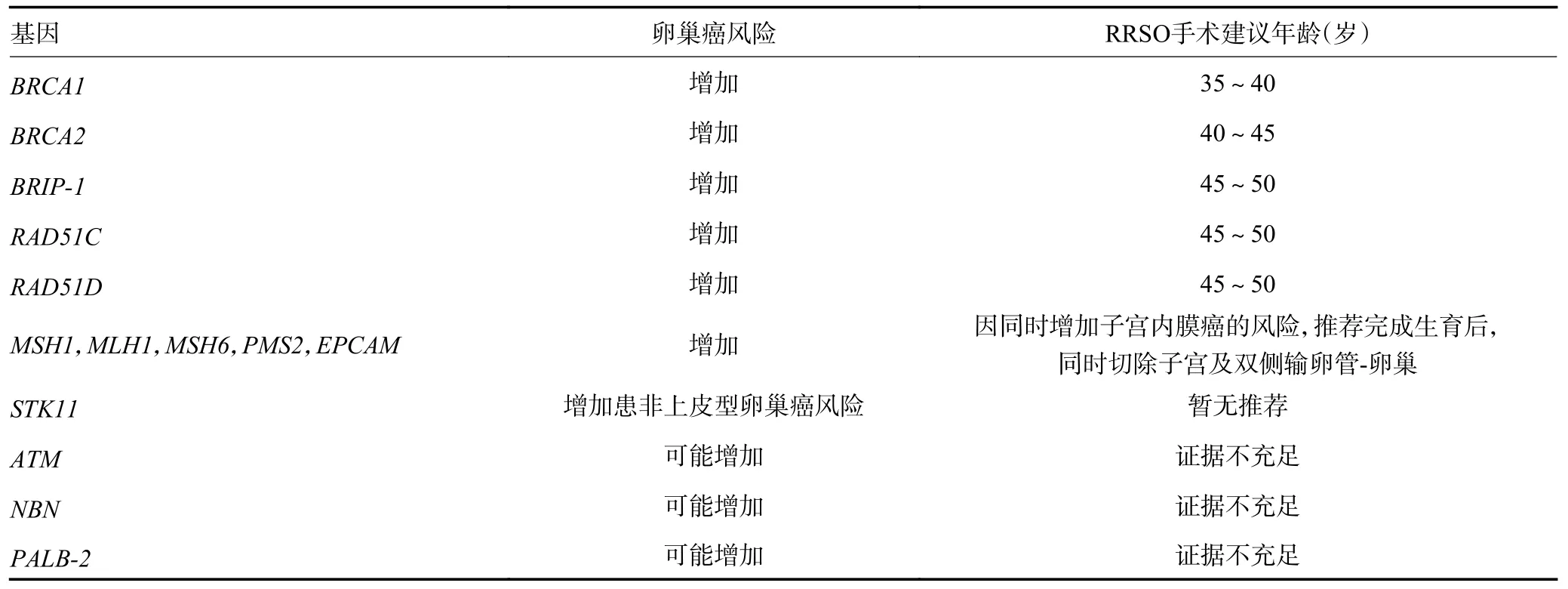
表1 降低风险手术的建议年龄
病理学评估:标本取材推荐分段式全输卵管尤其是伞端剖切检查(sectioning and extensively examining the fimbriated end,SEE-FIM),以2 mm 的间隔进行连续切片,以发现或排外隐匿性癌;如发现有隐匿恶性疾病或确诊浆液性输卵管上皮癌(serous tubal intraepithelial carcinoma,STIC),需转诊至妇科肿瘤专科医师。约10%的RRSO 标本中发现上皮内瘤变或癌变[27]。
②降低风险输卵管切除术。大部分年轻BRCA1/2突变携带者,尤其具有生育要求以及顾虑医源性绝经患者,往往一时难以接受RRSO,可推荐双侧输卵管切除术。手术范围包括输卵管伞端至进入子宫部分完整切除。同时告知患者RRSO 是降低卵巢癌风险的标准手段,双侧输卵管切除术不等同于RRSO,该预防性措施不能够降低乳腺癌、卵巢生殖细胞肿瘤、性索间质肿瘤甚至上皮性肿瘤的发生风险,建议年轻的BRCA1/2携带者患者随着年龄的增加和生育任务的完成,最终接受双侧卵巢切除术[28]。
③双侧输卵管切除术及延迟性卵巢切除术(bilateral salpingectomy with delayed oophorectomy,BS/DO)。目前BS/DO 预防高危女性罹患卵巢癌有效性和安全性的证据有限,期待有更完善的前瞻性研究提供BS/DO 有效性和安全性证据。
④全子宫和双侧输卵管-卵巢切除术(total hysterectomy and bilateral salpingo-oophorectomy,THBSO)。预防性THBSO 是降低LS 人群相关子宫内膜癌和卵巢癌的有效措施,THBSO 应基于高危人群的绝经期状态、有无合并症及明确的基因突变等,并结合个体化原则。手术时机选择在完成生育计划后,尤其是年龄>40 岁者[29],THBSO 前应当常规进行子宫内膜活检,排除隐匿性子宫内膜癌。
专家组意见:BRCA1/2 突变健康携带者应在充分的知情同意和遗传咨询后,根据年龄和生育情况,选择合适的药物或手术干预方式。未选择降低风险手术的高危人群,应加强临床监测与筛查。
3)阻断HBO 向后代传递的措施:遗传性肿瘤为常染色体显性遗传,突变基因携带者有50%的概率将致病性突变传递给子代。胚胎植入前遗传学检测(preimplantation genetic testing,PGT)技术能最大程度地降低致病性基因突变向子代传递的风险[30]。选择PGT 单基因缺陷(PGT for monogenic/single gene defects,PGT-M)检测前,应充分告知下述相关事宜:①可获得囊胚的数量受年龄、卵巢储备等多种因素的影响;②理论上50%的胚胎不携带致病性基因突变,并非每例患者获得的囊胚中有50%不携带致病性突变,有时这种概率可能为0;③选择做PGT 时机很重要,如有冷冻保存的卵子,一旦决定卵子体外受精便可考虑PGT-M,暂无生育计划者冻存PGT 检测后胚胎。
3.1.3 生育力保存和RRSO 后的激素替代治疗 1)生育力保存:妇科肿瘤医师与肿瘤生殖学专家携手对BRCA基因携带者管理非常重要。研究发现,年龄18~40 岁的BRCA基因突变女性携带者具有较少的原始卵泡,卵母细胞中的DNA 损伤也更为严重。此外,携带BRCA基因突变的女性原始卵泡中DNA 双链断裂速度增加,有可能导致卵巢早衰,最终可导致围绝经期提前[31]。因此,BRCA1和BRCA2突变携带者有可能存在卵巢储备功能降低[32],该类人群的生育窗口相对较窄,建议将具有BRCA1和BRCA2突变的女性尽早(20~30 岁)转诊至生殖内分泌专家,以便有相对充足的时间评估基础卵巢储备,指导和实施生育力保存计划,卵巢储备功能的评估方法有经阴道超声卵巢窦卵泡计数(antral follicle counting,AFC)、抗米勒管激素(AMH)水平测定、早卵泡期卵泡刺激素和雌二醇检测,可预测控制性超促排卵的反应。根据卵巢储备功能医患双方共同决策是否需要或何时启动生育力保存计划,以满足其生育要求。
冷冻保存卵母细胞和(或)胚胎是有效的生育力保存策略,但选择冷冻保存卵母细胞和(或)胚胎前需要与患者沟通探讨:①生育力保存并不能保证最终的活产,成功率很大程度上取决于年龄及卵巢的反应性;②各种辅助生殖的用药及操作均具有一定的风险。在一般人群中,辅助生殖不会增加乳腺癌、卵巢癌或子宫内膜癌的风险。有限的数据表明,辅助生殖也不会增加BRCA突变携带者乳腺癌及卵巢癌的风险,但仍建议控制性超促排卵时应联合使用芳香化酶抑制剂或采用微刺激方案等,以最大程度地降低雌二醇水平。
专家组意见:对于有生育需求的BRCA1/2 突变携带者,及早转诊生殖专家,评估基础卵巢储备,充分告知后医患双方共同制定生育力保存的时间和方式。
2)RRSO 后的激素替代治疗:自然绝经前接受RRSO 或THBSO,意味着提早进入医源性绝经期,导致多种症状,如严重的血管舒缩症状、阴道干燥、性功能障碍和认知改变,并可能显著的影响其生存质量。此外,其发生冠心病和骨质疏松的风险也会增加。因此,推荐降风险手术后每年1 次盆腔检查,监测CA125水平,鼓励体育锻炼,补充钙元素和维生素D,每隔1~2年进行1 次骨扫描[33]。
激素治疗在减轻与绝经相关的症状方面非常有效,但对高风险的女性行输卵管卵巢切除术后,进行激素治疗仍有争议,主要的顾虑源于激素替代治疗可能会进一步提高乳腺癌高危人群的发病风险。尚无研究评估激素治疗在因BRCA突变而行预防性手术以及LS 女性的安全性数据。对于年龄<50 岁的一般人群女性,在子宫切除术中同时切除卵巢会显著增加其心血管疾病的风险和全因死亡率,应综合考虑利弊。5-羟色胺再摄取抑制剂、α2-肾上腺素受体激动剂、饮食和生活方式改变等可用于改善血管舒缩症状。
3.2 针对携带致病变异卵巢癌患者的临床管理方案
3.2.1 针对BRCA突变携带者的卵巢癌患者的治疗 1)初始治疗后维持治疗:卵巢癌初始治疗达到完全缓解(complete response,CR)/部分缓解(partial response,PR)后给予维持治疗可推迟复发,改善生存。根据SOLO-1、PAOLA-1 及PRIMA 等多项Ⅲ期临床随机对照试验的结论,PARP 抑制剂作为卵巢癌一线维持治疗药物的疗效显著[34]。对于Ⅱ~Ⅳ期初始治疗达到CR/PR 的BRCA1/2胚系或体细胞突变卵巢癌患者:①初始化疗未联合贝伐珠单抗者,可选择PARP抑制剂维持治疗或观察(Ⅱ期患者);②初始化疗联合贝伐珠单抗者,可选择贝伐珠单抗+奥拉帕利。PARP抑制剂主要适用于组织学类型为高级别浆液性癌和子宫内膜样癌,或BRCA突变的透明细胞癌和癌肉瘤类型。
2)铂敏感复发缓解后的维持治疗:根据study 19、SOLO-2、NOVA 及ARIEL3 等临床试验的结论[35],对于完成≥2 线含铂化疗达CR/PR 且BRCA突变者,既往未使用过PARP 抑制剂者应使用PARP 抑制剂(奥拉帕利、尼拉帕利或卢卡帕利)维持治疗,特别是BRCA突变者。而既往使用过PARP 抑制剂或复发后用过贝伐珠单抗者再使用PARP 抑制剂的资料有限。
3.2.2 针对卵巢癌患者其他癌症预防 遗传性卵巢癌患者还应根据基因检测结果,进行其他癌种的预防。例如BRCA突变的患者应关注乳腺癌、胰腺癌的预防;LS 相关的卵巢癌患者需重视结肠癌的筛查。
专家共识委员会
名誉组长
季加孚 北京大学肿瘤医院
专家组组长
解云涛 北京大学肿瘤医院
专家组副组长
吴 鸣 北京协和医院
丁培荣 中山大学附属肿瘤医院
贾淑芹 北京大学肿瘤医院
家族遗传性卵巢癌执笔专家
蔡红兵 武汉大学中南医院
吴 鸣 北京协和医院
专家组成员
见《中国肿瘤临床》2021年第48 卷第2 期
秘书组
见《中国肿瘤临床》2021年第48 卷第23 期

