长链非编码RNA SPATA3-AS1在胃癌中的表达及意义
张鹤腾,唐银炳,谢文杰,陆佳伟,汪贝贝,侯雯跻,周晓东,蒋鹏程,于强,张文波,邹晨
(1. 江苏大学医学院,江苏 镇江 212013; 2. 江苏大学附属人民医院普外科,江苏 镇江 212002;3. 江苏大学附属人民医院神经外科,江苏 镇江 212002)
胃癌死亡率高,是癌症相关死亡的第三大常见原因[1]。据国际癌症研究机构编制的2018年全球癌症发病率和死亡率估算数据统计,胃癌发病率为5.7%,死亡率为8.2%[2]。在我国,胃癌已成为男性第二大(13.5%)常见癌症及第三大(15.1%)癌症相关死亡原因、女性第五大(7.1%)常见癌症及第二大(11.1%)癌症相关死亡原因[3-4]。通常早期胃癌无明显症状,约80%患者在确诊时已处于进展期,早期诊断及治疗可以提高50%~70%患者5年生存率[5-6]。
长链非编码RNA (long non-coding RNA, lncRNA)是一类由不同种类的RNA分子组成的不编码或翻译任何蛋白质的长度大于200个核苷酸的功能性RNA分子,在表观遗传、转录和转录后水平均发挥重要的基因调控作用[7]。多种肿瘤的生物学行为与LncRNA功能失调密切相关[8-9],如LncRNA ELFN1-AS1促进卵巢癌细胞的迁移、侵袭[10];LincRNA-ROR/miR-145轴通过靶向ZEB2诱导上皮-间充质转化(EMT),促进肝癌的侵袭和转移[11];LncRNA 91H通过与IGF2BP2相互作用调控IGF2表达,促进结直肠癌发生[12];在胃癌中LncRNA LOC400043通过调节Wnt信号通路抑制胃癌进展[13];LncRNA-ATB[14]、LncRNA HEIH[15]、LncRNA PVT1[16]均在胃癌中表达上调并参与促进胃癌细胞的增殖、迁移、凋亡等;LncRNA AL139147.1在胃癌中呈高表达可促进胃癌细胞增殖[17];LncRNA HIF-1α和ANRIL在胃癌组织和患者血浆中均高表达[18]。
LncRNA SPATA3-AS1是人精子发生相关基因SPATA3的反义RNA,定位于染色体2q37.1,长度为3 526 bp。本课题组通过预实验发现SPATA3-AS1在胃癌组织中的表达明显高于癌旁组织。为进一步研究其在胃癌发生发展中的作用,本研究对80例胃癌及癌旁组织和29例胃癌患者血浆中SPATA3-AS1的表达进行qRT-PCR检测,随后行细胞实验研究SPATA3-AS1对胃癌细胞增殖、迁移及侵袭能力的影响和潜在机制。
1 病例和方法
1.1 研究对象
选择2016年4月至2020年6月期间就诊于江苏大学附属人民医院普外科行胃癌根治术80例患者切除的癌组织与癌旁组织。术后病理检查确诊胃腺癌诊断,选取距肿瘤最远边缘>5 cm的胃组织为对照的癌旁组织。其中,男57例,女23例;年龄47~82岁,中位年龄67岁;肿瘤直径≤5 cm者51例,>5 cm者29例;肿瘤TNM分期Ⅰ~Ⅱ期40例,Ⅲ~Ⅳ期40例;淋巴结转移阴性40例,阳性40例。随机收集上述29例患者清晨空腹肘正中静脉血各5 mL,2 000 r/min室温离心,取500 μL上层血浆于-80 ℃保存备用。另选择同期随机选取的29例健康体检者血浆。男23例,女6例;年龄47~77岁,中位年龄63岁;肿瘤直径≤5 cm者14例,>5 cm者15例;Ⅰ~Ⅱ期10例,Ⅲ~Ⅳ期19例;淋巴结转移阴性10例,阳性19例,本研究通过江苏大学附属人民医院医学伦理委员会同意,所有受试者均签署知情同意书。
1.2 主要试剂
逆转录试剂盒及qRT-PCR试剂盒(海翊圣生物科技有限公司);FITC-Annexin V 及细胞凋亡试剂盒(上海通善生物技术有限公司);Transwell细胞迁移板(美国Corning公司);RPMI 1640培养液(美国Thermo Fisher公司);人胃癌AGS、HGC-27细胞(中国科学院上海生命科学研究院细胞资源中心);胎牛血清(美国Gibco公司);胰蛋白酶(美国Amresco公司);Matrigel基质胶(美国BD公司);RNA提取试剂盒、Trizol均购自上海一基实业有限公司。
1.3 qRT-PCR检测SPATA3-AS1相对表达量
按制Trizol试剂说明书,提取标本、细胞及血浆中总RNA,检测RNA浓度及纯度,参照RNA逆转录试剂盒说明书配制逆转录反应体系。20 μL PCR反应体系:DEPC水8.2 μL、SYBR Premix ExTaqⅡ 10 μL和各0.4 μL上、下游引物、cDNA 1 μL。每个样本设3个复孔,SPATA3-AS1引物系列:上游为5′-CTTAAGGGGTCGCCTGAGTC-3′,下游为5′-GGCAGAAA GAAGCTGCCCTA-3′,以β-肌动蛋白作为组织和细胞的内参基因,以U6作为血浆样本的内参基因,以-ΔCt值、-ΔΔCt值法计算相对表达量;qRT-PCR条件:95 ℃预变性30 s,95 ℃ 5 s,55 ℃退火30 s,40个循环。
1.4 细胞实验
1.4.1 细胞转染及分组 细胞分为si-SPATA3-AS1组及si-NC组。分别在12孔板中接种处于对数生长期的AGS、HGC-27细胞,置于37 ℃、5% CO2培养箱中培养。细胞密度达60%~80%时行转染。按说明使用Lipofectamine 2000试剂对AGS及HGC-27胃癌细胞进行转染,每孔加入上述混合液100 μL及1 mL培养液,置于37 ℃、5% CO2培养箱中培养,待培养48~72 h后回收。si-SPATA3-AS1序列为GCUGCUGGAACUGAAUAAATT,si-NC序列为UUCUCCGAACGUGUCACGUTT。
1.4.2 绘制细胞生长曲线、克隆形成实验检测胃癌细胞增殖水平 绘制细胞生长曲线:取“1.4.1”转染48 h的AGS、HGC-27细胞,胰蛋白酶消化并计数,每组6个复孔,以1×104/孔浓度接种。置于37 ℃、5% CO2培养箱中培养,72 h更换一次培养基,光学显微镜下每天计数1次取平均值。连续计数5 d后进行细胞生长曲线的绘制。细胞克隆形成实验:取“1.4.1”转染48 h的AGS、HGC-27细胞,胰蛋白酶消化,于6孔板中按103个/孔细胞数接种并置于培养箱中培养,每天观察细胞增殖情况。培养约10 d后出现肉眼可见的细胞集落时,用0.5%结晶紫染色15 min并拍照及计数。
1.4.3 Transwell实验检测AGS、HGC-27细胞迁移与侵袭 细胞迁移实验:取“1.4.1”转染48 h的AGS、HGC-27细胞,调整细胞浓度约为1×105/mL。在Transwell 小室,上室每孔接种细胞数为2×104个,并在各对应下室中每孔加入等量含血清培养基,孵育24 h;棉签擦去上室未迁移细胞,细胞用0.5%结晶紫染色15 min并拍照。细胞侵袭实验:将无血清培养基与Matrigel按7 ∶1比例混合稀释;用基质胶以50 μL/孔包被Transwell小室底部膜的上室面后放置于24孔板中,培养箱孵育2 h;余步骤同迁移实验。
1.4.4 流式细胞凋亡实验检测胃癌细胞凋亡水平 取“1.4.1”转染48 h后细胞并重悬,调整细胞密度为2×105/mL,加入FITC-Annexin V和Propidium iodide试剂,暗箱静置15 min,流式细胞仪检测胃癌细胞凋亡数。
1.4.5 qRT-PCR检测敲减SPATA3-AS1后肿瘤相关mRNA表达 按制Trizol试剂说明书,取“1.4.1”转染胃癌细胞,分别提取RNA后逆转录成cDNA,其余步骤同“1.3”。采用2-ΔΔCt法计算相对表达量,每个样本设3个复孔,引物序列见表1。

表1 肿瘤相关基因引物序列
1.5 统计学方法
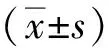
2 结果
2.1 SPATA3-AS1在胃癌组织中表达及与临床病理特征分析
qRT-PCR结果显示,与癌旁组织相比,胃癌组织中SPATA3-AS1相对表达量明显上调(t=2.183,P<0.05)。见图1。根据胃癌组织中qRT-PCR检测结果,取SPATA3-AS1相对表达量的中位数为分界值,将胃癌组织分为SPATA3-AS1高表达组(n=40)和低表达组(n=40)。胃癌组织中SPATA3-AS1相对表达与胃癌患者淋巴结转移(P=0.007)、TNM分期 (P=0.007)及肿瘤浸润深度(P=0.043)相关,而与其他因素无关(P均>0.05)。见表2。Kaplan-Meier分析显示,与低表达组相比,SPATA3-AS1高表达组患者5年生存率明显降低(HR=2.292,95%CI:1.143~4.597,P=0.020)。见图2。
2.2 SPATA3-AS1在血浆中的表达与临床意义
与健康体检者相比,胃癌患者血浆中SPATA3-AS1表达水平显著增高(t=4.156,P<0.05)。见图3。SPATA3-AS1表达与肿瘤TNM分期及淋巴结转移相关(P均<0.05),高表达者具有较多的淋巴结转移及较高的肿瘤TNM分期。见图4。此外,利用ROC曲线评估SPATA3-AS1在血浆中差异表达的敏感性及特异性,其曲线下面积为0.788,提示该指标具有较好的诊断价值。见图5。
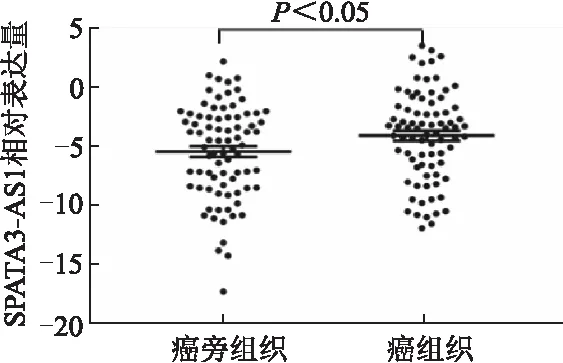
图1 胃癌及癌旁组织中SPATA3-AS1表达水平比较

表2 胃癌患者癌组织中SPATA3-AS1的表达与临床病理特征的关系
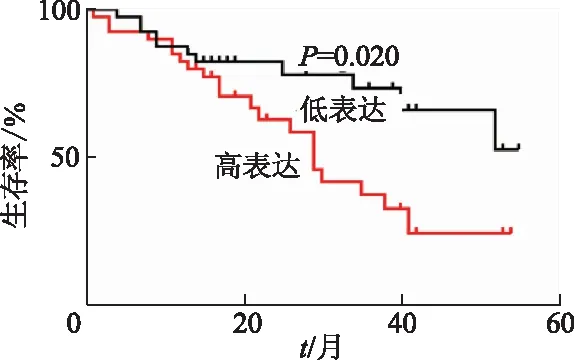
图2 SPATA3-AS1表达水平与胃癌患者生存率的相关性
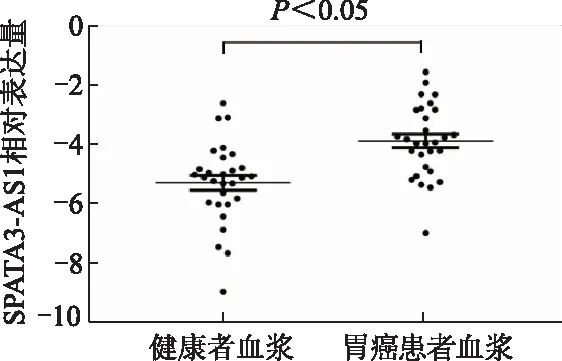
图3 胃癌患者与健康者血浆中SPATA3-AS1相对表达水平比较(n=29)
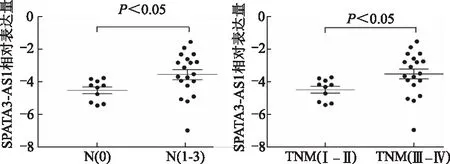
图4 胃癌患者血浆SPATA3-AS1表达与临床病理特征的关系
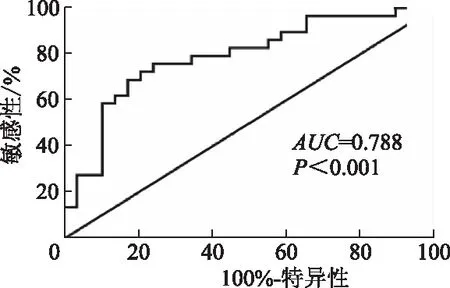
图5 胃癌患者血浆中SPATA3-AS1的ROC曲线
2.3 敲减SPATA3-AS1对细胞增殖、迁移、侵袭及凋亡的影响
2.3.1 敲减SPATA3-AS1对细胞增殖的影响 qRT-PCR结果显示,与si-NC组相比,AGS、HGC-27细胞si-SPATA3-AS1组中SPATA3-AS1表达明显降低(P均<0.01),证实敲减效果满意。见图6。细胞生长曲线结果显示,与si-NC 组相比,AGS、HGC-27细胞中si-SPATA3-AS1组胃癌细胞数分别从第3天及第4天明显减少。见图7。计数及克隆形成实验显示,与si-NC 组相比,AGS、HGC-27细胞中si-SPATA3-AS1组细胞克隆形成率明显降低(P均<0.01),由此表明,敲减SPATA3-AS1抑制AGS、HGC-27细胞增殖。见图8。
2.3.2 敲减SPATA3-AS1对细胞迁移的影响 Transwell实验显示,与si-NC对照组相比,AGS、HGC-27细胞中si-SPATA3-AS1组细胞迁移能力均显著降低(t=10.21,11.08,P均<0.01)。见图9。
2.3.3 敲减SPATA3-AS1对细胞侵袭的影响 Transwell实验显示,与si-NC对照组相比,AGS、HGC-27细胞中si-SPATA3-AS1组细胞侵袭能力显著降低(t=12.88,10.30,P均<0.01)。见图10。
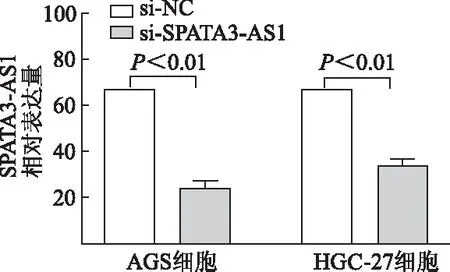
图6 qRT-PCR检测敲减SPATA3-AS1后 AGS、HGC-27细胞中SPATA3-AS1的表达

图7 敲减SPATA3-AS1后AGS和HGC-27细胞的生长曲线
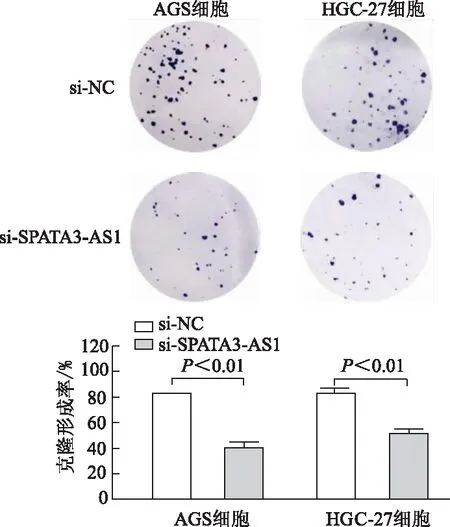
图8 细胞平板克隆形成实验检测各组AGS和HGC-27细胞增殖
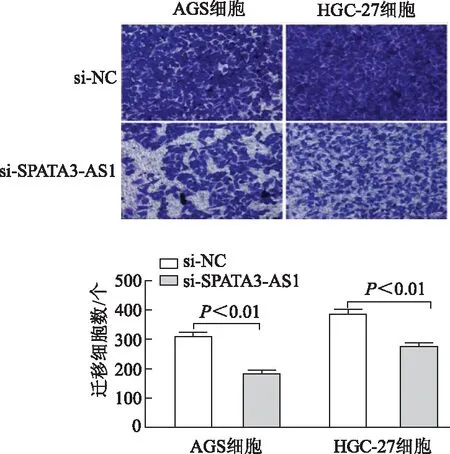
图9 Transwell 实验检测AGS和HGC-27细胞迁移能力

图10 Transwell实验检测AGS和HGC-27细胞侵袭能力
2.3.4 敲减SPATA3-AS1对细胞凋亡的影响 Transwell实验显示,与si-NC对照组相比,AGS、HGC-27细胞si-SPATA3-AS1组细胞凋亡能力均显著升高(t=11.07,9.94,P均<0.01)。见图11。
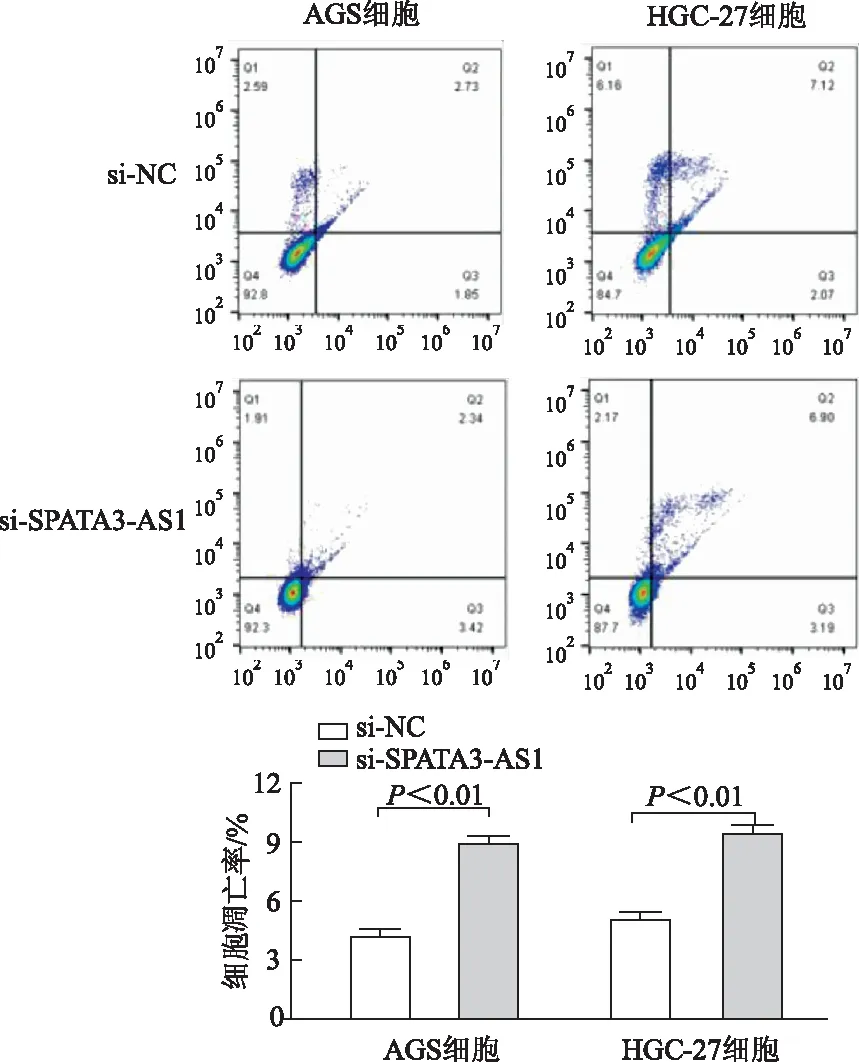
图11 流式细胞仪检测AGS和HGC-27细胞的凋亡
2.4 敲减SPATA3-AS1对肿瘤相关基因mRNA表达的影响
qRT-PCR结果显示,在AGS、HGC-27细胞株中,与si-NC对照组相比,si-SPATA3-AS1组EMT相关标志物发生显著改变,其中间质标志物N-cadmRNA显著下调,同时上皮标志物E-cadmRNA 显著上调,与此同时转录因子Twist1、SnailmRNA表达明显降低(P<0.05或<0.01),而其他相关基因mRNA表达无明显差异。见图12。由此提示,SPATA3-AS1可能通过EMT途径调控胃癌的发生发展。
3 讨论
本研究发现,相较于癌旁组织和健康者血浆,SPATA3-AS1在胃癌患者癌组织和血浆中的表达明显上调,且与肿瘤TNM分期及淋巴结转移相关。其中,高表达SPATA3-AS1患者生存率低于低表达患者,提示SPATA3-AS1可能预测胃癌患者远期生存率。此外,ROC曲线下面积为0.788,提示SPATA3-AS1作为胃癌诊断指标具有较高的价值。体外细胞实验结果表明,相比于阴性对照组,敲减SPATA3-AS1处理后的胃癌细胞侵袭、迁移、增殖能力均降低但细胞凋亡增加,说明SPATA3-AS1促进胃癌的发生发展。
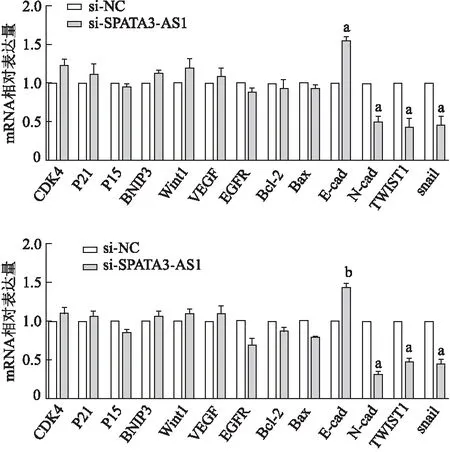
a:P<0.01,b:P<0.05,与si-NC组相比
为进一步研究SPATA3-AS1 在胃癌细胞生物学表型中的调节作用,本研究对肿瘤相关基因进行筛查。qRT-PCR结果显示,敲减SPATA3-AS1显著抑制转录因子Twist1、SnailmRNA和间质标志物N-cadmRNA表达,同时促进上皮标志物E-cadmRNA表达,提示SPATA3-AS1可能通过EMT途径促进胃癌细胞表型恶化。EMT是上皮细胞获得间充质特征的过程,对胚胎发生、伤口愈合及降低癌细胞药物敏感性方面至关重要[19]。EMT在多种恶性肿瘤形成过程中促进癌细胞的迁移、侵袭、转移及其他恶性生物学行为。Twist1、Snail、Slug等转录因子及N-cad、波形蛋白、E-cad等EMT相关基因的显著表达,反映肿瘤细胞活跃的运动能力[20]。LncRNA可通过多种途径调控胃癌EMT过程,如染色质修饰[21]、转录调控[22]、调控mRNA[23]等。本实验结果提示,SPATA3-AS1在胃癌细胞中可能通过上调Twist1、Snail、N-cad表达,下调E-cad表达,促进上皮源性细胞失去细胞极性,细胞黏附能力下降、迁移运动能力增强,导致肿瘤的发生发展和远处转移,其具体机制还待进一步研究。本研究后续拟通过荧光原位杂交技术、细胞质核分离实验进行亚细胞定位,并通过RNA免疫共沉淀等实验探讨其可能的调控分子。
综上所述,SPATA3-AS1在胃癌的EMT过程中发挥重要作用进而影响胃癌进展。其可能通过调控转录因子Twist1、Snail,进而调控间质标志物N-cad及上皮标志物E-cad表达,从而调控胃癌EMT。后续研究将进一步探讨SPATA3-AS1、癌基因与 EMT之间的关系进而阐明SPATA3-AS1在胃癌发生发展中的具体作用机制。

