六点始叶螨内参基因筛选及其在超氧化物歧化酶基因EsSOD表达分析中的应用
梁晓 陈青 伍春玲 方永军

摘 要:為了筛选稳定内参基因分析六点始叶螨超氧化物歧化酶基因EsSOD的表达量,本研究采用geNorm、Bestkeeper、Normfinder和RefFinder软件分析6个候选内参基因actin、gapdh、rpl13、α-tub、β-tub和18sRNA在六点始叶螨幼螨、前若螨、后若螨和雌成螨中的表达稳定性。结果表明,根据geNorm软件分析得出6个候选内参引物的稳定性从大到小的排序为:actin>β-tub>rpl13>α-tub>gapdh>18sRNA;根据NormFinder软件分析得出的稳定性从大到小的排序为:rpl13>β-tub>actin>α-tub>18sRNA>gapdh;根据BestKeeper软件分析得出的稳定性从大到小的排序为:β-tub>rpl13> actin>gapdh>α-tub>18sRNA;最终根据RefFinder软件的综合分析结果,actin和β-tub是稳定性最佳的2个内参引物。分别以actin和β-tub为内参进行EsSOD基因表达量的RT-qPCR分析,结果表明,与取食感螨橡胶树种质‘IAN2904后EsSOD表达量相比,不同龄期六点始叶螨取食抗螨橡胶树种质‘IRCI12后EsSOD表达量均降低。本研究获得了可用于六点始叶螨EsSOD表达量分析的稳定内参引物,为橡胶树种质抗螨性分子机理研究奠定了理论基础。
关键词:六点始叶螨;内参基因;超氧化物歧化酶基因EsSOD;基因表达
中图分类号:S433.5 文献标识码:A
Abstract: In order to screen stable reference genes in analyzing the expression level of Eotetranychus sexmaculatus superoxide dismutase gene EsSOD, six candidate genes, actin, gapdh, rpl13, α-tub, β-tub and 18SRNA, were analyzed for their expression stability in different life stages (i.e., larva, protonymph, deutonymph and female adults) of E. sexmaculatus by using geNorm,Bestkeeper, Normfinder and RefFinder analysis methods. The results showed that according to the geNorm analysis, the stability ranking of the six candidate genes was listed as: actin > β-ub > rpl13 > α-tub > gapdh > 18sRNA, according to the NormFinder analysis, the stability ranking of the six candidate genes was listed as: rpl13 > β-tub > actin > α-tub > 18sRNA > gapdh, according to the BestKeeper analysis, the stability ranking of the six candidate genes was listed as: rpl13 > β-tub > actin > α-tub > 18sRNA > gapdh, the order of the stability of six candidate primers was analyzed by BestKeeper software. The qualitative order from large to small was: β-tub > rpl13 > actin > gapdh > α-tub > 18sRNA. Finally, according to the comprehensive analysis results of Reffinder software, actin and β-tub were the best two reference genes, and were subjected to the subsequent RT-qPCR analysis of EsSOD transcription. The results showed that compared with those feeding on mite-susceptible clutivars IAN2904, the expression of EsSOD in mite feeding on mite-resistant clutivars IRCI12 was decreased. Stable reference genes in analyzing the transcription of EsSOD might provide theoretical basis for the study of molecular mechanism of mite resistance in rubber tree.
Keywords: Eotetranychus sexmaculatus; reference gene; superoxide dismutase gene EsSOD; gene expression
DOI: 10.3969/j.issn.1000-2561.2021.01.024
利用实时荧光定量PCR(real-time fluorescence quantitative PCR, RT-qPCR)方法分析基因相对表达量时,通常需引入一个表达较为稳定的内参基因(reference gene)[1-3]。理想的内参基因应在特定物种的组织、细胞和特定的试验处理下具有稳定的表达水平。在农业害虫(螨)的相关功能基因表达水平研究中,已筛选出许多内参基因并经过表达稳定性的验证[4]。然而,内参基因的选择和确证因物种或实验条件而异[5-6]。因此,要分析特定物种在特定处理下的基因表达水平,仍须进行内参基因的筛选以保证结果的准确性。
天然橡胶是关系到国计民生的重要战略物质,在国防和国民经济建设中具有不可替代的作用[7-8]。六点始叶螨(Eotetranychus sexmaculatus)是危害我国橡胶树最严重的一种世界危险性害螨[9]。当前,各橡胶产区对于该螨的防治仍依赖于化学药剂,但橡胶树高大,药剂难以靶标,防治难度很大,寻求有效的控制橡胶害螨且符合环保要求的新的防治策略和防治方法,成为当前我国天然橡胶产业发展中亟待解决的重要课题。
培育抗性品种是防治橡胶害螨最经济、最有效、最简便的方法,对橡胶树的抗螨机理进行研究可以为抗螨橡胶树品种的培育提供理论基础。前期研究发现抗螨橡胶树种质‘IRCI12能夠抑制六点始叶螨抗氧化酶超氧化物歧化酶(SOD)的活性,而感螨橡胶树种质则不会改变SOD酶的活性[10],迄今为止,由于尚无六点始叶螨内参基因筛选的相关报道,因此也未能进行六点始叶螨抗氧化酶SOD基因表达水平的验证。本研究拟分别采用geNorm、NormFinder和BestKeeper和RefFinder 4种软件[11]用于六点始叶螨取食抗、感螨橡胶树种质后抗氧化酶基因EsSOD[10, 12]表达量变化RT-qPCR分析的内参基因筛选和评价,为深入阐明橡胶树种质抗螨的分子机理提供理论和材料支撑。
1 材料与方法
1.1 材料
1.1.1 供试六点始叶螨 供试六点始叶螨为实验室以感螨参照橡胶树种质‘IAN2904新鲜叶片继代饲养的室内种群。将六点始叶螨雌成螨分别接于橡胶树叶背面,并将叶子放置于长25 cm、宽19 cm的白瓷盘中湿润海绵上方,同时以湿润吸水纸围拢于叶片周围以防止试螨逃离,每隔3~5 d更换叶片以保证材料新鲜。饲养条件为:人工气候箱,温度(25±1)℃,相对湿度为(75±5)%,光照周期14(L)∶10(D)。
1.1.2 供试橡胶树种质 选用遗传稳定的抗螨参照橡胶树种质‘IRCI12和感螨参照橡胶树种质‘IAN2904为试验材料[4]。均由中国热带农业科学院橡胶研究所国家橡胶种质资源圃提供。
1.1.3 供试试剂 RNA提取试剂盒、cDNA合成试剂盒、Mastermix、MaximaTM SYBR Green qPCR Master Mix 试剂盒均为Fermentas公司产品(Fermentas, GlenBurnie, MD)。
1.2 方法
1.2.1 总RNA提取和cDNA第一链合成 总RNA的提取参照Fermentas公司RNA提取试剂盒进行。采用NanoDrop 2000 Spectrophotometer (Thermo, USA)核酸浓度测定仪测定RNA浓度和纯度,OD260/280在1.80~2.20之间表示RNA质量较好,并进一步通过1.0%琼脂糖RNA电泳检测其完整性。采用经gDNA Eraser (Takara Biochemicals, Dalian, China)处理去除基因组DNA后,取1.0 μg RNA用于第一链cDNA的合成。cDNA合成方法参照Fermentas公司的cDNA合成试剂盒进行。RNA和cDNA样品均保存于-70 ℃超低温冰箱中。
1.2.2 六点始叶螨候选内参基因和抗氧化酶基因 本研究初步选择的6个候选内参基因actin、gapdh、rpl13、α-tub、β-tub和18sRNA分别为在其他害虫(螨)研究中已经确定的内参基因[13-15],抗氧化酶基因为EsSOD。上述7个基因的引物根据实验室前期经由RNA-seq测序获得的部分基因序列进行设计,引物和基因序列号等相关信息见表1。
1.2.3 RT-qPCR分析方法 采用Bio-Rad CFX96 TouchTM荧光定量PCR仪(Bio-Rad, USA)运行RT-qPCR程序,反应条件为:95 ℃预变性2 min,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。最后在54~95 ℃进行引物溶解曲线分析,经熔解曲线分析确认所设计的引物无非特异扩增及引物二聚体后,将cDNA模板按照3倍稀释成5个浓度梯度(3?1、3?2、3?3、3?4、3?5)进行标准曲线分析,并根据公式E=[(10(?1/slope)- 1)×100%计算不同引物的扩增效率,同时根据Pfaffl的2?ΔΔCt方法计算基因的相对表达量[16],每个处理3次重复。
1.2.4 候选内参基因的稳定性分析方法 首先采用分析软件geNorm、Normfinder和Bestkeeper并参照Niu等[17]建立的方法分别进行候选内参基因的稳定性排序,然后用RefFinder综合评价上述3种方法的分析结果以避免单个分析方法的片面性,最后根据RefFinder的最终评估结果并结合geNorm分析,可以判定进行特定功能基因RT-qPCR验证所使用的内参个数[18]。
1.2.5 六点始叶螨取食抗、感螨橡胶树种质对抗氧化酶基因表达的影响 将4个不同龄期(幼螨、前若螨、后若螨和成螨)按200头/叶分别接种于抗螨参照橡胶树种质‘IRCI12和感螨参照橡胶树种质‘IAN2904叶背面,饲养方法参照1.1进行,分别于接种后48 h挑取存活的六点始叶螨样品,以1.2.4中筛选得到的稳定性最佳的内参基因,采用RT-qPCR分析(参考1.2.3)抗氧化酶基因EsSOD表达量的变化情况。
2 结果与分析
2.1 候选内参基因表达水平,引物特异性及RT-qPCR扩增效率分析
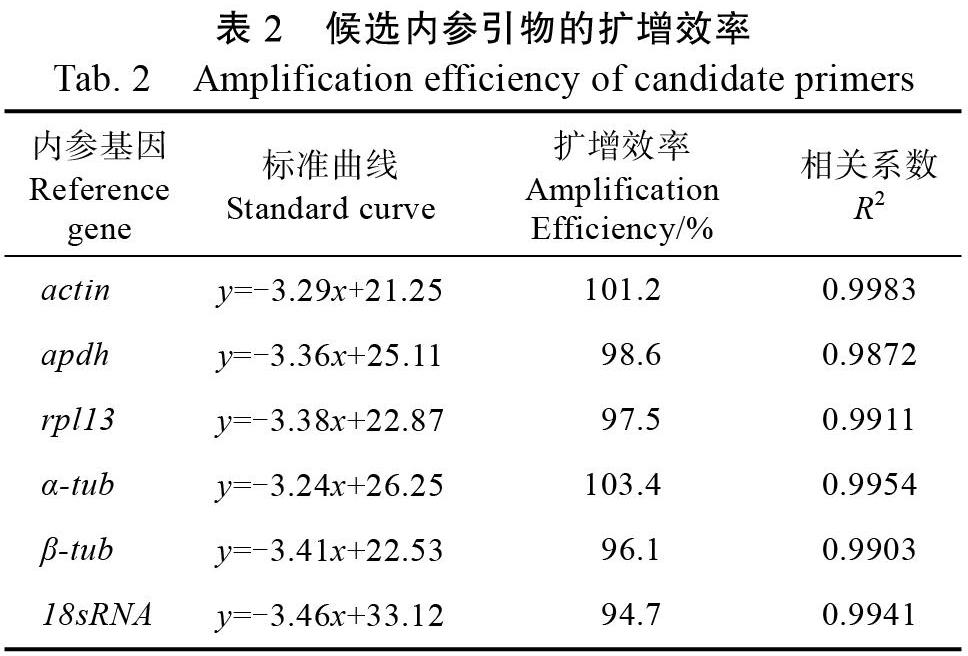
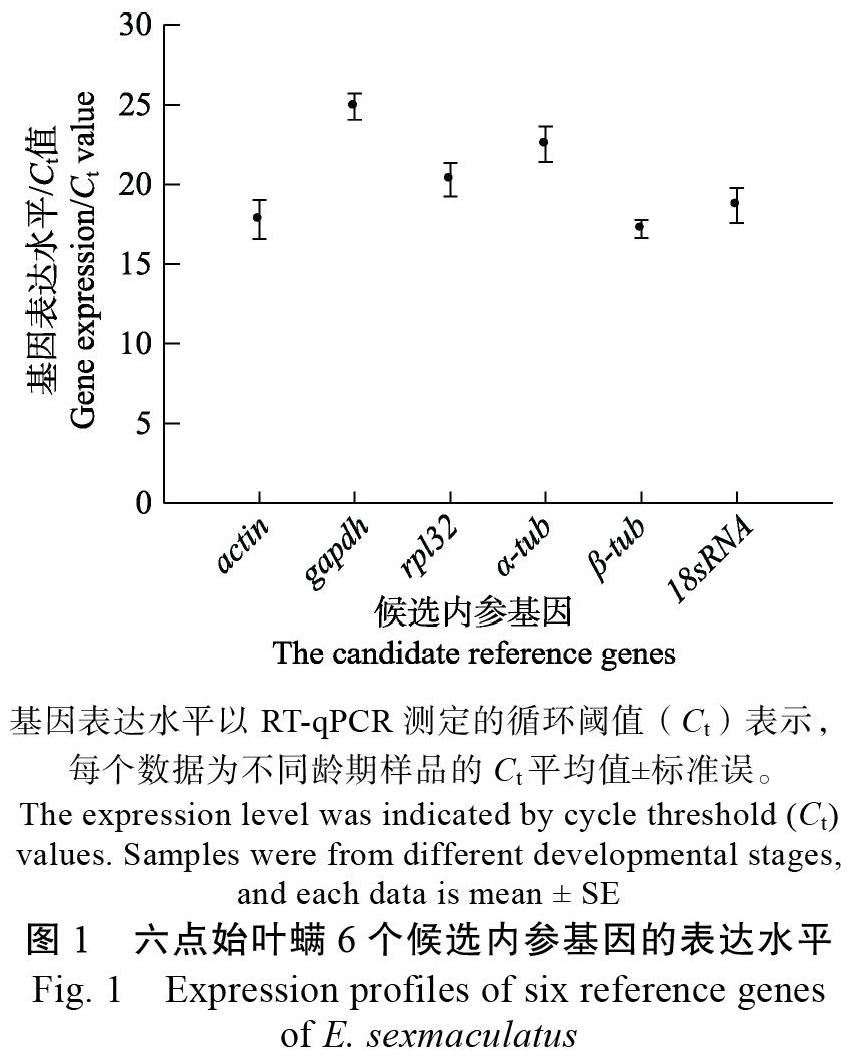
扩增效率分析结果表明,6个候选内参基因的PCR扩增效率在94.7%~103.4%之间,并且相关系数(R2)均大于0.990(表2)。RT-qPCR分析结果表明,6个候选内参基因在六点始叶螨不同龄期的循环阈值(Ct)平均值均低于25.0,并且大部分基因的Ct值均在17~22之间,每个基因在不同龄期的Ct值变化幅度较小(标准差小)。actin和β-tub是表达丰度最高的2个基因,Ct平均值分别为17.8和17.2,而表达丰度最低的基因为gapdh,其Ct平均值为24.9(图1)。
2.2 不同龄期六点始叶螨候选内参基因稳定性分析
表3结果表明,根据△Ct分析方法,在六点始叶螨不同龄期6个候选内参引物的稳定性从大到小的排序为:actin>β-tub>rpl13>18sRNA> gapdh>α-tub,actin是稳定性最好的内参基因;根据geNorm软件分析方法,6个候选内参引物的稳定性从大到小的排序为:actin>β-tub>rpl13>α- tub>gapdh>18sRNA,actin是稳定性最好的内参基因;根据NormFinder软件分析方法,6个候选内参引物的稳定性从大到小的排序为:rpl13> β-tub>actin>α-tub>18sRNA>gapdh,rpl13是稳定性最好的内参基因;根据BestKeeper软件分析方法,6个候选内参引物的稳定性从大到小的排序为:β-tub>rpl13>actin>gapdh>α-tub>18sRNA,β-tub是稳定性最好的内参基因。而最终根据RefFinder软件的综合分析结果,6个候选内参引物的稳定性从大到小的排序为:actin>β-tub> rpl13>α-tub>gapdh>18sRNA,综合来看actin是稳定性最佳的内参引物,并且β-tub的分值与actin十分接近,而18sRNA的稳定性最差(图2)。此外,RefFinder软件结合geNorm软件分析结果还表明,V2/3<0.15(V值表示使用n个和n+1个内参引物对RT-qPCR分析结果影响的两两变异值,以确定不同样本中RT-qPCR数据标准化所需的最佳内参基因个数,当V<0.15时的n值即表示分析使用的最佳内参基因为n个),因此同时使用actin和β-tub 2个基因为内参已完全满足后续RT-qPCR分析的要求(图3)。
2.3 内参基因稳定性验证
分别以2.1中筛选出的actin、β-tub、actin+ β-tub组合作为稳定的内参,同时以18sRNA为不稳定内参,研究不同龄期六点始叶螨取食抗、感螨橡胶树种质后EsSOD基因表达量的变化。结果表明,不同龄期六点始叶螨幼螨取食抗螨橡胶树种质‘IRCI12后,体内EsSOD基因表达量较取食感螨橡胶树种质‘IAN2904均有所下降,其中分别以actin、β-tub、actin+β-tub組合作为内参时,幼螨、前若螨、后若螨和成螨EsSOD基因表达量下降百分率分别为26.3%、33.5%、36.8%和56.2%,25.3%、35.5%、38.2%和51.7%,22.6%、34.9%、37.5%和53.3%(图4),均没有超过58%;而以18sRNA作为内参时,幼螨、前若螨、后若螨和成螨取食抗螨橡胶树种质‘IRCI12后EsSOD基因表达量分别为取食‘IAN2904的58.5%、78.5%、74.9%和88.3%(图4),均在58%以上。上述结果表明,以actin、β-tub、actin+β-tub组合作为内参分析EsSOD基因表达量变化水平可以获得较为一致的结果。
3 讨论
准确稳定的RT-qPCR分析除了需要合理的试验与引物设计之外,试验过程中还应注意确保高的RNA提取质量、高的聚合酶的扩增效率、减少cDNA合成以及PCR准备过程中的操作误差,避免样品污染等因素[19]。此外,选择合适的内参基因也尤为重要。由于受物种和试验处理条件的差异,不存在完全通用的、恒定表达的内参基因。由于迄今为止尚无六点始叶螨内参基因筛选的相关报道,因此课题组选择的6个内参基因均为其他叶螨科(Tetranychidae)研究中常用的或者已经确定的可用于RT-qPCR分析的内参基因。例如杨丽红[20]对柑橘全爪螨的研究结果表明,在不同发育阶段稳定性较好的是RpII,在低温胁迫和高温胁迫下稳定性较好的分别是α-tubulin和RpII。Yang等[21]研究了10个候选内参基因在二斑叶螨不同发育阶段的表达稳定性,结果表明PRL13和v-ATPase是稳定性最佳的2个内参。岳秀利等[22]筛选了8个内参基因[18sRNA, α-tubulin, β-actin, ELF, gapdh, rpl13a, SDHA (succinate dehydrogenase complex, subunit A), TBP (TATA-box- binding protein)]用于二斑叶螨解毒酶基因表达水平的分析,结果表明,α-tubulin的稳定性最好。周兴隆等[23]对二斑叶螨多重抗性品系最优内参基因进行筛选,并应用于CYP392A亚家族基因的表达分析,结果表明,最佳内参基因为EFLn。由此可见,即便针对同一物种,在不同的试验处理下,内参基因的选择也有较大的差异,因此,必须根据不同的试验对象、试验目的和试验条件选择合适的内参基因。
当前用于内参稳定性评价的3种主流软件分别是geNorm、NormFinder和BestKeeper。本研究中3种软件评价结果存在一定的差异,geNorm分析得出actin是稳定性最好的内参,NormFinder分析得出rpl13是稳定性最好的内参,BestKeeper分析获得β-tub是稳定性最好的内参。最终应用RefFinder整合geNorm、NormFinder和BestKeeper的分析结果,最终得出actin和β-tub是稳定性最好的2个内参。分别以这2个内参单独使用、同时使用验证不同龄期六点始叶螨取食抗、感螨橡胶树品种后EsSOD基因的表达水平,发现actin、β-tub内参无论单独或组合分析均表明EsSOD基因表达量在害螨取食抗螨种质时均低于取食感螨种质,并且均低于采用稳定性最差的内参18sRNA分析获得的结果。前期研究表明,不同龄期六点始叶螨取食抗螨橡胶树品种‘IRCI12后体内SOD酶活性相比取食感螨橡胶树品种‘IAN2904显著降低[10],本研究中分析得到的EsSOD基因表达变化趋势与之前的酶活变化趋势具有一致性,可为橡胶树种质抗螨性分子机理研究奠定理论基础。
参考文献
Yoo W G, Kim T I, Li S, et al. Reference genes for quantitative analysis on Clonorchis sinensisgene expression by real-time PCR[J]. Parasitology Research, 2009, 104(2): 321-328.
Haller F, Kulle B, Schwager S, et al. Equivalence test in quantitative reverse transcription polymerase chain reaction: Confirmation of reference genes suitable for normalization[J]. Analytical Biochemistry, 2004, 335(1): 1-9.
Ransbotyn V, Reusch T B H. Housekeeping gene selection for quantitative real-time PCR assays in the seagrass Zostera marina, subjected to heat stress[J]. Limnology & Oceanography Methods, 2006, 4(10): 367-373.
陈 芳, 陆永跃. 热胁迫下棉花粉蚧内参基因的筛选[J]. 昆虫学报, 2014, 57(10): 1146-1154.
Bo-Ra Kim, Hee-Young Nam, Soo-Un Kim, et al. Normalization of reverse transcription quantitative-PCR with house keeping genes in rice[J]. Biotechnology Letters, 2003, 25(21): 1869-1872.
Marum L, Miguel A, Ricardo C P, et al. Reference gene gelection for quantitative real-time PCR normalization in Quercus suber[J]. PLoS One, 2012, 7(4): e35113.
孙晓艷. 橡胶产业海内外发展的优劣势分析——以广东农垦为例[J]. 中国农垦, 2019(3): 39-42.
佘时英. 2008年我国天然橡胶产业状况与形势分析[J]. 世界热带农业信息, 2008(8): 11-14.
张方平, 朱俊洪, 李 磊, 等. 不同生长期橡胶叶对六点始叶螨选择性及种群增长影响[J]. 热带作物学报, 2016, 37(1): 153-157.
Lu F P, Chen Z S, Lu H, et al. Effects of resistant and susceptible rubber germplasms on development, reproduction and protective enzyme activities of Eotetranychus sexmaculatus (Acari: Tetranychidae)[J]. Experimental & Applied Acarology, 2016, 69(4): 427-443.
Pfaffl M W, Tichopad A, Prgomet C, et al. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper-Excel-Based tool using pair-wise correlations[J]. Biotechnology Letters, 2004, 26(6): 509-515.
张会英. 橡胶树种质抗螨性及其机理研究[D]. 海口: 海南大学, 2014.
Sun W, Jin Y, He L, et al. Suitable reference gene selection for different strains and developmental stages of the carmine spider mite, Tetranychus cinnabarinus, using quantitative real-time PCR[J]. Journal of Insect Science, 2010, 10(4): 1-12.

