取代苯基甲醛类脱氢枞酰腙化合物的合成及其体外抑菌活性研究
伍 勇,黄春花,徐 静
(四川卫生康复职业学院药学系,四川 自贡 643000)
酰腙类化合物是由酰肼与醛酮经分子间缩合得到的一类化合物,含有-CONHN=CH-基团,具有潜在的杀菌[1-6]、杀虫[7-8]等生物活性,受到研究者的广泛关注。脱氢枞酸是松香树脂酸系列产品,其氢化菲结构中因有多个手性碳原子,故被视为生物医药领域不可或缺的天然原料之一。作者以脱氢枞酸为起始原料,对其主要结构进行化学修饰,经酰卤化、亲核取代、脱水缩合等3步反应,合成6个取代苯基甲醛类脱氢枞酰腙化合物,通过IR、1HNMR对其结构进行表征,并对其进行体外抑菌活性评价。合成路线如图1所示。
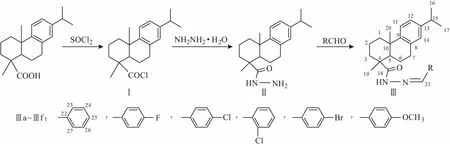
图1 取代苯基甲醛类脱氢枞酰腙化合物的合成路线
1 实验
1.1 试剂与仪器
脱氢枞酸,浙江万安塑料有限公司;其它试剂均为市售分析纯或化学纯。
X-4型数显双目显微熔点测定仪(温度计未经校正),巩义予华仪器有限责任公司;AV-400型核磁共振波谱仪(DMSO为溶剂,TMS为内标),美国Bruker公司;Nicolet iS 10型傅立叶变换红外光谱仪(KBr压片),美国Thermo Fisher公司。
1.2 合成方法
1.2.1 脱氢枞基酰氯(Ⅰ)的合成
取50 g(167 mmol)脱氢枞酸置于250 mL四口烧瓶中,加入75 mL CH2Cl2,搅拌溶解,逐滴加入18.5 mL二氯亚砜(SOCl2)溶液,40~45 ℃下搅拌5 h(TLC跟踪),冷却后减压蒸除溶剂,得棕色油状脱氢枞基酰氯(Ⅰ)。
1.2.2 脱氢枞基酰肼(Ⅱ)的合成
取10 mmol脱氢枞基酰氯置于250 mL四口烧瓶中,加入100 mL四氢呋喃,搅拌溶解,然后加入12 mmol 80%水合肼、10 mmol无水Na2CO3,常温下搅拌3 h(TLC跟踪),过滤,滤液减压蒸馏得白色固体,再用无水乙醇-四氢呋喃混合液(体积比1∶1)重结晶,得白色粉末脱氢枞基酰肼(Ⅱ),收率80.3%。
1.2.3 取代苯基甲醛类脱氢枞酰腙化合物(Ⅲ)的合成
取10 mmol脱氢枞基酰肼置于250 mL四口烧瓶中,加入50 mL四氢呋喃,搅拌溶解,逐滴加入10 mmol 取代苯基甲醛,加热搅拌回流3 h(TLC跟踪),冷却,乙醇重结晶,得取代苯基甲醛类脱氢枞酰腙化合物(Ⅲ)。
1.3 体外抑菌实验
供试菌株:金黄色葡萄球菌(Staphylococcusaureus)ATCC 29123、粪肠球菌(Enterococcusfaecalis)ATCC 29212、肺炎链球菌(Streptococcuspneumoniae)ATCC 49619、铜绿假单胞菌(Pseudomonasaeruginosa)ATCC 27853、大肠埃希菌(Escherichiacoli)ATCC 25922、阴沟肠杆菌(Enterobactercloacae)ATCC 700323等均由自贡市第四人民医院微生物室提供。
采用琼脂二倍稀释法体外测定目标化合物Ⅲ的最低抑菌浓度(MIC)。以N,N-二甲基甲酰胺(DMF)为溶剂、无菌水为稀释液,35 ℃孵育20~24 h,观察菌株生长状况。
2 结果与讨论
2.1 合成工艺分析
(1)反应原料脱氢枞酸来源丰富。
(2)试剂的选择。反应所需试剂简单易得,反应条件温和,操作简便。脱氢枞基酰氯(Ⅰ)的合成过程中加入SOCl2试剂,经酰卤化反应后均以SO2、HCl气体释放,且SOCl2沸点78 ℃,易于减压分离。脱氢枞基酰肼(Ⅱ)和目标化合物Ⅲ的合成过程中使用四氢呋喃为溶剂,由于四氢呋喃与水互溶,可快速吸收缩合反应释放的水,利于反应的进行。
(3)酰肼结构(-CO-NHNH2)中氮原子作为亲核试剂,因羰基吸电子效应,使得亲核氮原子作用减弱,反应收率会受到一定影响。
2.2 结构表征
合成得到的6个取代苯基甲醛类脱氢枞酰腙化合物Ⅲa~Ⅲf的IR、1HNMR数据如下:
脱氢枞基苯甲酰腙(Ⅲa):白色固体,m.p.179~180 ℃,收率58.3%;IR,ν,cm-1:3 272,2 955,2 931,2 857,1 654,1 601,1 494,1 468,1 383,819;1HNMR,δ:9.59(m,1H,NH),7.58(m,1H,21-H),7.19~7.12(m,3H,11-H,24-H,26-H),6.99(m,1H,12-H),6.88(d,1H,J=3.2 Hz,14-H),6.73~6.70(m,3H,23-H,25-H,27-H),2.89~2.75(m,3H,7-H,15-H),2.16(d,1H,J=12.5 Hz,5-H),1.81~1.42(m,8H,1-H,2-H,3-H,6-H),1.26(s,3H,20-H),1.18~1.16(m,9H,16-H,17-H,19-H)。
脱氢枞基对氟苯甲酰腙(Ⅲb):白色固体,m.p.185~189 ℃,收率53.1%;IR,ν,cm-1:3 258,2 956,2 928,2 868,1 669,1 619,1 497,1 460,1 383,1 232,820;1HNMR,δ:9.51(m,1H,NH),7.46(m,1H,21-H),7.18~7.12(m,3H,11-H,24-H,26-H),6.99(m,1H,12-H),6.88(d,1H,J=3.4 Hz,14-H),6.63~6.58(m,2H,23-H,27-H),2.89~2.75(m,3H,7-H,15-H),2.13(d,1H,J=12.6 Hz,5-H),1.84~1.42(m,8H,1-H,2-H,3-2H,6-H),1.25(s,3H,20-H),1.19~1.16(m,9H,16-H,17-H,19-H)。
脱氢枞基对氯苯甲酰腙(Ⅲc):黄色固体,m.p.213~214 ℃,收率63.7%;IR,ν,cm-1:3 298,2 996,2 942,2 868,1 675,1 624,1 485,1 401,1 312,1 089,825;1HNMR,δ:9.57(m,1H,NH),7.53(m,1H,21-H),7.19~7.11(m,3H,11-H,24-H,26-H),6.95(m,1H,12-H),6.88(d,1H,J=2.9 Hz,14-H),6.74~6.71(m,2H,23-H,27-H),2.84~2.72(m,3H,7-H,15-H),2.14(d,1H,J=12.2 Hz,5-H),1.81~1.44(m,8H,1-H,2-H,3-H,6-H),1.22(s,3H,20-H),1.18~1.14(m,9H,16-H,17-H,19-H)。
脱氢枞基邻氯苯甲酰腙(Ⅲd):白色固体,m.p.176~177 ℃,收率58.3%;IR,ν,cm-1:3 271,2 956,2 929,2 868,1 670,1 620,1 497,1 460,1 383,1 173,820;1HNMR,δ:9.58(m,1H,NH),7.55(m,1H,21-H),7.20~7.13(m,3H,11-H,24-H,27-H),6.93(m,1H,12-H),6.86(d,1H,J=3.0 Hz,14-H),6.78~6.73(m,2H,25-H,26-H),2.85~2.74(m,3H,7-H,15-H),2.16(d,1H,J=12.7 Hz,5-H),1.88~1.47(m,8H,1-H,2-H,3-H,6-H),1.22(s,3H,20-H),1.19~1.16(m,9H,16-H,17-H,19-H)。
脱氢枞基对溴苯甲酰腙(Ⅲe):黄色固体,m.p.227~229 ℃,收率73.5%;IR,ν,cm-1:3 247,2 995,2 941,2 868,1 669,1 624,1 481,1 398,1 174,823;1HNMR,δ:9.61(m,1H,NH),7.59(m,1H,21-H),7.41~7.38(m,3H,11-H,24-H,26-H),7.06(m,1H,12-H),6.93(d,1H,J=3.1 Hz,14-H),6.83~6.75(m,2H,23-H,27-H),2.88~2.74(m,3H,7-H,15-H),2.14(d,1H,J=12.1 Hz,5-H),1.83~1.42(m,8H,1-H,2-H,3-H,6-H),1.25(s,3H,20-H),1.18~1.16(m,9H,16-H,17-H,19-H)。
脱氢枞基对甲氧基苯甲酰腙(Ⅲf):黄色固体,m.p.175~176 ℃,收率78.8%;IR,ν,cm-1:3 268,2 967,2 928,2 838,1 624,1 601,1 507,1 461,1 301,1 166,1 024,832;1HNMR,δ:9.63(m,1H,NH),7.59(m,1H,21-H),7.22~7.14(m,3H,11-H,24-H,26-H),7.08(m,1H,12-H),6.98(d,1H,J=3.2 Hz,14-H),6.93~6.90(m,2H,24-H,27-H),2.89~2.85(m,3H,7-H,15-H),2.17(d,1H,J=12.4 Hz,5-H),1.83~1.44(m,8H,1-H,2-H,3-H,6-H),1.28(s,3H,20-H),1.21~1.18(m,9H,16-H,17-H,19-H)。
化合物Ⅲa~Ⅲf的IR图谱中:3 298~3 247 cm-1处为酰腙结构N-H吸收峰,2 955 cm-1、2 931 cm-1、2 857 cm-1处为脱氢枞基-CH3、-CH2-吸收峰,1 660 cm-1、1 620 cm-1处为酰腙结构C=O、C=N特征吸收峰;化合物Ⅲa~Ⅲf的1HNMR图谱中:δ9.63~δ9.51处为CO-NH氢原子吸收峰,δ7.59~δ7.46处为N=CH氢原子吸收峰,δ7.41~δ6.58处为苯环氢原子吸收峰。结合IR图谱中其它吸收波数以及1HNMR图谱中各特征基团的吸收峰,可以确定所合成产物为目标化合物取代苯基甲醛类脱氢枞酰腙化合物。
2.3 体外抑菌活性
体外抑菌实验结果表明,目标化合物Ⅲa~Ⅲf对金黄色葡萄球菌、粪肠球菌、肺炎链球菌、铜绿假单胞菌、大肠埃希菌、阴沟肠杆菌等6株菌株的抑菌活性均较弱,化合物Ⅲa、Ⅲc、Ⅲf的最低抑菌浓度均为128 μg·mL-1,化合物Ⅲb、Ⅲd、Ⅲe的最低抑菌浓度均大于128 μg·mL-1。
3 结论
以脱氢枞酸为起始原料,经酰卤化、亲核取代、脱水缩合等3步反应合成了取代苯基甲醛类脱氢枞酰腙化合物(Ⅲa~Ⅲf),6种化合物对金黄色葡萄球菌、粪肠球菌、肺炎链球菌、铜绿假单胞菌、大肠埃希菌、阴沟肠杆菌等6株菌株的抑菌活性均较弱,其中化合物Ⅲa、Ⅲc、Ⅲf的最低抑菌浓度均为128 μg·mL-1。该方法具有反应条件温和、操作简便、产物易分离等优点。

