microRNA⁃449a通过调控MDM4抑制神经母细胞瘤生长
程 涛,张 生,姚 远,张向宁,张爱辉,侯崇智
西安市儿童医院普外一科,陕西 西安 710002
神经母细胞瘤是儿童最常见的实体肿瘤。由于现有针对神经母细胞瘤的治疗方法对于高风险神经母细胞瘤患者的治愈率只有30%。因此,高风险的神经母细胞瘤是儿童主要的肿瘤相关致死原因[1-3]。神经母细胞瘤起源于神经嵴,通常易发于肾上腺髓质或椎旁神经结,以颈部、胸部、腹部和骨盆肿块为特征。然而,神经母细胞瘤的临床表现高度不一致,可仅表现为肿块而无症状,也可由于局部浸润或广泛转移而造成不良预后[4]。因此,对神经母细胞瘤病理发生和分子机制的进一步研究可以帮助我们发现新的治疗策略从而有效控制神经母细胞瘤。
microRNA(miRNA)是内源表达的小型非编码RNA,大量研究表明miRNA 在肿瘤发生中发挥重要作用[5-6]。miR⁃449a 在许多肿瘤中发挥肿瘤抑制因子的功能,包括视网膜母细胞瘤、肺癌、前列腺癌等[7-9]。近期,有文献报道miR⁃449a 可以通过诱导细胞分化和细胞周期阻滞进而抑制神经母细胞瘤[10]。但是miR⁃449a 在神经母细胞瘤中是否存在其他作用机制仍不清楚。
MDM2 和MDM4 含有相似的蛋白结构,都包含1 个锌指结构域、1个与p53 N 端相连的N端结构域以及C 端的RING(really interesting new gene)结构域。MDM2 和MDM4 均被报道对p53 发挥抑制作用。MDM2 的作用机制已被广泛研究,主要是通过与p53直接结合抑制其转录因子活性及促进p53的泛素化降解。MDM4主要是通过调节p53的活性发挥作用,协同MDM2发挥其泛素蛋白酶活性[11]。文献报道MDM4在早期胚胎发育过程中可以负向调控由p53 诱导的细胞周期阻滞和神经细胞凋亡[12],然而MDM4在神经母细胞瘤的作用机制仍有待探索。本研究分析了miR⁃449a 对神经母细胞瘤细胞凋亡的影响,并评价了miR⁃449a 对肿瘤细胞生长、细胞凋亡和相关基因表达的调控。
1 材料和方法
1.1 材料
人神经母细胞瘤细胞株BE(2)⁃C购于中国科学院上海生命科学研究所。DMEM 培养基、胎牛血清(Gibco 公司,美国);青霉素和胰酶、BeyoRTTM2 cD⁃NA 第一链合成试剂盒、PMSF、BCA 蛋白定量试剂盒、CCK⁃8 试剂盒、Annexin V⁃FITC 细胞凋亡试剂盒、考马斯亮蓝染色液(上海碧云天公司);miR⁃449a模拟物、抑制物和p53干扰质粒(上海吉玛生物有限公司)。TRIzol 试剂(Invitrogen 公司,美国);SYBR Green PCR Master Mix(TaKaRa 公司,日本);荧光素酶活性检测试剂盒(Promega 公司,美国);所有抗体均购自美国Abcam公司。
1.2 方法
1.2.1 细胞培养
人神经母细胞瘤细胞株BE(2)⁃C 培养基为DMEM加10%胎牛血清,1%青霉素和胰酶。细胞置于含5%CO2培养箱,37 ℃培养。细胞培养液每2 d更换1次。所有实验都采用对数生长期细胞进行。
1.2.2 实时荧光定量PCR(qPCR)
用TRIzol 试剂提取总RNA 并使用广谱分析仪确定RNA 质量,随后使用cDNA 第一链合成试剂盒将RNA逆转录为cDNA,采用SYBR Green PCR Mas⁃ter Mix 和应用生物系统7500 实时PCR 系统进行定量聚合酶链反应,PCR 引物通过Premier3.0 软件进行设计并通过上海生工合成。引物序列为:MDM4,上游5′⁃AGGTCCAGCCTAGATGTTTC⁃3′,下游5′⁃AGGTCCAGCCTAGATGTTTC⁃3′;β⁃actin,上游5′⁃CCTGGCACCCAGCACAAT⁃3′,下游5′⁃GGGCCG⁃GACTCGTCATAC⁃3′。反应条件为:95 ℃10 min;95 ℃,15 s;60 ℃,45 s,40个循环;95 ℃,15 s;60 ℃,1 min;95 ℃,15 s;60 ℃,15 s。基因相对表达水平根据公式2-ΔCT进行计算。
1.2.3 CCK⁃8试验
于实验前日接种细胞3 000 个/孔(对照组和转染miR⁃449a模拟物组)于96孔培养板中。将培养板放入培养箱培养过夜(37 ℃、5%CO2)。培养次日,去除培养液并向培养板中加入100 μL CCK⁃8检测溶液(包含90 μL培养基和10 μL CCK⁃8),培养1 h。随后测定450 nm处吸光度值。
1.2.4 克隆形成试验
接种3 000 个处理后的细胞(对照组和转染miR⁃449a 模拟物组)于6 孔培养板中。将培养板放入37 ℃,5%CO2的培养箱中继续培养3周,每3 d更换1次培养液。3周后将培养液吸出加入4%多聚甲醛固定15 min。然后去除固定液,加适量考马斯亮蓝染液染色20 min,然后用流水缓慢洗去染色液,空气干燥后拍照、计数。
1.2.5 荧光素酶活性分析
根据预测结果,分别将野生型和突变型MDM4基因的3′UTR区域克隆到pGL3载体中,并将载体和miR449a的模拟物一同转染至BE(2)⁃C细胞中。荧光素酶活性检测利用荧光素酶活性检测试剂盒来完成。转染48 h 后,吸取培养液,用磷酸盐缓冲液(PBS)洗2 次。6 孔板每孔加入260 μL 裂解液并用刮子将细胞收集到1.5 mL 离心管中,12 000 r/min,4 ℃离心15 min后收集上清。将100 μL细胞裂解液加到96孔板中,然后每孔加入100 μL底物,迅速混匀后在发光仪上读取数值。
1.2.6 流式细胞术检测细胞凋亡
将处理后的细胞(对照组、转染MDM4 过表达质粒组、转染miR⁃449a 模拟物组、同时转染MDM4过表达质粒和miR⁃449a模拟物组)用不含EDTA 的胰酶消化收集后,室温条件下,2 000 r/min 离心5~10 min,收集细胞。用预冷1×PBS(4 ℃)重悬细胞1 次,2 000 r/min 离心5~10 min,洗涤细胞;加入300 μL 的1×Binding Buffer 悬浮细胞;加入5 μL Annexin V⁃FITC混匀后,避光,室温孵育15 min;上机前5 min 再加入5 μL PI 染色;上机前,补加200 μL 1×Binding Buffer。流式细胞仪检测。
1.2.7 免疫印迹实验
总细胞蛋白通过标准流程提取和定量。BE(2)⁃C细胞加入添加了蛋白酶抑制剂和PMSF 的RIPA 试剂,置于冰上30 min,13 000g4 ℃离心15 min 后收集上清。采用BCA 试剂盒测定蛋白浓度。取等量蛋白加入SDS⁃PAGE 胶并将样品转移至PVDF 膜上。将膜置于5%脱脂奶粉溶液于室温孵育2 h。随后4 ℃孵育一抗MDM4(1∶1 000)、MDM2(1∶1 000)、p53(1∶1 000)、cleaved PARP(1∶2 000)、GAPDH(1∶1 000)过夜。
1.3 统计学方法
采用SPSS10.0 统计软件进行分析。数据以均数±标准差()表示,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR⁃449a 过表达抑制BE(2)⁃C 细胞增殖和克隆形成
将miR⁃449a模拟物转染到BE(2)⁃C细胞中,转染48 h后收取细胞qPCR检测miR⁃449a表达量。由图1A可见,转染miR⁃449a模拟物后,miR⁃449a表达量显著升高,说明miR⁃449a模拟物达到了过表达miR⁃449a的目的。随后发现过表达miR⁃449a会显著抑制BE(2)⁃C细胞增殖(图1B),降低细胞克隆形成能力,对照组克隆数目为(684±25)个,而转染miR⁃449a模拟物组克隆数目为(114±23)个(图1C、D)。
2.2 MDM4是miR⁃449a的靶基因

图1 miR⁃449a过表达抑制BE(2)⁃C细胞增殖和克隆形成Figure 1 miR⁃449a overexpression inhibits cell proliferation and colony formation in BE(2)⁃C cell line
为了研究miR⁃449a的作用机制,运用在线数据库miRDB 预测miR⁃449a 的靶基因。结果发现在评分为100 的预测靶基因中,存在1 个p53 调节基因MDM4。于是运用荧光素酶表达系统验证MDM4是否为miR⁃449a 的靶基因。如图2A 和2B 所示,将包含2个预测位点的MDM4野生型(MDM4⁃WT)3′UTR区域克隆到荧光素酶报告质粒pGL3 中,并同时构建针对2 个位点的突变型(MDM4⁃mut1、MDM4⁃mut2、MDM4⁃mut1⁃2)质粒。荧光素酶结果显示,与空载组相比,miR⁃449a 过表达显著降低转染了MDM4野生型和突变型质粒组的荧光素酶活性。另外,与转染MDM4野生型质粒组相比,转染MDM4突变质粒后荧光素酶活性显著升高(图2C)。接下来将miR⁃449a 的模拟物转染到细胞中,检测MDM4 mRNA 和蛋白水平的变化。结果显示,转染miR⁃449a 后MDM4 的表达水平均降低(图2D、E)。因此可以得出结论,MDM4是miR⁃449a的1个靶基因。
2.3 干扰MDM4 表达可以显著降低BE(2)⁃C 细胞增殖和克隆形成能力
为了研究miR⁃449a 的靶基因MDM4 对于神经母细胞瘤的作用,从而进一步阐明miR⁃449a的作用机制,本研究合成MDM4 的siRNA 并将siMDM4 和miR⁃449a模拟物分别或同时转染BE(2)⁃C细胞。
通过CCK⁃8法检测了细胞24、48及72 h的增殖情况。如图3A所示,siMDM4和miR⁃449a模拟物均可显著抑制BE(2)⁃C细胞增殖,并且siMDM4和miR⁃449a模拟物对于BE(2)⁃C细胞增殖抑制效果近似,同时转染miR⁃449a 和siMDM4 没有表现出叠加效应。该结果进一步表明,miR⁃449a 通过调控MDM4从而抑制BE(2)⁃C细胞增殖。
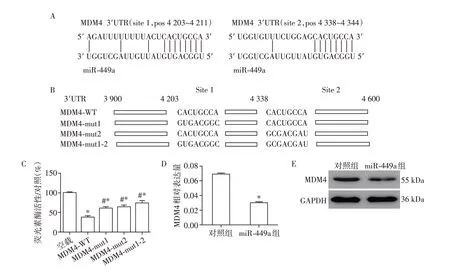
图2 MDM4是miR⁃449a的靶基因Figure 2 MDM4 is a target gene of miR⁃449a
克隆形成试验结果显示,siMDM4 和miR⁃449a模拟物均可显著抑制BE(2)⁃C 细胞克隆形成,并且siMDM4 和miR⁃449a 模拟物抑制效果近似;同时转染miR⁃449a和siMDM4组克隆形成能力与分别转染siMDM4 或miR⁃449a 模拟物没有显著差别(图3B、C)。上述结果表明,miR⁃449a通过调控MDM4从而抑制BE(2)⁃C细胞增殖和克隆形成。
2.4 过表达MDM4 可以抵消由转染miR⁃449a 模拟物所引起的细胞凋亡和p53蛋白量的增加

图3 干扰MDM4表达抑制肿瘤细胞增殖和克隆形成Figure 3 Silencing of MDM4 inhibits cell proliferation and colony formation in BE(2)⁃C cell line
为了进一步验证上述结论,单独或共同转染miR⁃449a模拟物和MDM4过表达质粒后,观察细胞增殖能力的变化。结果显示,与对照组相比,单独转染MDM4过表达质粒会增加细胞增殖能力,单独转染miR⁃449a可以降低细胞增殖能力,但是同时转染miR⁃449a 和MDM4 会对由转染miR⁃449a 导致的细胞增殖能力的降低起到一定的恢复作用(图4A)。此外,在转染miR⁃449a 模拟物的细胞中高表达MDM4 可以抵消由转染miR⁃449a 导致的细胞凋亡增加(细胞凋亡率为:对照组2.63%±1.02%,MDM4 组1.70%±0.50%,miR⁃449a 组36.10%±1.68%,MDM4+miR⁃449a 组6.13%±0.90%)以及p53蛋白水平的上升(图4B~D)。
接下来检测了p53 的mRNA 水平的变化,并且观察到单独转染miR⁃449a并不影响p53 mRNA水平(图4E)。该结果提示miR⁃449a 应该是通过调控MDM4进而对p53的蛋白水平进行调控。如图4F所示,过表达MDM4可以降低p53蛋白水平,但是蛋白酶体抑制剂MG132 处理可以部分阻止p53 的降解。因此我们认为MDM4 通过调控p53蛋白的稳定性而非mRNA水平发挥作用。
2.5 miR⁃449a 通过调控MDM4 稳定p53 蛋白水平从而促进细胞凋亡
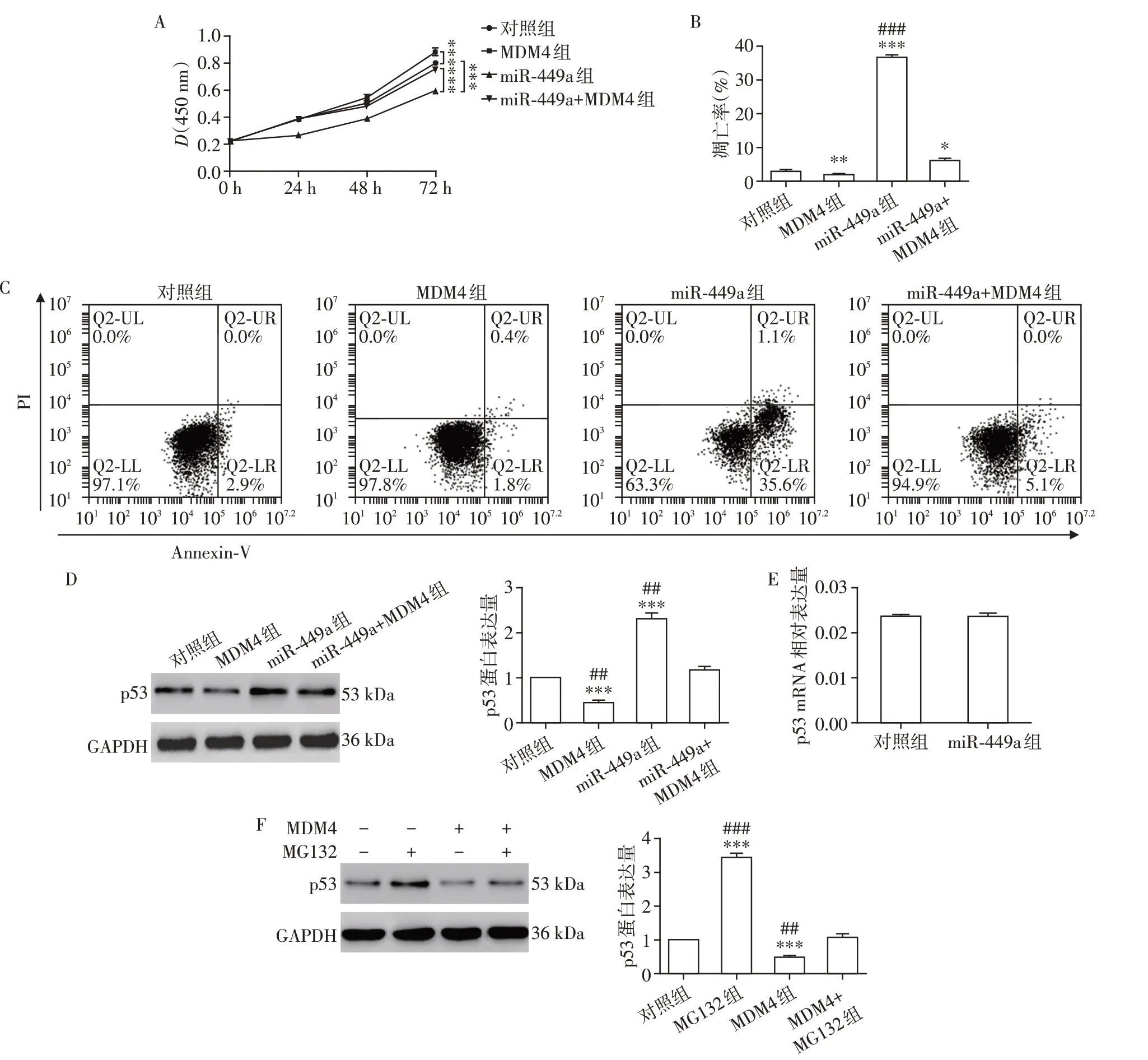
图4 过表达MDM4可以抵消由转染miR⁃449a所引起的细胞凋亡和p53蛋白量的增加Figure 4 Overexpression MDM4 blocks the increase of cell apoptosis and the protein level of p53 induced by miR⁃449a transfection
为了进一步阐明miR⁃449a 抑制神经母细胞瘤增殖的分子机制,我们将miR⁃449a 模拟物转染BE(2)⁃C 细胞并通过流式细胞术检测细胞凋亡情况,通过免疫印迹法检测凋亡相关指标的变化。如图5A、B 所示,miR⁃449a 显著增加BE(2)⁃C 细胞凋亡,凋亡率由(3.00±1.32)%增加至(38.20±2.78)%。miR⁃449a 显著下调MDM4 蛋白水平并上调p53 蛋白水平。p53上调导致细胞凋亡分子cleaved PARP 上调(图5C)。为了进一步证明p53在此中的作用,我们构建p53 低表达的稳定细胞株[shp53 BE(2)⁃C]并用此细胞株进行上述实验,结果证明在shp53 BE(2)⁃C 细胞中miR⁃449a 不能促进细胞凋亡,凋亡率由(3.33±1.20)%增加至(4.26±0.55)%,差异无统计学意义。此外发现miR⁃449a 并不能影响MDM2 的蛋白水平。因此,miR⁃449a可能通过调控MDM4稳定p53蛋白水平从而促进细胞凋亡。
3 讨论
已有研究表明,miR⁃449a作为肿瘤抑制子在多种肿瘤中阻止肿瘤细胞的细胞周期,包括肺癌、前列腺癌、胃癌及视网膜母细胞瘤[7-8,13-14]。除了对肿瘤细胞细胞周期的调控,miR⁃449a也可通过其他机制对肿瘤细胞进行调控,如抑制细胞增殖和诱导细胞凋亡。本研究结果表明,在神经母细胞瘤中miR⁃449a 也可通过引起细胞凋亡和降低细胞增殖发挥肿瘤抑制作用。

图5 miR⁃449a抑制MDM4并促进p53蛋白稳定Figure 5 miR⁃449a inhibits the level of MDM4 and promotes stability of p53
本文主要研究了miR⁃449a 靶基因其中之一的MDM4。首先通过经典的miRNA 靶基因预测方法预测miR⁃449a 潜在靶基因。该方法基于种子区域(通常位于miRNA 5′端的6~8个核苷酸)与mRNA 3′UTR 靶向区的相互作用[15]。进而我们通过荧光素酶实验证明MDM4 确实为miR⁃449a 的1 个靶基因。据报道,MDM4 是p53 的负调控因子,但是由于MDM4 没有泛素酶活性,需要与MDM2 结合形成2聚体,进而促进MDM2 对p53 泛素化[16]。另外在多种肿瘤中均发现了MDM4的过表达。MDM4可以通过抑制p53的转录活性进而导致细胞周期阻滞以及细胞凋亡的产生[17]。本研究发现miR⁃449a 可以促进细胞凋亡和p53 的表达,但是在高表达MDM4 的细胞中这种效应得到了中和。另外,我们还发现miR⁃449a对MDM2的表达没有影响,进而证明miR⁃449a 通过调控MDM4 稳定p53 蛋白。然而,其他miR⁃449a 可能的靶基因可能同样对于细胞增殖和细胞凋亡发挥重要作用,后续我们依然需要研究这些靶基因的作用从而完整地阐明miR⁃449a 在神经母细胞瘤中抑制肿瘤的机制。
囿于资源局限性,无法在本研究中检测miR⁃449a在神经母细胞瘤患者样本中的内源表达水平,从而阐释miR⁃449a 表达水平与肿瘤患者生存时间的关系。对于miR⁃449a 内源表达水平调控机制的研究将进一步促进神经母细胞瘤治疗策略的发展。
——一道江苏高考题的奥秘解读和拓展

