人多能干细胞诱导类肾的实验研究
俞 欣,李开霖,孔 峰,赵升田,张登禄
1中国科学技术大学附属第一医院(安徽省立医院)急诊外科,安徽 合肥 230001;2山东大学第二医院中心实验室,山东 济南 250000;3山东省立医院山东省泌尿器官与功能重建工程实验室,山东 济南 250000;4山东中医药大学附属医院实验中心,山东 济南 250000
终末期肾病(end stage renal disease,ESKD)已成为全球范围内严重的健康问题,每年约有260 万ESKD患者需要透析或肾移植,其中220万患者因无法医治而过早死亡[1]。由于肾移植供体不足,长期透析的成年患者平均寿命仅为10年[2]。因此,迫切需要阻止慢性肾脏疾病向ESKD进展的治疗。考虑到肾脏疾病可能由遗传异常引起,所以需要更全面地了解人类肾脏的发育,尽管动物模型可以提供关于发育机制的信息,但不能准确反映由同源基因突变引起的人类肾脏疾病[3]。人多能干细胞(human pluripotent stem cell,hPSC)由于其扩增性及对发育信号的可塑性,可以诱导分化成肾脏细胞从而模拟人类遗传肾脏疾病的发病过程[4-6],为准确了解肾脏发育过程和肾脏疾病发病机制并最终治疗ESKD提供了新的思路和手段。本实验利用hPSC在体外构建类肾体,并通过类肾体在小鼠肾包膜下移植,证实用hPSC诱导类肾,具有肾脏早期的特征结构,可在小鼠体内环境下进一步血管化。
1 材料和方法
1.1 材料
NuwacellTM科研级HiPSC 细胞株购自安徽中盛溯源生物科技有限公司,健康4~6周SCID小鼠购自北京维通利华公司,小鼠购买后于山东大学动物实验中心SPF级饲养,本研究经医院伦理委员会批准。
hPSC诱导类肾试剂:NuwacellTMNova hPSC培养基、NuwacellTMhPSC来源肾上皮细胞分化试剂盒、Nu⁃wacellTMEDTA 传代工作液、NuwacellTMBlebbistatin、NuwacellTMhPSC 冻存液、NuwacellTMSolase 细胞消化液、0.25%Trypsin⁃EDTA 和Trypsin inhibitor(安徽中盛溯源生物科技有限公司),Matrigel(Corning公司,美国),DMEM/F12培养基、DPBS、24孔板和T25培养瓶(Thermo Scientific 公司,美国),poly⁃HEMA(Sigma公司,美国)。类肾鉴定用试剂:多聚甲醛、Triton X⁃100、FluoroshieldTMwith DAPI(Sigma 公司,美国),CDH1、LTL、PODXL和内皮细胞抗原⁃32(MECA⁃32)抗体(Abcam 公司,美国),Donkey Anti⁃Goat IgG(594)、Donkey Anti⁃Rabbit IgG(488)(Life Technology公司,美国)。1200型号透射电镜(transmission elec⁃tron microscopy,TEM)和LKB⁃V半薄切片机(日本电子公司,日本);荧光倒置显微镜(Nikon 公司,日本)。
1.2 方法
1.2.1 类肾的诱导
按NuwacellTMhPSC来源肾上皮细胞分化试剂盒步骤,诱导过程如下:①诱导起始日(D0),当hP⁃SC 细胞汇合度达到50%时,启动分化程序,将NuwacellTMNova hPSC 培养基吸除,加入500 μL DPBS(不含钙镁)洗涤细胞1次,随后加入0.5 mL/孔分化完全培养基A。每天更换培养基,培养4 d(D0~D4)。②第4天(D4),吸除分化完全培养基A,以1 mL/孔加入分化完全培养基B,每天换液,培养2 d(D4~D6)。③第6天(D6),吸除分化完全培养基B,按照1 mL/孔加入分化完全培养基C,培养2 d(D6~D8)。④第8 天(D8),转3D 培养:提前配制好6 mL 分化完全培养基D,并加入10 μmol/L Nu⁃wacellTMBlebbistatin,向24 孔板的1个孔中加入500 μL 0.25%Trypsin EDTA,37 ℃孵育3 min 后加入500 μL Trypsin Inhibitor 终止消化,使用1 mL 移液器轻柔吹打,随后将细胞悬液转移至1.5 mL 离心管,掌上离心机瞬时离心5~10 s,吸弃上清。加入含10 μmol/L NuwacellTMBlebbistatin 的分化完全培养基D 重悬细胞并转移至poly⁃HEMA 包被的T25 培养瓶中,置于三维摇床,15 r/min 培养。每天换液(D8~D10)。⑤第10天(D10),吸除分化完全培养基D,按照6 mL/孔加入分化完全培养基C,连续培养3 d,每天换液(D10~D13)。⑥第13天(D13),吸除分化完全培养基C,按照5 mL/孔加入Nephron分化培养基E,每天换液,约2~4 d可获得类肾(D13~D15/17)。
1.2.2 类肾免疫荧光检测
类肾冰冻切片使用DPBS洗1遍,5 min;4%多聚甲醛室温固定10 min,DPBS 洗3 遍,每遍5 min;向切片中加入1%Triton X⁃100(溶于DPBS 中)室温通透1 h;DPBS洗3遍,每遍5 min;使用10%山羊血清室温封闭1 h;用封闭液按1∶100 稀释一抗;移除封闭液,加入一抗CDH1、PODXL 和LTL 抗体,4 ℃孵育过夜;移除一抗,DPBS 洗3 遍,每遍5 min;使用封闭液按1∶1 000 稀释二抗Donkey Anti⁃Goat IgG(594)、Donkey Anti⁃Rabbit IgG(488),避光加入二抗,室温孵育1 h;移除二抗,用DPBS洗2遍,每遍5 min,避光;向切片中加入适量FluoroshieldTMwith DAPI,荧光显微镜下观察染色情况。
1.2.3 类肾的电镜观察
类肾诱导的第15 天(D15),取约1 mm3类肾样品若干块,分别迅速置入盛有3%戊二醛固定液的小瓶中,常规浸洗、1%锷酸固定、磷酸缓冲液漂洗、梯度脱水、Epon812 包埋,半薄切片定位,制备超薄切片,经醋酸双氧铀和柠檬酸铅双重电子染色后,用透射电镜观察。
1.2.4 小鼠肾包膜下类肾移植
SCID 小鼠实验前适应性饲养3 d,类肾在体外诱导至D15,进行移植手术,切开小鼠右肾包膜,将类肾颗粒移植到小鼠右肾包膜下,利用包膜的组织张力固定类肾颗粒。
1.2.5 移植后类肾的组织学检测
移植手术后,小鼠继续饲养4周,处死。取右肾及类肾标本进行大体观察、HE 染色和免疫荧光鉴定。HE 染色:取移植后类肾标本,甲醛固定后,经过脱水、透明和浸蜡等程序后,再以石蜡、切片进行HE染色。免疫荧光鉴定CDH1、PODXL和MECA⁃32,实验过程同类肾免疫荧光检测。
2 结果
2.1 类肾的组织学检测
利用肾脏高效表达特异性标志物PODXL、LTL和CDH1 分别检测类肾足细胞、近端小管和远端小管。免疫荧光显示PODXL呈阳性表达,阳性细胞呈球形分布。免疫荧光显示LTL 和CDH1 表达阳性,阳性细胞呈管形分布。PODXL 阳性表达细胞分布于LTL 和CDH1 阳性表达细胞的末端(图1)。足细胞、近端小管和远端小管的特异性蛋白阳性表达,且阳性细胞的毗邻位置关系与肾脏细胞位置关系一致,提示类肾具备足细胞、近端小管和远端小管等肾单位组成结构。
2.2 透射电镜观察
电镜下观察到类肾体有簇状分布的足细胞,其电镜下特征表现为细胞突起丰富,细胞器丰富,细胞核凹凸明显,有上皮样连接结构。TEM还观察到上皮细胞组成的管状结构,上皮细胞腔面存在大量不规则的微纤毛样结构,细胞内含大量线粒体,符合肾小管上皮细胞微观表现;细胞核质比大,部分上皮细胞呈复层排列,缺乏透明的管状基底膜,提示极化不完全(图2)。TEM未观察到红细胞和毛细血管。TEM 分析说明类肾具备足细胞和肾小管上皮的特征结构,但结构仍处于不成熟阶段。

图1 体外类肾器官CDH1、LTL和PODXL免疫荧光染色(×200)Figure 1 Immunofluorescence staining of CDH1,LTL,PODXL in renal organoids in vitro(×200)
2.3 移植类肾肉眼观察
类肾移植小鼠肾包膜当日观察,类肾体积小(以宿主肾为参照),类肾未见血管。移植4周后,类肾体积较移植时增大,类肾与宿主嵌合生长,移植物表面可观察到多条小血管(图3)。说明类肾可在小鼠体内环境下完成血管化,移植物可在体内环境持续生长。
2.4 移植类肾组织学检测

图2 类肾透射电镜观察(×8 000)Figure 2 Renal organoids were observed by TEM(×8 000)

图3 类肾移植于SCID小鼠肾包膜下Figure 3 The renal orgnoids were transplanted into the renal subcapsular of the SCID mouse
HE 染色观察,移植物可观察到肾小球样结构、小管状结构和大量类软骨结构,肾小球和类肾基质内可观察到大量红细胞,提示类肾在移植后,获得血管化,同时出现大量非肾系组成(图4)。免疫荧光显示,人源性特异性标志物人抗核抗原(human unclear antigen,HNA)表达阳性,肾小球样结构PODXL 表达呈阳性,管状结构CDH1 表达呈阳性。小鼠MECA⁃32 阳性细胞散在分布于移植组织和肾小球结构中(图5)。提示移植物的血管化,其血管内皮细胞可能是宿主来源。
3 讨论
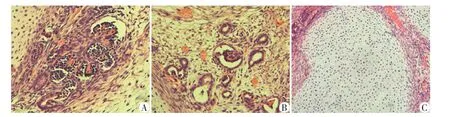
图4 移植4周类肾HE染色(×200)Figure 4 HE staining of renal organoids after transplantation for 4 weeks(×200)

图5 移植4周类肾免疫荧光染色(×200)Figure 5 Immunofluorescence staining of renal organoids after transplantation for 4 weeks(×200)
近年来,利用干细胞诱导类器官作为研究发育和疾病的体外模型研究取得了较大进展[5,7-8]。早期将多能干细胞转化为肾细胞的方案,是试图模拟控制中间中胚层早期肾脏形成的发育信号,发现包括低剂量Wnt 激动剂CHIR99021 在内的一系列诱导因子可诱导中间中胚层样细胞[9]。该领域的重大突破是发现高浓度的CHIR99021(8 mmol/L)和成纤维细胞生长因子9(fibroblast growth factor 9,FGF9)可诱导具有类似于妊娠早期胎儿肾脏的类器官[10]。随后研究表明,B27可以替代FGF9,B27是一种用于维持神经元细胞培养中的无血清补充剂。此外,激活素A、骨形态发生蛋白和FGF9的更复杂组合已被用于诱导肾脏类器官的形成[11-13]。这些诱导因子在多能干细胞诱导类肾过程中的作用机制,目前尚不清楚[14]。目前诱导方案的主要缺点是试剂成本高以及诱导过程复杂,从而限制了肾脏类器官的大规模培养[13]。本研究通过肾上皮细胞诱导试剂盒优化类肾诱导过程,诱导出类肾结构,成本较低,并且具有较好的重复性。HE 染色观察到肾小球样和肾小管样结构,免疫荧光染色发现,足细胞标志物PODXL在肾小球结构中阳性表达,近端小管标志物LTL和远端小管标志物CDH1 在小管结构中阳性表达,表明本实验诱导的类肾体具有足细胞、近端小管和远端小管等肾脏特征结构。
多种体外诱导类肾方案都可以生成人类肾脏特征的细胞类型和结构,但相较于人类肾脏约35周的体内发育时间,体外诱导类肾培养时间最多只有几周,因此类肾的成熟程度普遍较低,这在基因和形态水平上均得到了证实[14]。为了进一步评估类肾中肾小球和肾小管结构成熟度,本研究对体外诱导的类肾体进行了TEM分析,观察到类肾中足细胞初级突起、次级突起等特征表现,但足细胞排列松散,也未发现毛细血管结构;在肾小管中,观察到上皮细胞腔面大量不规则的微纤毛样结构,形成刷状缘,同时部分上皮细胞表现为多层上皮,提示极化不完全。本研究在超微观结构上进一步证实了体外诱导的类肾结构不成熟,这与其他诱导方案通过免疫组化等鉴定结果相一致。体外诱导类肾体的结构幼稚,目前认为当前的诱导方案尚无法完全模拟体内肾脏发育过程[15]。另外,在体外培养环境中,随着类肾组织体积增大,由于没有功能性血管的营养供应,类肾的营养摄入和代谢物排出障碍出现负代谢平衡,细胞无法持续扩增[16]。
类肾体的血管化是其发育成熟并最终产生功能的关键,van den Berg 等[16]和Bantounas 等[17]利用Takasato 方案诱导的类肾,分别移植到小鼠肾包膜和皮下,发现hPSC来源的肾脏组织能够募集宿主来源的内皮细胞,形成宿主来源的肾小球循环,并促进了移植物结构成熟,这表明功能性血管化是人类肾脏类器官成熟形态形成所必需的。本研究将体外诱导的D15 类肾体移植到小鼠肾包膜下,发现移植物体积逐渐增大,并且肉眼可见移植物中存在连接移植物和宿主的血管。HE 染色可见移植物肾小球结构内部及移植物基质中大量红细胞。免疫荧光显示,小鼠MECA⁃32阳性细胞弥散分布于移植组织和肾小球结构中。本研究进一步证实类肾在小鼠体内环境中,可能通过招募宿主来源的内皮细胞完成血管化,并促进其进一步生长。本研究还发现,随着移植时间的延长,肾小球和肾小管结构逐渐减少,移植物中出现大量类软骨结构。这可能是由于诱导过程中脱靶细胞的存在,以及上皮细胞向非肾系的去分化[15]。这说明,生成结构单一的肾脏组织,需要进一步优化诱导方案,以促进干细胞向肾系最终分化,并在诱导过程中避免细胞脱靶。
综上所述,人多能干细胞hPSC通过体外诱导可生成类似早期肾脏的幼稚结构,在体内环境,可能通过招募宿主内皮细胞完成血管化,促进类肾生长,同时大量非肾系组织生成,所以仍需优化诱导方案,避免脱靶细胞的产生和促进类肾组织的最终分化。

