缝隙连接蛋白32与肝脏稳态相关性研究综述
许 艳(综述),施宝民(审校)
同济大学附属同济医院普外科,上海 200065
1 背景
1967年,Loewenstein 等[1]用大鼠肝脏做实验发现,与正常肝细胞相比,大鼠肝癌细胞之间不能进行离子交换,与同时期提出的细胞之间直接交流的丧失是癌症发生发展的基础[2]这一学说不谋而合;同年,Revel 等[3]运用负染技术发现了肝细胞膜上的细胞之间的连接——日后命名为缝隙连接通道的六聚体亚基序列;直到1974年,Goodenough 等[4]成功分离小鼠肝脏中的2种缝隙连接蛋白质并命名为缝隙连接蛋白(connexin,Cx)。20 世纪80年代中期,克隆出人和大鼠肝脏连接蛋白才是广泛的缝隙连接通道研究的开端。
Cx 是一种细胞膜表面的四次跨膜蛋白,根据其分子量区分不同种类,目前在鼠类发现20 种Cx 而在人类发现21 种Cx 蛋白成员[5-6]。Cx 表达于脊椎动物除红细胞、成熟精子细胞和分化骨骼肌细胞的几乎所有的细胞类型中,一般来说Cx的表达具有一定的种属特异性及器官特异性。所有的连接蛋白有着相同的拓扑结构[7],包括1个N 末端,4个跨膜区(M1-M4),2个胞外环(Extracellular loop),1个胞内环(cytoplasmic loop),1个C 末端(图1),4个跨膜区的氨基酸序列在不同的缝隙连接蛋白中高度保守,同源性较高。6个蛋白质分子作为亚单位组成六聚体称为连接子而整合到细胞膜上,相邻细胞膜之间同样的连接子对接形成的细胞间通道称为缝隙连接(gap junction,GJ)[8]。
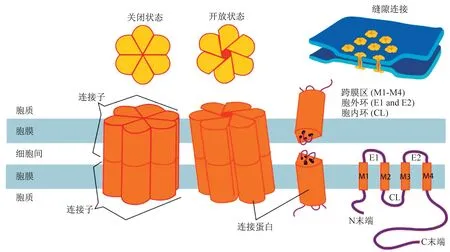
图1 缝隙连接蛋白结构Fig.1 Structure of connexin
连接子是中空的圆筒状亲水性通道,其中心直径约为1.5~2.0 nm,可以允许分子量少于1 000 道尔顿的小分子通过,如水、离子、ATP、IP3、小分子肽、第二信使等,因此可以快速协同相邻细胞对外界信号的反应,GJ 介导小分子物质在细胞间的流动引起信号改变,又为缝隙连接细胞间通讯(GJIC)作用[9-10]。细胞膜电位与细胞内酸碱度变化,以及胞液游离钙离子浓度的改变可以影响缝隙连接通道的开放及关闭[11]。
GJ 作为一种细胞与细胞之间联系的方式,长期以来认为其在细胞的生长发育、增殖、凋亡及分化过程中起主导作用,对维持细胞内环境的稳态、整个器官功能及新陈代谢起重要的调控作用[12]。但除了被视为GJ 的重要组成而执行作为通道的功能之外,如今越来越明确Cx 还有除GJIC 之外的半通道作用和作为功能蛋白质的作用[13],其在病理状态、肿瘤生长、迁移及细胞信号转导方面扮演更重要的角色[14]。
2 Cx32与肝脏稳态
肝脏中表达丰富的缝隙连接蛋白,在缝隙连接蛋白的基因序列与蛋白结构发现以前,用电镜例如冰冻蚀刻电镜已观察到肝脏细胞中含有丰富的缝隙连接超级显微结构,故肝脏被当作最常用的研究缝隙连接的组织。肝脏组织中(不包括支配肝脏的血管组织,血管组织的特征性缝隙连接蛋白为Cx37、Cx40 与Cx43)存在至少4 种缝隙连接蛋白:Cx26、Cx32、Cx40 与Cx43,随着肝脏发育成熟,Cx32成为肝实质细胞大量表达的连接蛋白并且在肝脏功能稳态中起主导作用[15]。随着20 世纪70年代的细胞组织化学与单克隆抗体技术、细胞与分子生物学技术的发展,David Paul,Kumar Gilula 等[16-17]研究组在1986年首先从肝脏组织中克隆了大鼠的Cx32。
2.1 Cx32与肝脏生长发育
Cx32参与肝脏功能稳态维持的机制中,其GJIC作用得到较多研究者的关注,建立精细的肝细胞的GJIC 对于正常的肝脏发育非常重要。由于肝切除后再生模型中GJIC 的削弱使得研究者一度认为GJIC 在控制肝细胞分裂增殖中扮演重要角色[18],随着Cx32 的鉴定及基因技术的应用,现在更多认为GJIC并不涉及细胞周期中G0/1-S转变,也不促进细胞周期的进展[19],Cx32介导的GJIC不具备促进细胞分裂增殖作用[20]。但公认其对于维持肝细胞分化成熟至关重要,胚胎型肝细胞主要表达Cx43,或者说Cx43是干细胞的特征性缝隙连接[21],在肝祖细胞向成熟肝细胞分化过程中Cx43 逐渐转变为Cx26 及Cx32,Cx32 占主导优势并达肝实质细胞的90%,Cx26 主要分布于门静脉周围的组织,更多证据还是支持在成人的肝脏维持功能分化如糖原分解、氨解毒、白蛋白分泌、生物转换等方面主要还是Cx32 起着关键作用[22]。
原代肝细胞来源受限、体外增殖难以为继使得通过诱导干细胞向肝细胞分化成为研究热点,但是实际操作中由干细胞分化而来的肝细胞总是有着胎儿肝细胞的表型及功能,使得该分化过程中走向着成熟肝细胞的最后一步成为困境[23]。在肝细胞再生领域,Cx32 也扮演着重要的角色,不论是通过基因还是化学药物增强Cx32 的表达都可以促进肝细胞分化,反之亦然,Qin 等[24]首次证明了Cx32 作为一种关键的肝缝隙连接蛋白,调节人胚胎干细胞(hESC)向肝谱系的分化和成熟,其结果表明Cx32及其GJIC 活动的上调可以促进肝细胞标志物表达及分化过程中肝细胞功能的提升,后又有学者且进一步提出这一过程可以由p38 MAPK 信号通路调节,p38抑制剂可以通过上调Cx32及下调Cx43表达促进肝细胞分化[25],而p38 MAPK 通路通过磷酸化降解Cx32,负调控Cx32 及其介导的缝隙连接可削弱GJIC功能。
近年来人们初识缝隙连接通道与细胞凋亡相关性,但这一研究处于初始阶段,与肝细胞相关的研究更为稀少,Cx32 与肝细胞凋亡的研究尚未见报道。已有研究用肝癌细胞细胞系发现凋亡早期出现GJIC 的瞬时性增强[26],可能表明缝隙连接通道在细胞间凋亡初期有死亡信号传播的作用,钙离子为其关键。随后而来的则是GJIC 活动的削弱,可能是为了阻止有毒代谢物如一氧化氮及超氧阴离子与周围健康细胞的物质交换[27-28]。细胞凋亡过程中GJIC 的消失是由于缝隙连接的去除,而不是由于它们的功能关闭,而观察肝细胞凋亡后期Cx32合成增加且在细胞膜表面聚合成半通道形态,通过实验验证Cx32半通道促进细胞凋亡向坏死转变[29],但目前此研究领域尚显空白。
2.2 Cx32与肝脏病理过程
肝脏病理状态如中毒、损伤、炎症和氧化应激期间往往伴随着Cx32和Cx26的表达降低和Cx43表达增加[30]。通常认为Cx32 对于肝脏稳态起着保护性作用,但各个研究结论对于Cx32在肝脏功能稳态中发挥的作用大相径庭。
一方面,研究显示在药物诱导的小鼠非酒精性脂肪性肝炎模型中,认为与野生型动物相比,Cx32基因阴性变异者受到损伤时表现为更明显的肝脏损伤、炎症和氧化应激[31]。Cx32 阴性变异者仅仅阻断其GJIC 功能而不干扰非GJIC 功能,提示Cx32 的GJIC 在非酒精性脂肪性肝炎进展中起保护性作用[32]。Cx32 基因敲除的小鼠在由对乙酰氨基酚引发的肝损伤中表现更为严重[33],在四氯化碳诱导建立的肝纤维化模型中,Cx32 基因敲除小鼠表现为更重的肝损伤和更多地胶原沉积[34],进一步认为基于Cx32信号调节抗氧化能力可抵抗肝损害。
另一方面,有实验发现Cx32缺陷小鼠在药物性肝损的进程中受到保护,简单的实验设计示Cx32抑制剂2-氨基乙氧基硼酸二苯酯抑制Cx32 介导的GJIC,应用于野生基因型小鼠可以减轻药物诱导的肝损伤[35],Cx32 阴性变异转基因大鼠对四氯化碳、半乳糖胺等化学物质诱导的肝损伤具有抵抗力[36],提示肝细胞之间的缝隙连接在组成分子通道介导GJIC 同时也可介导化学药物的毒理效应、有害信号通过GJ在细胞之间传递,促进肝脏损伤、炎症扩大。而不仅仅是扮演保护细胞的角色。另外对乙酰氨基酚引起急性肝中毒的模型中,在Cx32阴性变异转基因大鼠受到的肝毒性远小于野生型,且提出Cx32形成的GJIC 变化引发第二信使如ATP、钙离子的改变,从而诱导Cx43 生成,在乙酰氨基酚诱导肝细胞死亡的过程中则主要是通过Cx43介导细胞凋亡[37]。
因为各个实验使用的动物模型不具有同质性,药物使用亦不统一,因此尚没有权威的实验室能证实Cx32 在肝脏毒性损伤过程中起何种作用,Cx32基因敲除的动物模型并没有办法区分药物诱导的肝损伤是基于GJIC 还是非GJIC 信号改变而引起的,Cx32 的半通道作用介导的是细胞与其周围细胞外环境之间的信号传递,不同于GJIC,半通道更倾向于在病理状态时起作用,且发现它在原代肝细胞培养时可促进细胞死亡[38]。
2.3 Cx32与肝癌发生
在细胞癌变方面,人们视Cx32 基因为抑癌基因,但在癌变过程,GJIC 丢失的许多机制中,涉及连接蛋白基因的变异却是罕见事件,更常见的是表观遗传修饰如DNA 甲基化[22]。除了在维持肝细胞正常表型、提升肝细胞特异性功能的作用外,Cx32 可降低恶性表型,对肿瘤形成机制有抑制效应,转染Cx32cDNA 抑制肝癌肿瘤细胞生长,而Cx32 会减少者发生肝癌的概率极大增加[39-41]。而Cx32 基因敲除小鼠肝脏极易发生癌变,或者在致癌物诱导下更易出现肝癌[42-44]。上皮-间充质转化(EMT)是多种肿瘤细胞耐药的重要机制,Cx32是肝癌EMT的重要调节因子,转染Cx32cDNA 可逆转EMT,部分恢复肝细胞癌对奥沙利铂的敏感性[45],因此Cx32有望成为逆转肝癌耐药的新靶点。
尽管最初Cx32 相关的GJIC 被视为肿瘤抑制因子,但现今越来越多研究表明连接蛋白的状态与癌症的发生和发展有着复杂的关系,介导不同的信号通路则引起不同的效应,从调节细胞增殖、黏附和迁移角度来说,不如将其归类为条件性肿瘤抑制因子[46]。在肝细胞癌中,尽管检测到Cx32蛋白表达增加,但因其定位于细胞质中,可增进癌细胞的侵袭和转移而加快疾病进程[47]。此外,体内模型证明在诱导表达的Cx32 不能形成GJIC 通道和半通道时可促进HCC 细胞增殖、迁移和侵袭,小鼠中癌细胞的转移灶明显增加[15]。另有研究发现肝癌组织中Cx32的上调及胞质定位与该肿瘤的TNM分期、分化及预后相关,进一步地揭示其以独立于GJIC 的机制保护肝癌细胞使其免于化疗药物诱导的凋亡,该机制为联合酪氨酸激酶Src 激活EGFR 通路,建立在Cx32作为蛋白质的功能上而非其介导的GJIC,因此Cx32可能会成为肝癌临床预后的标志物[48]。
3 结语
Cx 基因家族的复杂性及其亚型的特异性与人类许多疾病相关,从基因转录、蛋白质合成、翻译后修饰及运输至细胞膜方面阐明其调节机制对于我们理解Cx在健康与疾病进程中所起做作用很重要。以前的报道表明某些缝隙连接蛋白由于不是定位于细胞膜上而对细胞间通信没有作用,Cx 需要运输到细胞膜并正确组装成间隙连接斑块以形成功能性的间隙连接通道,因此,在肝脏发生病理生理改变过程中检查功能性GJIC 的变化可能比单纯观察其蛋白质表达量的变化更为重要。但除GJIC 外,Cx形成半通道、其本身作为蛋白质的非通道功能在许多病理生理过程也有其独特的效应,主要是通过与不同信号通路中的关键分子相互作用而改变细胞的生物学行为,由此不难理解Cx在肝脏病理生理进程中显示出多种功能,而这些功能有时自相矛盾。目前研究多集中在Cx 介导的GJIC 作用上,但这些也只是揭示了冰山一角,未来仍然需要进一步研究更多GJIC 及非GJIC 功能的分子机制及信号通路。尤其是在肝癌发生发展方面明确其作用机制找到靶点并施以药物阻断有望为肝癌诊治开辟新的道路。

