敲除ABRO1对小鼠胚胎成纤维细胞(MEF)LPS/TLR4通路活化的影响①
李东旭 张 文 葛志强 詹轶群 尹荣华 杨晓明
(天津大学化工学院制药工程系,天津 300072)
脂多糖(LPS)是革兰氏阴性细菌细胞壁外壁的组成成分,由脂质和多糖构成,是天然免疫反应中最有效的刺激因子之一[1]。Toll样受体4(TLR4)是一种与天然免疫反应密切相关的受体,广泛分布于免疫细胞的细胞膜表面。TLR4通过识别LPS活化NF-κB和MAPK信号通路等,诱导多种炎症相关基因的表达,进而介导免疫应答和抵抗病原体入侵[1-2]。此外,LPS诱导的TLR4信号通路的过度激活是多种炎症性疾病发生的主要原因,如败血症、内毒素导致的慢性肝病重症化等[3]。发现新的LPS/TLR4信号通路的调控因子及调控机制对相关疾病的治疗具有重要意义。
ABRO1(abraxas brother 1),也被称为KIAA0157或FAM175B,与BRCC36、MERIT40和BRCC45共同组装形成BRISC复合体。BRISC复合体是一种特异性去除K63泛素化的去泛素化酶,其中ABRO1与BRCC3是最重要的两个亚基,BRCC3具有去泛素化功能,ABRO1具有酶活性的催化功能,共同调节BRISC的去泛素化酶活性[4]。ABRO1在各类细胞中均有表达,参与不同的生理过程,包括炎症反应、细胞分裂、DNA损伤反应等[5-6]。ABRO1敲除小鼠可以抵抗LPS诱导的败血症,其外周血单个核细胞中,IL-1β和IFN-β等细胞因子的mRNA水平明显降低,在小鼠骨髓来源巨噬细胞(BMDM)中,敲除ABRO1和BRCC3并不影响LPS/TLR4信号通路活化,然而ABRO1和BRCC3缺失会阻断NLRP3炎症小体组装,进而抑制IL-1β和IL-18分泌[7-8]。综上所述,ABRO1在LPS/TLR4通路活化中的作用仍未确定。
本文主要探讨ABRO1在小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)细胞中对LPS/TLR4信号通路的调节作用[8]。研究发现敲除ABRO1并不影响LPS/TLR4信号通路的活化,提示ABRO1对LPS/TLR4通路的调节可能具有细胞选择性。
1 材料与方法
1.1材料
1.1.1小鼠 ABRO1敲除小鼠(C57BL/6)由本实验室建立并饲养于军事科学院军事医学研究院实验动物中心。选取SPF级8周龄、体重20~22 g、雌雄ABRO1杂合小鼠进行交配,选择孕期为13.5 d的孕鼠分离MEF细胞。
1.1.2细胞和质粒 HEK-293T细胞购自ATCC,用含10%FBS的DMEM完全培养基培养;慢病毒包装质粒psPAX2、pMD2和荧光素酶报告基因载体pCDH-NF-κB-Luciferase为实验室保存。
1.1.3主要试剂 DMEM培养基、RPMI1640培养基、胎牛血清(FBS,Gibco公司);LPS(Sigma公司);Pierce ECL化学发光底物(美国Thermo scientific 公司);ABRO1抗体为实验室定制(ABclonal公司);ACTB抗体(ABclonal公司);p-P65、P65、p-IκBα、IκBα、p-P38、P38、p-ERK、ERK、p-JNK和JNK抗体(CST公司);IL-6流式微球阵列(CBA)试剂盒(BD公司);双荧光素酶报告基因活性检测试剂盒、反转录试剂盒(Promega公司);TRIzol(北京威格拉斯公司);定量PCR试剂盒(Thermo 公司);慢病毒包装试剂盒(System Biosciences公司)。
1.1.4主要仪器 细胞培养箱3111型(美国Thermo scientific 公司);NanoDrop 2000超微量分管光度计(美国Thermo scientific 公司);流式细胞仪LSRFortessa型(BD公司);PCR仪(美国Bio-Rad公司);电泳仪(美国Bio-Rad公司);显微镜成像(奥林巴斯);荧光检测仪(Promega公司)等。
1.2方法
1.2.1MEF的分离培养 将怀孕13.5 d的ABRO1杂合小鼠放到鼠笼里,脱颈椎法处死小鼠,将小鼠浸泡在酒精中3~4 min,然后将已处死的孕鼠拿到超净台上的盘子中,用剪刀和镊子取出胚胎,将胚胎放到PBS中,去除头、四肢和内脏,转移至新的培养皿中,用手术刀细细切碎,37℃胰酶消化30 min,每隔5 min轻轻吹打使之消化充分,然后加入含10%FBS的DMEM终止消化,用200目的尼龙网过滤后,将滤液转移至新的50 ml离心管中,4℃,1 000 r/min 离心5 min,DMEM清洗2次,弃上清,用1 ml DMEM重悬细胞沉淀,计数板计数,按一定密度接种于新的60 mm细胞培养皿中,用含有10%FBS,1%P/S的DMEM传代培养1~2代。
1.2.2细胞因子检测 传代培养2代后,进行消化处理,重新按1×106个/ml接种到24孔板,细胞贴壁过夜。加入10 ng/ml、100 ng/ml或1 μg/ml LPS刺激,分别于0、6、12 h收取细胞培养基上清。参照说明书,利用CBA法检测IL-6的浓度,简述如下:取50 μl样本,用PBS稀释5倍,与含有2 μl 磁珠、2 μl PE和100 μl PBS混合后,室温避光孵育1.5 h,用PBS清洗1次,然后流式细胞仪检测。
1.2.3Western blot 分别接种ABRO1 KO和WT的MEF细胞于12孔板中,贴壁过夜,更换新的不含血清的DMEM饥饿3 h,用1 μg/ml LPS刺激0、15、30、60 min后,吸弃培养基,用PBS清洗1次后吸弃,每孔加入120 μl 2× loading buffer裂解细胞,收集于1.5 ml EP管中,将细胞裂解液样品沸水煮 15 min 后,每孔8 μl样品进行SDS-聚丙烯酰胺凝胶电泳,电转至PVDF膜上,用5%脱脂牛奶封闭2 h,4℃旋转孵育ABRO1、ACTB、p-P65、P65、p-IκBα、IκBα、p-P38、P38、p-ERK、ERK、p-JNK和JNK等抗体,孵育过夜,TBST洗3次,每次7 min,室温孵育二抗1 h,TBST洗3次,每次7 min,ECL法暗室显影检测相关通路蛋白。
1.2.4qPCR 提取ABRO1 KO和WT小鼠MEF细胞RNA:每个样品加1 ml TRIzol,反复吹打,摇床摇10 min,使蛋白与核酸完全分离;每个样品加入200 μl氯仿,振荡15 s,4℃,12 000 r/min离心15 min,把上层转移至新的RNase-free EP管中;加入同等体积异丙醇,上下颠倒混匀,冰上孵育30 min;4℃,12 000 r/min离心10 min,弃上清,75%酒精洗涤沉淀;4℃,12 000 r/min离心5 min,吸弃上清,待乙醇完全挥发干净,加入50 μl无RNase水,使其充分溶解后,NanoDrop 2000测定RNA浓度和纯度,样本无明显杂峰,OD值在1.8~2.0之间即为合格样本。将RNA逆转录后,进行qPCR,检查溶解曲线、扩增曲线、CT值等,然后计算作图。PCR 引物序列:IL-6上游5′-GGCGGATCGGATGTT-GTGAT-3′;下游:5′-GGACCCCAGACAATCGGTTG-3′;TNF-α上游:5′-GACGTGGAACTGGCAGAAGAG-3′;下游:5′-TTGGTGGTTTGTGAGTGTGAG-3′;IL-1β上游:5′-GAAATGCCACCTTTTGACAGTG-3′,下游:5′-TGGATGCTCTCATCAGGACAG-3′;GAPDH 上游5′-AGGTCGGTGTGAACGGATTTG-3′,下游 5′-TGT-AGACCATGTAGTTGAGGTCA-3′。
1.2.5慢病毒包装制备和MEF细胞感染 为制备慢病毒颗粒,在10 cm细胞培养皿中培养293T细胞,用15 μg pCDH-NF-κB-Luciferase表达载体、10 μg psPAX2(Addgene)和5 μg pMD2.G(Addgene)进行转染,转染8 h后,更换为含10%FBS,1%P/S的DMEM培养基,再过40 h后,收集培养基上清,1 000 r/min 离心10 min,上清液通过0.45 μm膜过滤,预冷的PEG-it 病毒沉淀溶液(System Bioscien-ces,LV810A)加入到上清中,上清与PEG-it的混合液4℃条件过夜,4℃,1 650 r/min离心 30 min,去除沉淀,收集悬浮着慢病毒颗粒的上清液,10 μl等量分装储存于-80℃冰箱中。用制备好的慢病毒颗粒对MEF细胞进行感染。
1.2.6荧光素酶报告基因活性检测 吸弃感染荧光素酶报告基因的MEF细胞上清,加入被动裂解液,室温裂解15 min,收集细胞裂解液上清,转移至新的96孔板中,参照仪器和荧光素酶报告基因活性检测试剂盒说明书,用荧光检测仪检测荧光。计算报告基因与内参基因的荧光素酶活性比值,即荧光素酶活性。
1.3统计学处理 采用GraphPad Prism 7.0软件进行数据分析,组间差异采用双侧t检验,P<0.05为差异具有统计学意义。
2 结果
2.1ABRO1敲除和WT小鼠MEF细胞的分离培养与表达鉴定 取孕期为13.5 d孕鼠胚胎,制备成ABRO1 KO和WT MEFs,Western blot鉴定MEF细胞,证实ABRO1 KO MEF细胞中无ABRO1表达,而WT MEF细胞中ABRO1正常表达(图1)。说明ABRO1 KO和WT MEF细胞构建成功。
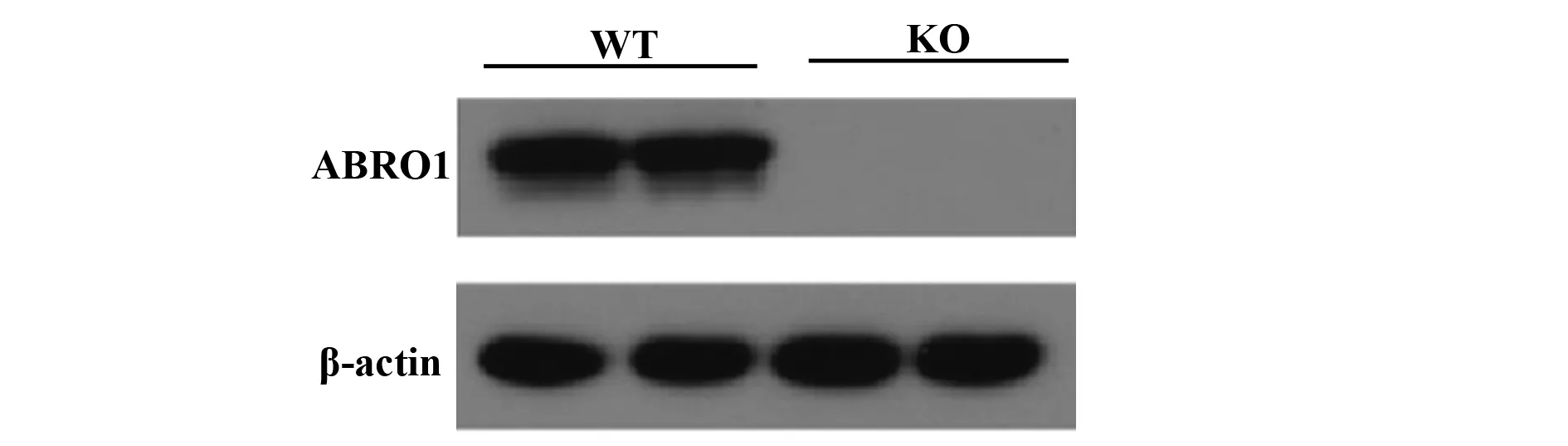
图1 MEFs细胞中ABRO1蛋白表达鉴定
2.2敲除ABRO1不影响MEF细胞中LPS诱导的IL-6释放 传代2次后的MEF细胞重新消化,种板,分别用10 ng/ml、100 ng/ml和1 μg/ml 3种剂量的LPS刺激MEF细胞0、6、12 h,收取细胞培养基上清,流式CBA法检测炎症因子IL-6的含量,结果显示,静息态MEF细胞分泌极少量IL-6,而LPS刺激6 h或12 h可以促进IL-6的大量分泌;但是,无论在何种刺激浓度和刺激时间下,ABRO1 KO和WT MEF细胞产生的IL-6水平都基本一致(图2A~C)。
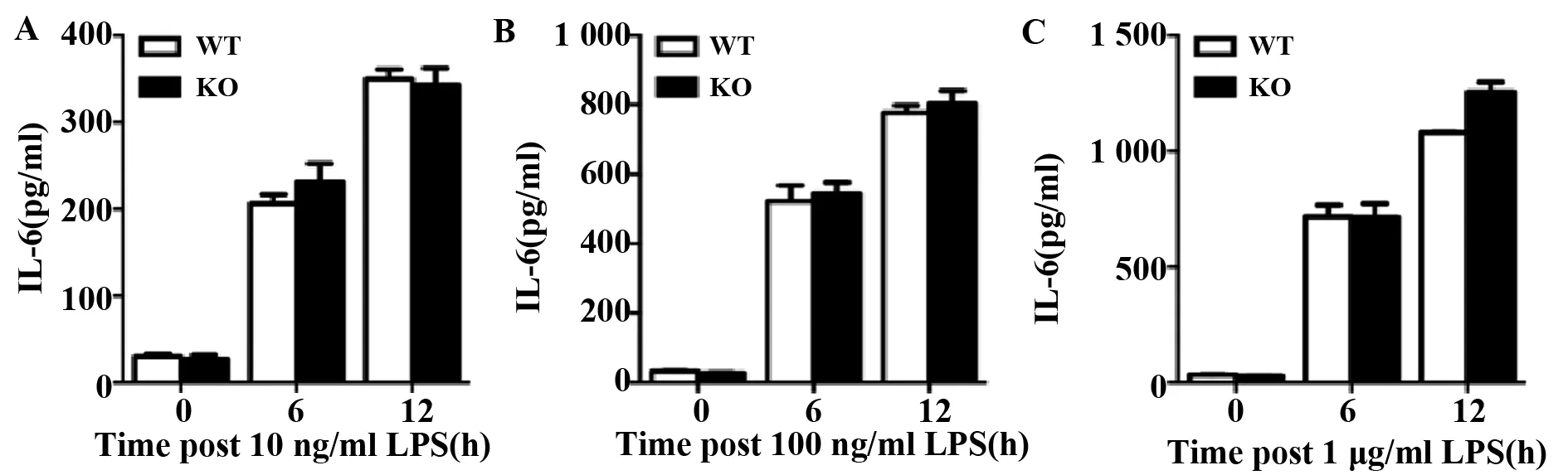
图2 敲除ABRO1不影响MEF细胞中LPS诱导的IL-6的释放
2.3敲除ABRO1不影响MEF细胞中LPS诱导的IL-6、IL-1β和TNF-α的mRNA水平 1 μg/ml LPS刺激MEF细胞0 h和3 h,收集细胞提取RNA,用qPCR检测IL-6、IL-1β和TNF-α的mRNA水平。结果显示,LPS刺激3 h显著提高了IL-6、IL-1β和TNF-α的mRNA水平,但ABRO1 KO和WT MEF细胞中这3种细胞因子的mRNA水平基本一致(图3A~C)。
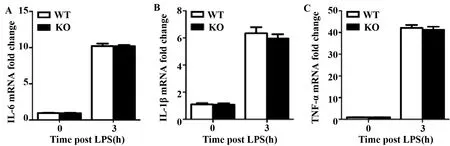
图3 敲除ABRO1不影响MEFs细胞中LPS诱导的IL-6、IL-1β和TNF-α的mRNA水平
2.4敲除ABRO1不影响MEF细胞中LPS-TLR4信号通路的活化 进一步检测了敲除ABRO1对TLR4下游信号通路活化的影响,主要包括NF-κB和MAPK信号通路。Western blot结果显示,LPS刺激后MEF细胞IκBα蛋白水平迅速降低,在之后60 min 恢复到较高水平;p-IκBα和p-P38在15 min和60 min出现2次表达峰;但ABRO1敲除并不影响IκBα降解以及P65、IκBα、P38、ERK、JNK磷酸化水平的动态变化(图4)。

图4 敲除ABRO1不影响MEF细胞LPS/TLR4信号通路的活化
2.5敲除ABRO1不影响MEF细胞中NF-κB报告基因活性 利用慢病毒将NF-κB报告基因转入到MEF细胞中,1 μg/ml LPS分别刺激0、3、6 h,结果显示,LPS刺激显著提高NF-κB报告基因活性,但ABRO1 KO和WT的MEF细胞中NF-κB报告基因的活性无显著差异(图5)。
3 讨论
本研究重点揭示了敲除ABRO1对MEF细胞LPS/TLR4通路活化的影响。结果显示,缺失ABRO1并不影响MEF细胞中LPS诱导的IL-6的分泌及IL-6、IL-1β和TNF-α的mRNA水平;ABRO1 KO MEF细胞中,LPS诱导的TLR4下游NF-κB和MAPK信号通路的活化并无明显异常;敲除ABRO1也并不影响LPS对NF-κB报告基因的激活。因此,敲除ABRO1不影响MEF细胞中LPS/TLR4通路的活化。LPS/TLR4通路活化后会激活多种转录因子,其中NF-κB最为关键。正常情况下NF-κB/P65被IκBα限制在胞质,LPS刺激促进IκBα磷酸化,进而IκBα发生降解,释放NF-κB,NF-κB入核后与目的基因特异性结合并使其转录[9]。类似NF-κB通路,LPS/TLR4活化也会促进ERK、JNK和P38发生磷酸化,激活相关核蛋白和转录因子,如AP1等[10]。IL-6等炎症细胞因子是转录因子NF-κB所调控的靶基因,在LPS/TLR4介导的炎症反应及相关疾病中起关键作用[11-12]。本研究重点检测了ABRO1 KO及WT MEF细胞中NF-κB和MAPK信号通路的活化、NF-κB报告基因的活性、炎症因子IL-6、IL-1β和TNF-α的转录以及IL-6的分泌,以探讨ABRO1对MEF细胞LPS/TLR4通路的影响。
已有研究表明,BRISC在免疫反应中发挥着重要作用。BRISC可以调节Ⅰ型干扰素受体IFNAR1的去泛素化并促进其活化,进而参与抗病毒反应[13]。BRISC也可以调节NLRP3去泛素化,进而促进NLRP3炎症小体活化[7]。BRISC还可以通过调节HIV-1病毒Tat蛋白K63位去泛素化,控制其自噬途径的降解[14]。在小鼠骨髓来源巨噬细胞(BMDM)中,敲除ABRO1和BRCC3并不影响LPS/TLR4信号通路的活化[15]。但是LPS处理后的ABRO1敲除小鼠外周血单个核细胞中,IL-1β和IFN-β等细胞因子的mRNA水平明显降低,提示敲除ABRO1可能抑制了某些细胞中LPS/TLR4通路的活化[13]。MEF细胞是研究天然免疫的重要材料,MEF细胞并不是发挥免疫功能的细胞,只有在外界刺激下才产生应答并分泌炎症因子或化学因子等,分泌细胞因子的能力强,MEF细胞的分离比分离纯化免疫细胞更方便,MEF细胞属于贴壁培养细胞,而大多数免疫细胞属于悬浮细胞,因此选用MEF细胞实验过程更容易控制[16]。目前MEF是研究天然免疫过程中某个基因或信号通路较佳的细胞模型[8]。而ABRO1在小鼠MEF细胞中的功能研究尚未报道。我们分离了ABRO1 KO和WT MEF细胞,建立了LPS诱导小鼠MEF细胞炎症模型,发现ABRO1敲除并不影响LPS诱导的炎症细胞因子IL-6的分泌以及TLR4下游NF-κB和MAPK信号通路的活化。说明ABRO1对LPS/TLR4通路的影响可能具有细胞特异性,需要后续进一步确定。

