蓝莓花药组织培养研究
付燕 杨芩 杨月 胡红
摘要 以“杰兔”“灿烂”和“粉蓝”3个兔眼蓝莓品种的花药为试材,采用正交试验设计,研究了植物生长调节剂和不同品种对蓝莓花药愈伤组织诱导和增殖效果的影响,以期为开展蓝莓花药培养创新种质提供科学依据。结果表明,6-BA、2,4-D 和NAA的浓度变化对蓝莓花药愈伤组织诱导有明显影响,其中6-BA 影响最大;MS+1.0 mg/L 6-BA+2.0 mg/L 2,4-D+0.4 mg/L NAA对“灿烂”花药愈伤组织诱导率最高,出愈率为35.67%。同时,将参试的3个品种的花药分别接种在上述培养基中,品种间的出愈率差异显著,依次分别为“杰兔”46.50%、“灿烂”35.70%和“粉蓝”29.50%。此外,以“杰兔”初代培养诱导的愈伤组织继续增殖培养,该研究处理中最佳增殖培养基为MS+1.00 mg/L IAA+1.25 mg/L 6-BA+0.25 mg/L KT+1.00 mg/LNAA,其增殖系数为0.89。
关键词 蓝莓;花药培养;基因型;愈伤组织;增殖
中图分类号 S663.9 文献标识码 A
文章编号 0517-6611(2021)01-0045-03
doi:10.3969/j.issn.0517-6611.2021.01.012
Abstract Orthogonal design was used to study the effects of plant growth regulators and different varieties on the induction and proliferation of anther callus using the anthers of three rabbiteye blueberry Powderblue,Premier and Brightwell as materials,in order to lay a foundation for the innovative germplasm in blueberry.The results showed that the concentration of 6-BA,2,4-D and NAA had significant effects on the induction of anther callus in blueberry,and among which 6-BA had the greatest effect.The optimum medium for anther callus induction of MS+1.0 mg/L 6-BA+2.0 mg/L 2,4-D+0.4 mg/L NAA with the highest induction rate of 35.67%.Meanwhile,there were significant differences in callus induction rate of anthers among different genotypes,and the callus induction rate of ‘Premier was the highest with 46.50%.In addition,the optimum medium for anther callus proliferation of MS+1.00 mg/L IAA+1.25 mg/L 6-BA+0.25 mg/L KT+1.00 mg/L NAA with the proliferation coefficient of 0.89.
Key words Blueberry;Anther culture;Genotype;Callus;Multiplication
藍莓 (Blueberry) 属杜鹃花科 (Ericaceae) 越橘属 (Vaccinium spp.) 植物,为多年生落叶或常绿小灌木果树[1],其果实含有大量的维生素A、C、E 和花青苷等生化物质,具有良好保健功能,备受国内外消费者青睐[2]。目前,国内关于蓝莓的研究主要集中在资源调查、育苗、土壤改良、贮藏加工等方面,而育种,特别是生物技术的研究很少[2-3],主栽品种大多为国外20世纪选育。为促使我国蓝莓产业可持续健康发展,必须加快培育拥有自主知识产权的品种[4]。目前,国内外关于蓝莓品种的选育主要通过野生选种、实生选种、杂交育种和倍性育种获得,其中杂交育种仍是最重要的手段[4-5]。近年来,我国把新品种培育作为保持和提升果品竞争力的有力措施,蓝莓遗传育种研究备受我国科研人员关注和重视[6]。然而,我国蓝莓常规杂交选育种技术由于受种质资源狭窄、周期长等缺点的限制,导致短时间内很难超越其他国家的优良品种,而利用花药培养等现代生物技术育种手段不仅可以加快蓝莓的育种进程,也是创新种质的有效途径[7-8]。
花药培养已在多种果树上成功应用,并获得单倍体、胚状体和胚性愈伤组织[9],而单倍体植株加倍后获得的双单倍体 (DH) 在遗传上具有高度的纯合性[10],可快速纯合优良杂交组合的优异基因,使植株的基因型和表现型完全一致,尤其在选择由隐性基因控制的优良性状时具有明显优势,能极大地缩短育种周期[11]。同时由于基因的纯合性,还可以提高基因作图和基因定位的准确性,因此单倍体植株是果树优质育种、遗传转化以及分子标记、遗传图谱构建和基因克隆等分子生物学研究领域的珍贵材料[12]。目前已有许多果树通过花药或花粉培养,获得了胚性愈伤组织或单倍体植物[11-12],但蓝莓花药培养研究迄今鲜有报道。鉴于此,笔者以7年生“灿烂”“粉蓝”和“杰兔”品种为试验材料,探讨植物生长调节剂、基因型对蓝莓花药培养效果的影响,以期建立蓝莓花药培养体系,为花药培养获取单倍体和双单倍体奠定技术基础,对创新蓝莓种质资源、推进育种工作具有重要的理论价值和现实意义。
1 材料与方法
1.1 材料
以种植于凯里学院卓越农林人才培养实训基地内7年生的蓝莓植株“杰兔”(六倍体,6n=72)、“灿烂”(六倍体,6n=72)、“粉蓝”(六倍体,6n=72)[13]3个品种为参试材料,盛花期采集横径为0.10~0.15 cm、纵径为0.7~0.8 cm的花蕾,显微镜观察花粉粒处于单核期且发育良好的花药为试验材料进行接种培养。
1.2 方法
1.2.1 花药的获得。
将采集的花蕾用70%的酒精去除花冠表面灰尘后,置于(4 ℃)条件下的冰箱中预处理3 d,然后在无菌条件下,用70% 的乙醇浸泡15 s,无菌水清洗3遍,再用0.1% 升汞溶液消毒4 min,清洗4~5遍。将处理好的材料放置于无菌滤纸上吸干水分,小心剥离花药并接种在各处理培养基上。
1.2.2 愈伤组织诱导培养基。
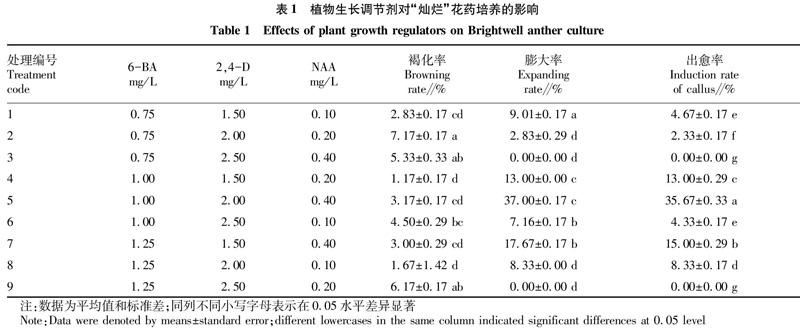
参照段丽君等[14-15]的方法并略有改动,愈伤组织培养基为 MS培养基,pH=6.0,添加蔗糖45 g/L,琼脂9.5 g/L,以“灿烂”花药为试料,采用L9 (33) 正交实验设计,植物生长调节剂6-BA 浓度为0.75、1.00、1.25 mg/L,2,4-D浓度为1.50、2.00、2.50 mg/L,NAA浓度为0.10、0.20、0.40 mg/L。将花药接种到含有不同激素种类的愈伤组织诱导培养基上,每瓶接种4枚花药,每处理共接种150瓶,每50瓶为1个重复,共3次重复,即每个处理共接种600枚花药。
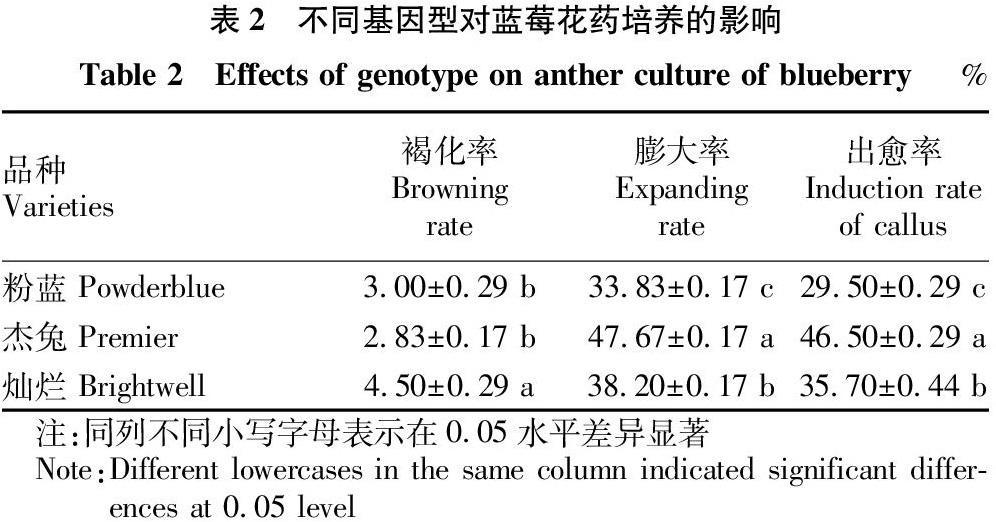
1.2.3 不同基因型对蓝莓花药诱导的影响。将“灿烂”“粉蓝”“杰兔”3个品种的花药分别接种到上述筛选的最佳培养基中,探讨不同基因型对蓝莓花药愈伤组织诱导的影响。
1.2.4 愈伤组织增殖培养基。
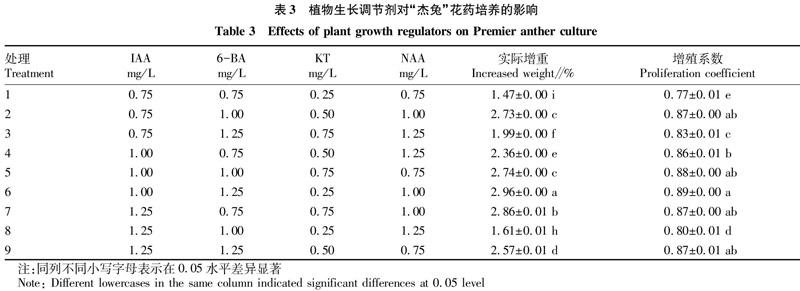
参照黄凤祥等[16]的方法并略有改动,愈伤组织增殖培养基为MS培养基,pH=6.0,添加蔗糖45 g/L,琼脂9.5 g/L,以“杰兔”花药为试料,采用L9(34) 正交实验设计,植物生长调剂6-BA浓度为0.75、1.00、1.25 mg/L,IAA为0.75、1.00、1.25 mg/L,KT为0.25、0.50、0.75 mg/L,NAA浓度0.75、1.00、1.25 mg/L。将直径1.0~1.5 cm的正方体或近圆形蓝莓花药愈伤组织接种到增殖培养基中,增殖周期为40 d,观察愈伤组织生长情况,并称量计算其鲜重增加量。每瓶接种1颗,每个处理均接种30瓶。
愈伤组织诱导和增殖接种后放置于培养室内,光照12 h/d,光强2 000~2 500 lx,温度 (25±1) ℃条件下培养。
1.3 数据统计与分析 接种60 d后统计各处理花药褐化率、膨大率及花药出愈率。增殖培养40 d称量鲜重,并计算增殖系数。用SPSS (16.0) 软件对试验数据进行方差分析,在分析之前先将所有百分率数据进行反正弦转换,处理间差异在0.05的显著水平上进行SNK检验。
褐化率=褐化花药数/接种花药总数×100%
出愈率=出愈花药数/接种花药总数×100%
膨大率=膨大花药数/接种花药总数×100%
增殖系数=(Y-Yo)/Yo
式中,Y为接种40 d后愈伤组织鲜重;Yo为接种时愈伤组织鲜重。
2 结果与分析
2.1 植物生长调节剂对蓝莓花药愈伤组织诱导的影响
接种后跟踪观察发现,接种后第20天左右花药开始膨大,第25天左右有部分花药开始分化愈伤组织,至接种后第33天可见米黄色团状愈伤组织,且部分愈伤组织在不断增殖,随着培养时间的延长,愈伤组织表面颜色由米黄转为绿色,至接种后第50天有少数愈伤组织边缘开始出现褐化的现象,之后随着培养时间的延长,褐化的愈伤组织进而出现干死的现象。同时,从表3可以看出,在培养基中添加不同种类、不同浓度的植物生长调节剂,对花药褐化率、膨大率及愈伤组织的诱导均有显著影响。各处理花药接种60 d后,花药的褐化率为1.17%~7.17%,褐化率最高的为2号处理,即0.75 mg/L 6-BA+2.00 mg/L 2,4-D+0.20 mg/L NAA,其膨大率和诱导率分别仅为2.83%和2.33%。各处理间花药的膨大率和出愈率均存在显著差异,且花药的膨大率与愈伤组织诱导率成正相关,其中5号处理6-BA 1.00 mg/L+2,4-D 2.00 mg/L+NAA 0.40 mg/L的花药膨大率和出愈率最高,分别为37.00% 和35.67%,并显著高于其他处理;其次是7号处理1.25 mg/L 6-BA+1.50 mg/L 2,4-D+0.40 mg/L NAA的花药膨大率和出愈率分别为17.67%和15.00%,再次是4号处理1.00 mg/L 6-BA+1.50 mg/L 2,4-D+0.20 mg/L NAA的膨大率和花药出愈率均为13.00%,其余处理组织的诱导率均为超过10.00%,且3和9号处理的花药膨大率和出愈率均为0。
2.2 不同基因型对蓝莓花药诱导的影响
由表2可知,基因型对蓝莓花药培养诱导愈伤组织有显著影响,不同品种的花药褐化率、膨大率和愈伤组织诱导率存在显著差异。参试的3个品种中,“灿烂”的褐化率最高,为4.50%,且显著高于“粉蓝”的3.00%和“杰兔”的2.83%。基因型对膨大率和出愈率的影响趋势一致,“杰兔”的膨大率和出愈率均最高,分别为47.67%和46.50%,且均显著高于灿烂的膨大率 (38.20%) 和出愈率 (35.70%),粉蓝的膨大率 (33.83%) 和出愈率 (29.50%)最低,且均顯著低于“杰兔”和“灿烂”。
2.3 植物生长调节剂对蓝莓增殖效果的影响
增殖培养跟踪观察发现,愈伤组织在整个增殖周期中质地均为致密状态,颜色由最初绿色变为褐绿色,随着培养时间推移颜色不断变深,鲜重不断增加。培养至第35天左右,愈伤组织鲜重几乎不再增加,并出现褐化。由表3可知,不同浓度植物生长调节剂组合对“杰兔”蓝莓花药愈伤组织增殖效果有显著影响,其中 6号处理实际增加鲜重显著高于其他处理,为2.96 g,增殖系数最高,为0.89;1号处理实际增加鲜重最低,为1.47 g,增殖系数也最低。综合考虑,6号处理组合,即MS+1.00 mg/L IAA+1.25 mg/L 6-BA+0.25 mg/L KT+1.00 mg/L NAA对“杰兔”花药愈伤组织增殖效果最好。
3 结论与讨论
花药离体培养可以使小孢子产生单倍体,是果树育种中种质资源创新的最有效方法之一[17],获得的单倍体经加倍形成纯合二倍体,能加快获得某一性状纯系,同时极大地丰富了亲本种质资源,从而更好地实现倍性育种,加快育种进程[18-19]。目前,苹果[17]、枇杷[15]、枸杞[20]、枣[21]、火龙果[9]、木瓜[22]、扁桃[10]、甜橙[23]、软枣猕猴桃[24]等果树已通过花药或花粉培养获得愈伤组织、胚状体、单倍体植株。研究表明,植物花药愈伤组织形成受多种因素影响,其中激素是影响花药愈伤组织诱导的关键因素,植物生长调节剂的种类、浓度和配比的差异直接影响植株的再生率[11,15-16]。该研究发现,不同种类和不同浓度的植物生长调节剂对蓝莓花药愈伤组织的诱导均有显著影响,这与植物生长调节剂对枇杷[15]、软枣猕猴桃[24]等果树的花药愈伤诱导的影响一致。该研究以“灿烂”花药为试材,在研究植物激素种类和浓度对愈伤组织诱导影响中获得的最高诱导率为35.67%,与段丽君等[14]在冬枣和范建新等[9]在火龙果上的花药愈伤诱导率相似,总体上诱导率不高,这可能是因为该研究正交实验中植物生长调节剂的种类或浓度梯度还不够合理,需要进一步优化。
将不同品种的花药接种在相同培养基上进行培养,发现“杰兔”兔眼蓝莓花药的诱导率均显著高于“灿烂”和“粉蓝”,这表明基因型对蓝莓花药愈伤组织诱导可产生显著影响,这与火龙果[9]上的研究结果一致。该研究虽然通过正交试验获得了比较成熟的蓝莓花药愈伤组织增殖配方,但增殖系数不高 (最大仅为0.89)。因此,建议在后期的优化研究中可添加诱导效果更好的TDZ,比较其对蓝莓愈伤组织增殖和再分化的影响。
参考文献
[1]胡选萍,秦公伟,曹小勇.蓝莓组织培养技术的研究进展[J].分子植物育种,2018,16(3):960-965.
[2]张晋,李江舟,赵雪丽,等.蓝莓品种“顶级”花药培养技术体系的建立[J].分子植物育种,2019,17(20):6756-6761.
[3]吴林.中国蓝莓 35 年——科学研究与产业发展[J].吉林农业大学学报,2016,38(1):1-11.
[4]孙海悦,李亚东.世界蓝莓育种概述[J].东北农业大学学报,2014,45(9):116-122.
[5]王慧亮,张慧琴,肖金平,等.蓝莓育种研究概况[J].浙江农业科学,2010,51(3):474-481.
[6]朱宏芬,刘健,徐兵兵.高丛蓝莓杂交育种及种子萌发研究[J].安徽农业科学,2016,44(36):55-57,69.
[7]余宏傲,叶朝军,康华靖,等.高丛蓝莓品种“薄雾”愈伤组织高效诱导及胚性转化[J].分子植物育种,2019,17(12):4042-4053.
[8]段元杰,劉海刚,孟富宣,等.枣树花药组织培养研究进展[J].江西农业学报,2016,28(11):47-50.
[9]范建新,邓仁菊,王永清,等.火龙果花药培养诱导胚性愈伤组织及遗传稳定性[J].分子植物育种,2017,15(1):258-266.
[10]CIM G,MARCHESE A,GERMAN M A.Microspore embryogenesis induced through in vitro anther culture of almond (Prunus dulcis Mill.)[J].Plant cell,tissue organ culture,2017,128(1):85-95.
[11]王广富,艾军,秦红艳,等.果树花药培养及单倍体植株鉴定研究进展[J].特产研究,2016,38(4):68-72.
[12]张圣仓,魏安智,杨途熙.果树单倍体和加倍单倍体 (DH) 技术研究与应用进展[J].果树学报,2011,28(5):869-874.
[13]SAKHANOKHO H,RINEHART T A,STRINGER S J,et al.Variation in nuclear DNA content and chromosome numbers in blueberry[J].Scientia horticulturae,2018,233:108-113.
[14]段丽君,邓青云,李国元,等.冬枣花药培养愈伤组织诱导的影响因素[J].江苏农业科学,2016,44(1):60-62.
[15]陶炼,潘翠萍,谢红江,等.枇杷花药胚状体诱导条件的优化[J].热带作物学报,2015,36(12):2223-2229.
[16]黄凤翔,管艳,桂明春,等.正交实验法优选橡胶树花药愈伤组织诱导的研究[J].北方园艺,2014(18):109-111.
[17]温鑫,邓舒,张春芬,等.“嘎啦”苹果花药培养种质创新[J].中国农业科学,2017,50(14):2793-2806.
[18]GERMAN M A.Gametic embryogenesis and haploid technology as valuable support to plant breeding[J].Plant cell reports,2011,30(5):839-857.
[19]GERMAN M A.Anther culture for haploid and doubled haploid production[J].Plant cell,tissue and organ culture,2011,104(3):283-300.
[20]段丽君,曹有龙.枸杞花药培养研究[J].种子,2018,37(9):100-105.
[21]韓晶,王玖瑞,代丽,等.“长红枣”和“金丝小枣”离体花药不定芽的诱导[J].河北农业大学学报,2014,37(6):38-42.
[22]CHONG-PREZ B,CARRASCO B,SILVA H,et al.Regeneration of highland papaya (Vasconcellea pubescens) from anther culture[J].Applications in plant sciences,2018,6 (9):1-7.
[23]CARDOSO J C,MARTINELLI A P,GERMAN M A,et al.In vitro anther culture of sweet orange (Citrus sinensis L.Osbeck) genotypes and of a C.clementina × C.sinensis ‘Hamlin hybrid[J].Plant cell,tissue and organ culture,2014,117(3):455-464.
[24]WANG G F,QIN H Y,SUN D,et al.Haploid plant regeneration from hardy kiwifruit (Actinidia arguta Planch.) anther culture[J].Plant cell,tissue and organ culture,2018,134(1):15-28.

