喀斯特特有植物罗甸小米核桃响应土壤水分的表型可塑性
程 晶,刘济明,*,王 姝,王 灯,李丽霞,徐国瑞,陈 梦,黄路婷
(贵州大学 a.林学院;b.森林生态研究中心,贵州 贵阳 550025)
土壤水分是影响植物光合作用和物质转运等生理活动的重要因素[1]。水分胁迫下植物叶片对光的利用能力减弱[2-3],净光合速率降低。喀斯特生境地区在水平和垂直空间上具有高度异质性,表现为土被不连续,地表复杂度高且地物分布不均,植被片段化严重[4-5],石面、石缝、石沟、石洞、石槽、土面等不同类型小生境之间土壤水分差异更明显。由于特殊的岩溶地质地貌和气候环境形成了喀斯特地区地表地下不同形态的双层空间结构,裂隙、洞穴及地表地下各种堆积形态形成了不均匀的“二元结构”,喀斯特二元结构加剧土壤水分向深层渗漏,在一定程度上限制了植物的分布与生长[6-7]。
罗甸小米核桃(JuglansregiaL.f.luodianenseLiu et Xu)系胡桃科胡桃属植物,为中国西南喀斯特地区特有物种,适应当地喀斯特石漠化生境[8],能在这种高度异质的喀斯特生境中良好地生长,说明该物种对水分的响应具有很强的可塑性。喀斯特地区频繁的土壤干旱是限制该地区植物生长分布的主要因子[9-10],植物可通过发达的根系吸收土壤深层水和地下水来适应喀斯特地区的季节性干旱[11],如刺槐(Robiniapseudoacacia)幼苗在土壤水分胁迫条件下,通过发达的根系获取土壤深层水分来保证正常生长[12]。
植物表型可塑性指植物对不同环境因子(如土壤水分、营养、光照等)变化做出响应而产生的不同特征表现,是植物对异质生境的生态适应策略[13]。植物的生长发育、功能及生活史特征对外界环境均有可塑性响应[14]。最典型的例子是同一植株上产生形态迥异的“沉水叶”和“气生叶”以适应水下和水上两种生境[15]。金静等[16]研究了喀斯特生境植物木豆(Cajanuscajan)在水分影响下的表型可塑性,随土壤含水量亏缺,木豆幼苗分配到根的生物量增加,叶生物量减少,表明木豆幼苗能通过器官生物量分配和形态结构调整来提高对干旱环境的适应能力。植物通过表型可塑性变化,如调整各种形态结构或生理生化性状来适应异质生境,提高了对环境资源的获取能力,最大限度利用了资源,从而降低了逆境对植物生长的负面影响[17-18]。无论在自然界或者人工控制的生态系统,植物在变动水分条件下的表型可塑性研究,包括植物根、茎、叶的形态、生理生化及植物的繁殖、生活史等各方面特征己经成为新的研究热点[19-21]。
目前关于罗甸小米核桃的研究只集中在植物栽培、生理生化[22-25]及果实品质评价[26]方面,对表型可塑性的研究报道较少。本试验选用1年生罗甸小米核桃,设置4个水分梯度,研究罗甸小米核桃幼苗形态、生物量分配及生理指标对土壤水分变化的可塑性响应,探讨罗甸小米核桃在不同水分环境下的适应能力,为进一步了解喀斯特特有植物对土壤水分变化的生态适应策略提供依据。
1 材料与方法
1.1 研究区概况
研究地点位于贵阳市花溪区贵州大学南校区林学院苗圃试验地,海拔约1 022 m,年均温度15.3 ℃,年均总降水量1 129.5 mm,年均相对湿度77%,年均日照时数1 148.3 h,年均降雪时间11.3 d。夏无酷暑,冬季温暖。试验地土壤由石灰岩发育而来,呈微碱性,肥力中等,田间持水量约为26.4%。
1.2 试验设计
于秋冬季节收集同一母株上的种子,去除杂质和果皮,采用0.4%的高锰酸钾溶液消毒30 min后4 ℃储存。试验前进行发芽预试验,观测种子发芽特性良好,然后另选一批种子种入托盘中,于3~4叶期移植入花盆。正常条件下缓苗1个月后,选择长势一致、无病害植株的幼苗进行水分处理。采用控水试验,以Hsiao[27]关于中生植物的水分梯度划分为依据,设置4个水分梯度,其土壤含水量分别为田间持水量的(100±5)%(轻度高水胁迫,W1,含水量26.4%)、(80±5)%(正常供水,CK,含水量21.1%)、(60±5)%(轻度低水胁迫,W2,含水量15.8%)、(40±5)%(中度低水胁迫,W3,含水量10.6%)。每个处理20盆,总共80盆。每天18:00称量盆的质量,补充当天失去的水分,以维持设定的土壤含水量。
1.3 数据收集
1.3.1 形态及生长指标
控水2个月后测定所有处理苗木各器官的指标,在每种水分处理中随机选取5株苗木整株收获,分为地上部分和地下部分取样,每个样株清洗干净后将地上部分的茎、叶和地下部分的根分别放入牛皮信封中,在110 ℃的烘箱中杀青1 h 后在70 ℃下烘干至质量恒定,分别测定各器官生物量及总生物量(total biomass,TB),根长(root length,RL)和苗高(seedling height,H)采用钢卷尺测定;地径(diameter,D)采用游标卡尺测定,叶面积(leaf area,LA)采用叶面积仪(Yaxin-1241)扫描测定,叶片厚度(leaf thickness,LT)采用叶片厚度测定仪(YH-1)测定。其中,根冠比(root shoot ratio,RSR)=地下部分生物量/地上部分生物量,其中地上部分生物量为茎生物量(stem biomass,SB)与叶生物量(leaf biomass,LB)之和;比叶面积(specific leaf area,SLA)=单面面积/干重;叶片肉质化程度(leaf succulence,LS)=叶鲜重/干重;根茎比(ratio of root and stem,RRS)=根长/茎长。
叶片组织结构紧密度(cell tense ratio,CTR)和叶片组织结构疏松度(spongy ratio,SR)的观测用石蜡切片法[28]。在显微镜下观察并用显微测微尺测量其叶片总厚度、栅栏组织厚度、海绵组织厚度,每个处理做5个切片,每片观察5个视野。叶片组织结构紧密度(CTR)和组织结构疏松度(SR)的计算公式[29]分别为:CTR(%)=栅栏组织/叶片厚度×100;SR(%)=海绵组织/叶片厚度×100。
1.3.2 生理指标
控水2个月后,在每个处理下选择5株生长态势一致的成熟叶片,采用光合作用仪(Li-6400xt,LiCor公司,美国),于一晴天09:00—12:00测量净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)。选取5株植物的成熟叶片用80%丙酮提取叶片色素,用分光光度计(UV-2800A,UNICO公司,美国)测定叶绿素a(Chl a)、叶绿素b(Chl b)含量,并计算叶绿素总量(Total Chl)以及叶绿素a/b(Chl a/b)[30]。
1.3.3 可塑性指数
可塑性指数参考Ashton等[31]方法,计算公式为P=(Xmax-Xmin)/Xmax。其中,P为不同水分环境中各指标的可塑性指数,Xmax和Xmin分别表示各指标的最大值与最小值。
1.4 数据分析
采用Excel 2010对数据进行初步统计,用SPSS 18.0对试验数据进一步处理,使用One-way ANOVA分析不同水分处理对受体植物幼苗形态、生物量和生理指标影响的差异显著性,并利用Duncan多重比较法进行检验(P=0.05)。
2 结果与分析
2.1 不同水分条件对罗甸小米核桃幼苗的形态特征的影响
罗甸小米核桃幼苗的形态特征在不同水分处理下存在明显差异(表1)。正常供水(CK)处理下植物的苗高高于其他处理组,与轻度高水胁迫W1处理间差异不显著(P>0.05),而与轻度低水胁迫W2、中度低水胁迫W3两组处理差异显著(P<0.05)。W3处理下植物的地径最小,与其他3组处理差异显著(P<0.05),而其他3组处理下植物的地径差异均不显著(P>0.05)。植物的叶面积和比叶面积在CK与W1处理下显著高于W2与W3(P<0.05),叶面积在正常供水处理下达最大值,与其他3组处理差异显著(P<0.05),且中度低水胁迫处理下植物的叶面积最小。比叶面积在W1处理下达到最大,与CK处理差异不显著(P>0.05),与其他两组处理差异显著(P<0.05)。W2处理下罗甸小米核桃幼苗有最大的根茎比0.88,CK处理下的根最长。方差检验表明,根茎比与根长在各水分梯度下的差异不显著(P>0.05);W1下的叶片肉质化程度最高,CK、W1与W2环境下叶片肉质化程度差异不显著(P>0.05),但三者均显著(P<0.05)高于W3处理。

表1 不同水分条件下罗甸小米核桃幼苗形态特征Table 1 Morphological traits of J.regia seedlings under different water conditions
不同水分处理下罗甸小米核桃幼苗的叶片结构存在较大差异(表2)。罗甸小米核桃幼苗叶片中栅栏组织在CK处理下最厚,随着土壤含水量降低,栅栏组织的厚度开始下降,但中度低水胁迫处理下栅栏组织厚度极显著(P<0.01)高于轻度低水胁迫处理;海绵组织厚度分别在W2和W1处理下达到最大和最小,CK与W3处理相差不大;叶片厚度在CK处理下最大,受到轻度高水胁迫W1时下降,并随着土壤水分含量的降低而逐渐降低;栅栏组织与海绵组织之比和叶片组织结构的紧密度(CTR)变化趋势较为一致,均以W1为最高,与W2处理存在极显著差异(P<0.01)。叶片组织结构疏松度(SR)的变化情况与前者正好相反,W2极显著(P<0.01)高于W1处理。
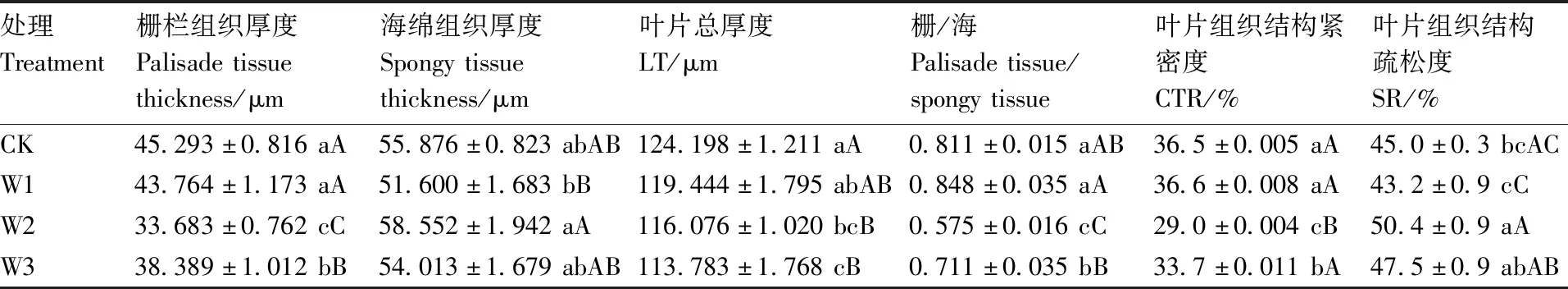
表2 不同水分条件下叶片组织厚度Table 2 Blade thickness under different water conditions
2.2 不同水分条件对罗甸小米核桃幼苗生物量积累与分配的影响
不同水分处理下罗甸小米核桃幼苗的各部位生物量存在一定差异(图1),但均在CK处理后的效果较好。地上部分叶的生物量指数均呈现为CK>W1>W2>W3。在不同水分处理下茎生物量各组间差异显著(P<0.05),CK处理与其他3组处理呈现极显著差异(P<0.01),且W2处理下茎生物量最小。不同水分处理下各组间的根生物量也存在显著差异(P<0.05),W2处理下均极显著低于CK和W3(P<0.01)。总生物量在W2和W3处理下差异不显著(P>0.05),CK处理下总生物量极显著(P<0.01)高于其他处理。
罗甸小米核桃幼苗的叶生物量比在轻度高水胁迫处理下最大,与轻度低水胁迫处理间无显著差异(P>0.05)(图2),在中度低水胁迫处理下最小。在CK和W3处理下的茎生物量比无显著差异(P>0.05),与其他两组呈显著差异(P<0.05)。不同水分处理下各组间的根冠比和根生物量比差异呈现出相似的规律(W3>W2>CK>W1),并且差异显著(P<0.05)。根生物量比在W3处理下达到最大,与其他3组处理差异显著(P<0.05),其中CK和W2处理间差异不显著(P>0.05),根冠比指数呈现一样的趋势。
2.3 不同水分条件对罗甸小米核桃幼苗叶绿素含量的影响
不同水分处理下罗甸小米核桃幼苗叶绿素含量的变化如图3所示,叶绿素a在不同水分处理间差异不显著(P>0.05)。叶绿素b随着土壤含水量降低逐渐出现下降趋势,W1处理下叶绿素b含量与其他3组处理间有显著差异(P<0.05),叶绿素a/b在W1处理下值最小,与CK差异不显著(P>0.05),而与其他两组处理差异显著(P<0.05)。叶绿素总量在W1处理下值较大,但与其他组间差异不显著(P>0.05)。
2.4 不同水分条件对罗甸小米核桃幼苗光合参数的影响
罗甸小米核桃幼苗净光合速率、气孔导度、胞间CO2浓度以及蒸腾速率变化趋势如图4所示,净光合速率与蒸腾速率在CK处理下达最大值,与W1处理间差异不显著,但CK和W1处理显著高于另外两组(P<0.05);胞间CO2浓度在CK、W1和W3处理间差异不显著(P>0.05),显著低于W2处理(P<0.05);气孔导度均呈现随着土壤含水量的降低而减小的趋势,且CK和W1与其他两组均有显著差异(P<0.05)。
2.5 不同水分条件对罗甸小米核桃幼苗可塑性指标综合评价
罗甸小米核桃幼苗各形态特征、生物量分配、光合参数等各性状对不同水分处理的可塑性差异很明显(图5)。在形态指标中,叶面积可塑性指数最大(0.48),其次为叶片肉质化程度,最小的为叶片厚度(0.08),基本上无明显变化。在生物量分配指标中,茎生物量可塑性指数最大(0.48),其次是叶生物量,可塑性最低的为茎生物量比指数。在光合参数指标中,净光合速率的可塑性居高(0.50),其次为气孔导度和蒸腾速率,最小为胞间CO2浓度(0.09)。在叶绿素含量变化中,叶绿素a/b的可塑性指数较高(0.23),而叶绿素a的可塑性指数是所有指标中最小的(0.02)。综合比较各指标可塑性分析表明,罗甸小米核桃幼苗在不同水分条件下的净光合速率可塑性最高,其次为叶面积和茎生物量,最低的为叶绿素a。
3 结论与讨论
3.1 不同水分条件对罗甸小米核桃幼苗形态特征的影响
植物的形态特征和生物量分配是植物对异质生境响应的外在体现。植物生长量降低是对干旱胁迫的一种响应[32],本研究中罗甸小米核桃幼苗在低水胁迫下,其苗高、地径、叶面积、比叶面积、根长、叶片肉质化程度以及叶厚均随土壤水分胁迫加剧而下降;而在轻度高水胁迫下,以上特征也表现出轻微的抑制作用,说明罗甸小米核桃幼苗形态特征在不同水分处理下存在可塑性调整。在水分亏缺严重情况下,叶片扩展受抑制,从而影响总叶面积,植物通过调节叶片叶面积和关闭气孔来稳定生长活动[33]。本研究中,水分胁迫处理对罗甸小米核桃幼苗的叶面积和比叶面积(SLA)有显著影响,当轻度低水胁迫下,叶面积和SLA急剧降低,说明幼苗在水分亏缺时能通过降低比叶面积等行为来减少植物内部水分散失,这与李永华等[34]研究结果相似。植物叶片组织结构紧密度在轻度低水胁迫下最低,而在中度低水胁迫下却有所增加,说明罗甸小米核桃幼株通过增加叶片组织结构紧密度有效地提高了叶片输水效率、减少蒸腾以维持基本的光合作用能力[29]。
3.2 不同水分条件对罗甸小米核桃幼苗生物量积累与分配的影响
在胁迫过程中,植物生物量分配可直接影响资源获取及环境适应能力[35-36]。本研究中,罗甸小米核桃幼苗的茎叶生物量分配在轻度高水胁迫之后下降,根部资源投入增多,根冠比增加,总生物量下降。有研究表明,植物在胁迫条件下,会调节地上和地下生物量比例来适应环境变化[37]。轻度高水胁迫下,罗甸小米核桃相对减少了对茎部投入,加大对叶部的投入,但这方面的改变在水分亏缺严重时被再次扭转。同时,幼苗在受到轻度高水胁迫后随着土壤含水量的降低,植株逐渐将更多的资源分配到根部,根冠比总体上表现出逐渐增加的趋势,以中度低水胁迫时最大,说明长期生活在中度低水胁迫下的罗甸小米核桃幼株不得不提高对根部的投入,最大限度地吸收周边的水分以维持基本的生理活动,这与邱权等[38]的研究结果相一致。
3.3 不同水分条件对罗甸小米核桃幼苗光合指标的影响
植物的叶绿素含量在一定程度上反映着植物的光合能力,在不同水分条件下,植物叶绿素含量的变化呈现出不同结果。研究表明,水分胁迫会降低叶绿素含量[39-40]。本研究中,轻度高水胁迫下叶绿素b及叶绿素总量均达到最大,随着水分亏缺严重后下降,说明轻度高水胁迫环境里生长的罗甸小米核桃幼苗收集光能的效率最高,同时叶绿素a含量的增加提高了其进行光化学反应的能力。植物的叶绿素含量对不同水分条件反应敏感,叶绿素含量增加可能与植物对环境因子的补偿和超补偿效应有关[41]。在轻度低水胁迫下的罗甸小米核桃幼苗通过提高叶绿素a/b值以保证对光能的充分利用,提高转化率,增强体内代谢活动,以提高其在该水分胁迫环境下的适应性。
植物叶片的光合生理特征可用来反映植物对干旱胁迫的适应性[32,42]。本研究中,气孔导度、净光合速率以及蒸腾速率基本上都随着水分胁迫加剧而降低,说明其控制失水和维持体内水分平衡能力较强。植物光合作用受到的限制主要是由气孔或者叶肉细胞变化引起,而导致植物Pn下降的原因主要有气孔限制和非气孔限制两类[43]。在轻度低水胁迫后,叶片Pn明显下降,也伴随着Tr下降,说明此时的Pn下降可能与气孔限制有关,在光合能力下降的同时,导致了胞间CO2浓度(Ci)的上升。而在中度低水处理下,气孔导度降低,净光合速率反而有所升高,说明此时非气孔因素影响了幼苗叶片的光合作用。
3.4 不同水分条件对罗甸小米核桃幼苗可塑性指标的综合评价
在胁迫条件下,植物可通过调节其形态特征、生物量分配、气孔开闭、光合作用等方式形成适应性的生存对策[44-46]。叶片是植物对环境变化较为敏感且可塑性较大的器官[47],其形态结构和生理变化反映了环境因子对植物的影响和植物对环境的适应[48]。本研究综合各可塑性指标,罗甸小米核桃幼苗的形态特征、生物量分配、光合指标对不同水分处理的可塑性差异较明显,主要通过灵活改变叶面积及叶片肉质化程度的外在形态结构,茎生物量和叶生物量的资源分配,以及调整净光合速率、气孔导度、叶绿素a/b和叶绿素b的内在生理性状来响应水分变化,最大限度地获取现有资源,维持生长。
综上所述,罗甸小米核桃幼苗在不同水分处理下存在可塑性调整,在正常供水和轻度高水胁迫下均能良好生长,表型性状强于其他水分条件,能良好地适应轻度土壤水分胁迫,这种适应性很有可能是其能够长期稳定生存在喀斯特复杂生境中的基础。

