下调CDKL1基因表达水平对食管癌细胞增殖和侵袭能力的影响
陈晓燕,罗金键,汪秀梅,许亚坡,张茂华,王莹莹
(郑州大学附属郑州中心医院 消化科,河南 郑州 450002)
食管癌占所有癌症的1%,是全球第8种常见的癌症类型,在癌症相关死亡人数中居第6位[1]。每年约有508 585例食管癌患者死亡,占所有癌症相关死亡人数的6.6%[2]。所有诊断出的食管癌病例中有50%以上发生在亚洲国家,食管癌患者5 a生存率很低[3-4]。局部晚期食管癌患者的5 a生存率为20%[5]。食管癌患者的标准治疗方式主要包括手术治疗、放疗和化疗。近年来有关食管癌的诊断及治疗方面取得了重大进展,但是由于肿瘤生长迅速,转移率高,食管癌患者的预后仍然很差。肿瘤分子靶向治疗是新兴的癌症治疗方法。鉴定分子标志物可能为食管癌的诊断、治疗提供关键的线索。细胞周期蛋白依赖性蛋白样激酶1(cyclin dependent kinase like 1,CDKL1)是一种丝氨酸/苏氨酸蛋白激酶,属于细胞周期调控蛋白2(cell division control protein 2,CDC2)相关蛋白激酶家族[6-7]。CDKL包括5个成员,根据细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)与CDKL1的结构关系,鉴定了CDKL1~CDKL5[8]。CDKL1基因与恶性肿瘤的发生、发展密切相关,被认为是胃癌[8]、乳腺癌[9]和结直肠癌[10]增殖和侵袭的重要调控因子。本研究探讨CDKL1基因在食管癌患者中的表达情况,与患者临床病理参数的相关性,以及对肿瘤细胞增殖及侵袭能力的影响,以期为寻找最佳的临床诊疗方案提供参考。
1 材料与方法
1.1 一般资料收集郑州大学附属郑州中心医院2017年6月至2019年6月经病理确诊的50例食管癌患者的临床资料。所有标本均在手术进行中收集。患者及家属签署知情同意书。人食管癌细胞系(TE1,TE7,EC1,EC109)和人正常食管上皮细胞系Het-1A购自中国科学院细胞库;RNAiso plus、反转录试剂盒、SYBR®Premix Ex TaqTMⅡ购自日本TaKaRa公司;聚合酶链反应(polymerase chain reaction,PCR)仪购自美国Agilent公司;倒置显微镜购自美国Leika公司;CDKL1的小干扰RNA(small interfering RNA,siRNA)和对照组的siRNA均购自吉玛公司;引物均由上海生工生物工程有限公司合成。
1.2 细胞培养在RPMI1640培养液中(体积分数为10%的胎牛血清、100 U·mL-1的青霉素和100 U·mL-1的链霉素)培养食管癌细胞系,将培养液置于37 ℃、含体积分数为5%的CO2的加湿培养箱中培养。3 d更换1次培养液,取对数生长期的细胞进行实验。
1.3 实时荧光定量PCR(1)使用Trizol试剂从组织或细胞中提取RNA,采用Nanodrop核酸蛋白测定仪检测RNA浓度及纯度。(2)严格按照试剂盒说明书操作进行反转录反应,将得到的cDNA冻存于-20 ℃待用。(3)实时荧光定量PCR(real-time fluorescent quantitative PCR,qRT-PCR):以第(2)步提取的cDNA作为模板,应用SYBR®Premix Ex TaqTMⅡ试剂盒进行PCR。应用Agilent Mx3005P仪器行定量检测和溶解曲线的分析,每个样本反应均设3个复孔。实验均重复3次,并计算均值。内参磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)上游引物序列为5’-TGACTTCAACAGCGACACCCA-3’,下游引物序列为5’-CACCCTGTTGCTG-TAGCCAAA-3’。CDKL1上游引物序列为5’-CGAATGCTCAAGCAACTCAAGC-3’,下游引物序列为5’-GCCAAGTTATGCTCTTCACGAG-3’。
1.4 siRNA的转染根据CDKL1基因序列分别设计靶序列为5’-CTACTGTGATACCAAGAAA-3’的siRNA,即为si-CDKL1组,转染无意义序列组(5’-TTCTCCGAACGTGTCACGT-3’)为对照组。当细胞密度达到80%左右时,将siRNA-转染试剂混合液(opti-MEM培养液+ Lipofectamine 3000+siRNA)加入含有细胞及培养液的孔中,使其混合均匀。于CO2培养箱中37 ℃温育48 h后,检测转染效率并进行其他实验。
1.5 CCK-8实验检测细胞增殖能力将细胞密度调整为1×107L-1,在96孔板每孔中加入100 μL的细胞悬液,分别在0、1、2、3 d测定细胞在450 nm处的吸光度(optical density,OD)。测定前需要避光加入CCK-8混匀,每孔10 μL,培养箱中静置孵育1 h。
1.6 平板克隆实验检测食管癌细胞克隆形成能力取对数生长期的细胞重悬于含体积分数为10%的胎牛血清的培养液中,将细胞悬液进行倍数稀释,按照每孔50个细胞接种于6孔板中,补加培养液至4 mL,静置培养。当出现肉眼可见的克隆时,终止培养,使用多聚甲醛固定,结晶紫染色,在显微镜下计数。
1.7 transwell实验检测细胞侵袭能力分别用不含血清的RPMI-1640培养液重悬实验组及对照组细胞,制备单细胞悬液,每毫升约2×105个。将各处理组细胞用胰酶消化并接种于铺有25 μL Matrigel胶的小室中。上室加200 μL细胞悬液,下室加600 μL含10%(体积分数)血清的培养液,培养24 h后取出小室,多聚甲醛固定,结晶紫染色,在荧光显微镜下观察并记录。于每孔中随机选取5个视野,计算细胞总数并求其平均值。
1.8 免疫组化染色根据免疫组化染色强度(阴性为 0分,弱为1分,中等为2分,高为3分)和染色成阳性的肿瘤细胞密度(0为0分,1%~40%为1分,41%~75%为2分,>75%为3分)评估染色情况。将强度得分和密度得分相乘,得到每个样本的最终免疫反应性得分。

2 结果
2.1CDKL1mRNA在食管癌癌组织及与其毗邻的癌旁组织中的表达情况CDKL1mRNA在食管癌癌组织中的表达水平(1.805±0.157)较癌旁组织中的表达水平(1.111±0.095)高(t=3.774,P<0.001)。
2.2 CDKL1蛋白在食管癌组织及与其毗邻的癌旁组织中的表达情况在食管癌癌旁组织中,CDKL1阴性表达35例,弱阳性表达15例;在癌组织中,CDKL1阴性表达10例,弱阳性表达25例,阳性表达15例 。见图1。
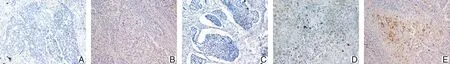
A为癌旁组织CDKL1阴性表达;B为癌旁组织CDKL1弱阳性表达;C为癌组织CDKL1阴性表达;D为癌组织CDKL1弱阳性表达;E为癌组织CDKL1阳性表达。
2.3 CDKL1蛋白在食管癌组织及与其毗邻的癌旁组织中表达水平的免疫组化评分CDKL1蛋白在癌旁组织和癌组织中的免疫组化评分分别为0.880±0.145、2.360±0.191。CDKL1蛋白在食管癌组织中的免疫组化评分高于癌旁组织(t=6.174,P<0.001)。
2.4CDKL1mRNA与食管癌患者临床病理参数的相关性肿瘤分期Ⅲ~Ⅳ期食管癌患者的CDKL1mRNA表达率高于肿瘤分期0~Ⅱ期者(P<0.05)。淋巴结转移的食管癌患者的CDKL1mRNA表达率高于淋巴结未转移者(P<0.05)。CDKL1mRNA表达水平与食管癌患者的性别、年龄、肿瘤分化程度无关(P>0.05)。见表1。CDKL1mRNA在癌旁组织中低表达36例,高表达14例;CDKL1mRNA在食管癌细胞系中低表达14例,高表达36例。CDKL1mRNA在食管癌细胞系中的表达率[72.0%(36/50)]高于癌旁组织[28.0%(14/50)](χ2=19.360,P<0.05)。
2.5CDKL1mRNA在食管癌细胞系中的表达情况CDKL1mRNA在食管癌细胞系TE1、TE7、EC1和EC109的表达水平分别为2.268±0.139、0.602±0.008、1.014±0.068、1.352±0.171,CDKL1mRNA在食管正常上皮细胞系Het-1A中的表达水平为0.327±0.023。CDKL1mRNA在食管癌细胞系TE1、TE7、EC1和EC109的表达水平均高于在食管正常上皮细胞系Het-1A中的表达水平(t=13.770、11.200、9.574、5.943,P=0.005、0.008、0.011、0.027)。

表1 CDKL1 mRNA与食管癌患者临床病理参数的相关性(n)
2.6 siRNA技术对食管癌细胞系中CDKL1mRNA表达水平的影响以上结果表明CDKL1mRNA在细胞系TE1中表达水平最高,故选择TE1来进行以下实验。与对照组比较,siRNA技术能够下调TE1细胞上CDKL1mRNA的表达水平(t=10.250,P<0.001)。见图2。

aP<0.05。
2.7 下调CDKL1mRNA对食管癌细胞增殖能力的影响si-CDKL1组食管癌细胞增殖能力弱于对照组(P<0.05)。食管癌细胞增殖能力情况见表2和表3。
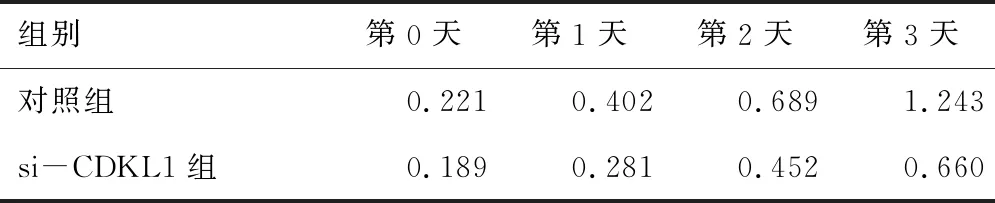
表2 第1次采用CCK-8实验检测食管癌细胞增殖能力情况

表3 第2次采用CCK-8实验检测食管癌细胞增殖能力情况
2.8 下调CDKL1对食管癌细胞克隆形成能力的影响镜下结果显示,si-CDKL1组食管癌细胞克隆形成能力弱于对照组。见图3。

A为对照组食管癌细胞克隆形成情况;B为si-CDKL1组食管癌细胞克隆形成情况。
2.9 下调CDKL1对食管癌细胞克隆形成数量的影响si-CDKL1组食管癌细胞克隆形成的数量少于对照组(t=14.140,P=0.005)。见图4。对照组两次的细胞克隆形成数量分别为80、85;si-CDKL1组两次的细胞克隆形成数量分别为35、30。

aP<0.05。
2.10 下调CDKL1对食管癌细胞侵袭能力的影响镜下观察24 h侵袭结果显示,si-CDKL1组食管癌细胞侵袭能力弱于对照组。见图5。

A代表对照组情况;B代表si-CDKL1组情况。
2.11 下调CDKL1对食管癌细胞侵袭数量的影响si-CDKL1组食管癌细胞侵袭数量少于对照组(t=11.310,P=0.008)。见图6。对照组两次的细胞侵袭数量分别为60、55;si-CDKL1组两次的细胞侵袭数量分别为15、20。

aP<0.05。
3 讨论
食管癌是一种高度恶性的消化道肿瘤,在世界范围内居男性和女性癌症相关死亡原因的第5位和第8位,由于确诊晚、生长迅速和转移,其5 a生存率仅为26.2%[11]。食管癌在全球范围内是癌症相关死亡的第六大原因,食管鳞癌是世界范围内的主要病理亚型[12-13]。尽管近年来针对食管癌的诊断技术及治疗方法不断改善,但是早期浸润和远处转移的特点导致食管癌患者的总体生存率仍不理想。
食管癌发病机理涉及多种因素,阐明食管癌发生、进展的机理能够为治疗提供临床依据。CDKs与特定的细胞周期蛋白形成活性复合物,从而控制参与细胞周期的下游基因的表达[14]。CDK1又称CDC2,是参与上述过程的其中一个关键分子。CDKL1是CDK1相关的丝氨酸-苏氨酸蛋白激酶家族的成员[15],以对应于CDK1(CDC2)的PSTAIRE基序的氨基酸序列命名[16-17]。
CDKL1基因在多种癌症中的表达水平升高,如胃癌[8]、乳腺癌[9]、结直肠癌[10]、黑色素瘤[6]等,与肿瘤细胞的增殖、侵袭及迁移能力密切相关[18]。Sun等[8]通过免疫组化发现相较于胃癌癌旁组织,CDKL1在胃癌癌组织的阳性率较高,MTT实验、克隆形成实验表明CDKL1可以加强胃癌细胞的增殖能力,CDKL1表达下调后肿瘤细胞凋亡增加。Qin等[10]通过免疫组化发现,CDKL1蛋白在结直肠癌癌组织中的表达水平高于癌旁组织,CCK-8实验、平板克隆实验、transwell实验以及小鼠成瘤实验表明CDKL1能够提升结直肠癌细胞的增殖及侵袭能力,但是凋亡实验表明CDKL1表达水平的高低不影响肿瘤细胞的凋亡过程。
在本研究中,CDKL1基因在食管癌癌组织及细胞系中高表达,与肿瘤分期和淋巴结转移密切相关。这表明CDKL1基因在食管癌患者中是一种促癌基因。CCK-8增殖实验和克隆形成能力实验证明,CDKL1基因的表达会促进食管癌细胞的增殖。transwell实验证明CDKL1基因表达可提高食管癌细胞的侵袭能力。CDKL1在食管癌中是促癌基因,可能与食管癌患者的不良预后有关,可作为评估食管癌患者不良预后的指标。
综上所述,CDKL1基因能够促进食管癌的进展,在食管癌的发生及进展过程中发挥了重要的作用,可能作为治疗食管癌患者的一种潜在的分子靶点,为研究食管癌的转移机制以及进一步指导临床治疗奠定了一定的基础。

