高迁移率族蛋白B1沉默对人端粒酶逆转录酶抑制作用及其与肺癌放疗敏感性关系研究
徐 莹, 吕东阳, 任 雪, 阎 英, 李 玲
北部战区总医院1.放射治疗科;2.妇产科,辽宁 沈阳 110016
肺癌是最常见的恶性肿瘤之一[1],放疗是肺癌的主要治疗手段[2]。然而,仍有部分患者放疗疗效不理想,出现肿瘤放射线抵抗。因此,对肺癌放射抵抗机制的研究成为了放疗领域的研究热点。人端粒酶逆转录酶(humantelomerasereversetranscriptase,hTERT)存在于90%的恶性肿瘤中,端粒是真核细胞染色体末端发现的一种特殊的DNA-蛋白质复合体,端粒稳态与放射敏感性密切相关,增加放射敏感性有助于控制肿瘤的生长速度[3]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是在哺乳动物中广泛存在的一种丰富的染色质相关蛋白,参与肿瘤的发生、增殖、侵袭和转移,其高水平表达与临床预后不良相关[4]。有研究表明,HMGB1对hTERT活性没有影响,改变HMGB1的表达不会导致染色质结构的任何明显变化[5]。另有研究表明,HMGB1基因在小鼠胚胎成纤维细胞中的沉默导致hTERT活性下降及端粒功能障碍,而HMGB1过表达则增强了hTERT活性[6]。目前,HMGB1基因沉默是否下调hTERT表达,以及是否提高肿瘤的放疗敏感性尚未清楚。本研究旨在探讨HMGB1沉默对hTERT的抑制作用,以及其与肺癌放疗敏感性的关系。现报道如下。
1 材料与方法
1.1 细胞培养 将肺癌细胞系(H-1299)和正常肺泡上皮细胞(BEAS-2B)在含10%胎牛血清的RPMI 1640培养基中培养。根据处理方式不同将细胞分为对照组(无X射线照射,转染空白质粒),HMGB1 KO组(转染HMGB1-shRNA,敲除HMGB1),KO+5 Gy组(转染HMGB1-shRNA,敲除HMGB1,照射剂量5 Gy),KO+10 Gy组(转染HMGB1-shRNA,敲除HMGB1,照射剂量10 Gy)。
1.2 构建稳定转染的细胞系 选择针对HMGB1的人shRNA 5‘-GCTCAAGGAGAAT TTGTAA-3’,该序列与3’端结合作用最强,然后以与人类基因同源性有限且打乱的人shRNA序列5‘-GCTGGAGCAGTCCGATC-3’作为阴性对照。合成shRNAs,将其亚克隆至pGPU6/GFP/Neo shRNA载体,构建成重组质粒pGPU6/GFP/Neo-shRNA载体。将得到的载体命名为pGPU6/GFP/Neo-HMGB1和pGPU6/GFP/Neo-shNC。用600 g/ml G418筛选HMGB1低表达细胞和阴性对照细胞。稳定转染的细胞系分别命名为H-1299-shHMGB1和H-1299-NC。
1.3 细胞转染 用脂质体2000对人HMGB1 shRNA和阴性对照shRNA进行细胞转染,操作过程按说明书进行。将病毒浓缩液与食管癌细胞共培养,光学显微镜下观察细胞荧光,证实转染成功。序列如下:HMGB1-shRNA正义,5‘-GGGAGGAGCAUAA GAAGAATT-3’和反义,5‘-UUCUUCUUAUGCUCCUCCUCTT-3’,NC shRNA正义,5‘-UUCUCCGAACGUGUCACGUTT-3’和反义5‘-ACGUGACACGUUCGGAGAATT-3’。
1.4 细胞系培养与X射线照射 肺癌细胞系(H-1299)和H-1299-shHMGB1细胞系在RPMI-1640培养基中加10%胎牛血清和1%青霉素/链霉素培养。细胞保存在CO2孵箱中(37℃,CO2浓度5%)。用6 MV西门子直线加速器照射肿瘤细胞,源皮距离100 cm,剂量220 Gy/min。
1.5 HMGB1 mRNA表达检测 从稳定转染的细胞中提取总RNA,用反转录试剂盒在42℃下反应10 min,然后在95℃下反应2 min。根据Takara 聚合酶链反应(polymerase chain reaction,PCR)试剂盒说明进行重复PCR反应操作。样品在95℃预孵育30 s,然后95℃预孵育5 s,60℃预孵育15 s,72℃预孵育30 s。HMGB1:5‘-ATATGGCAAAA GCGGACAAG-3’和5‘-GCAACATCACCAATGGACAG-3’。β-肌动蛋白:5‘-TGGCACCCAGCACAATGAA-3’和5‘-CTAAGTCATAGTCCGCCTAGAAG CA-3’。所有的操作均至少重复3次。热扩增在Mx3000P qPCR系统上进行,结果用MxP3000P分析程序进行分析。
1.6 蛋白免疫印迹法 每500 μl冷的裂解液中加入2 μl蛋白酶抑制剂,混匀后置于冰上备用。将组织剪碎匀浆后,用BCA蛋白测定试剂盒测蛋白浓度。进行转膜,将膜移至含有封闭液的平皿中,室温摇床上摇动封闭1.5 h。将一抗用PBST稀释至适当浓度,4℃孵育过夜后,用PBST在室温摇床上洗3次,每次10 min。添加二抗室温下孵育1.5 h后,用PBST在室温摇床上洗3次,每次10 min。进行化学发光反应。
1.7 噻唑蓝实验 将细胞接种于96孔板内,置于细胞培养箱内培养过夜,分别于0、24、48、72、96、120 h更换含5 μg/μl 噻唑蓝(MTT)溶液的培养液,加入DMSO震荡、溶解后,测定吸光度值。
1.8 划痕损伤实验 将进入对数生长期的细胞悬液放入六孔板中,用200 μl无菌枪头在每个孔中长满的单层细胞上划1~2道痕,在显微镜下观察划痕修复的过程,分别于0、24、36 h拍照记录,比较不同细胞损伤修复速度。
1.9 脂质体转染 以lipofectamineTM2000转染siRNA于24孔细胞培养板,室温孵育5 min。再用50 μl上述培养液稀释脂质体(LipofectamineTM2000),孵育完毕后将脂质体-siRNA混合液加入24孔板内。培养6 h后,将24孔板里含有脂质体-siRNA混合液的培养基吸弃,48 h观察细胞功能。
1.10 Transwell实验 将基质胶与无血清培养液按1∶5比例稀释,吸取200 μl稀释后的基质胶溶液均匀铺在小室上室面,于细胞培养箱内孵育30 min。基质胶凝固后,向24孔板孔内加入500 μl含10% FBS的培养液,FBS作为趋化因子诱导细胞穿膜。将细胞制成单细胞悬液接种至小室内,将小室浸入4%的多聚甲醛溶液中固定10 min,结晶紫溶液染色5 min,显微镜下观察并拍照。
1.11 平板克隆实验 将细胞制成单细胞悬液,于细胞培养箱内37℃培养10 d,PBS清洗,4%多聚甲醛溶液固定,结晶紫染色,PBS清洗,拍照后计数克隆数量。

2 结果
2.1 放疗对HMGB1表达影响 与正常肺泡上皮细胞BEAS-2B比较,HMGB1在肺癌细胞H-1299中表达显著上调(P<0.05,图1a)。10 Gy放疗48、96 h后,HMGB1均较对照组显著降低(P<0.05,图1b)。

图1 放疗对HMGB1表达影响(a.HMGB1蛋白在正常肺泡上皮细胞BEAS-2B和肺癌细胞H-1299中的表达;b.放疗对HMGB1蛋白表达的影响)
2.2 HMGB1沉默对H-1299细胞增殖的影响 MTT与细胞克隆形成实验结果显示,HMGB1沉默后,随着放疗剂量增加,H-1299细胞活力显著降低(P<0.05,图2)。
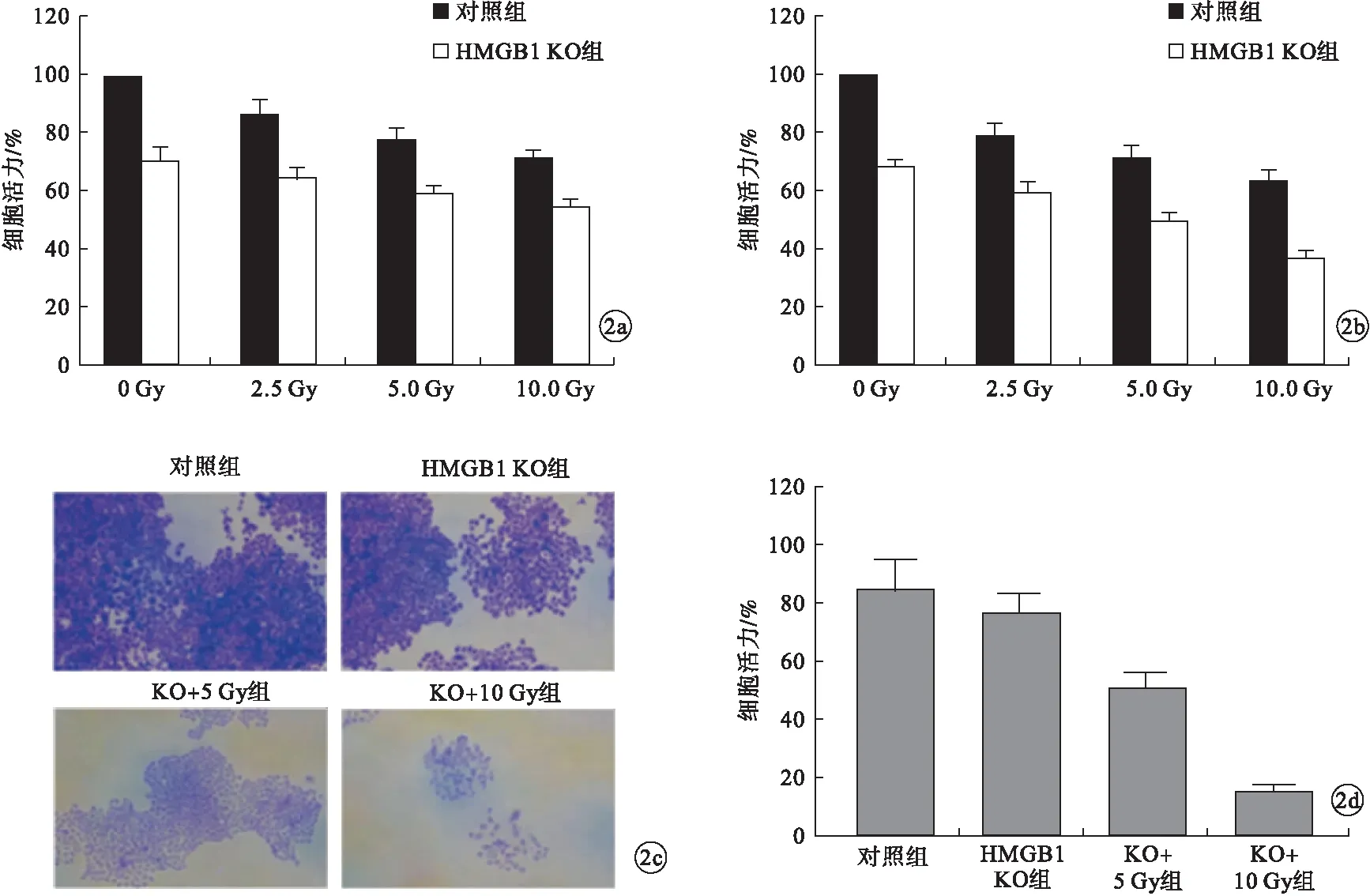
图2 HMGB1沉默对H-1299细胞增殖的影响(a.48 h MTT结果;b.96 h MTT结果;c~d.细胞克隆形成实验结果)
2.3 HMGB1沉默对H-1299细胞迁移及侵袭的影响 划痕实验结果显示,HMGB1沉默后,放疗剂量越大,H-1299细胞迁移所受影响越明显(P<0.05,图3a)。Transwell实验结果显示,HMGB1沉默后,随着放疗剂量增加,H-1299细胞侵袭能力显著降低(P<0.05,图3b)。

图3 HMGB1沉默对H-1299细胞迁移及侵袭的影响(a.划痕实验结果;b.Transwell实验结果)
2.4 HMGB1沉默对H-1299细胞细胞周期的影响 HMGB1沉默后H-1299细胞G1期减少,G2期增加;给予放疗后,细胞周期明显阻滞,G1期减少及G2期增加程度更明显。见图4。

图4 HMGB1沉默对H-1299细胞细胞周期的影响
2.5 HMGB1沉默对H-1299细胞凋亡的影响 HMGB1沉默后,随着放疗剂量增加,H-1299细胞凋亡率明显增加(P<0.05,图5)。

图5 HMGB1沉默对H-1299细胞细胞周期凋亡的影响
2.6 HMGB1沉默对hTERT相关信号通路的影响 HMGB1沉默导致hTERT、RFPL3、CBP、TRF1和TRF2蛋白表达均有不同程度的降低,而给予放疗后,这些蛋白的表达均显著降低(P<0.05,图6)。

图6 HMGB1沉默对hTERT相关信号通路的影响
3 讨论
HMGB1过表达与乳腺癌、直肠癌、膀胱癌、鼻咽癌和食管癌密切相关[7-9]。HMGB1在炎症、血管生成、自噬、增殖、凋亡、侵袭和转移等方面发挥着重要作用[10-11]。本研究发现,HMGB1在体外照射后,明显抑制肺癌细胞增殖,提示HMGB1在肺癌生长中起重要作用。DNA损伤需要HMGB1-hTERT的积累,且hTERT受HMGB1释放刺激调控[12]。HMGB1通过不同的信号通路促进肿瘤生长,HMGB1/RAGE的激活与基质金属蛋白酶的表达、肿瘤的增殖和迁移有关[13]。此外,有研究发现,shRNA沉默HMGB1的表达可降低食管癌细胞在照射后的迁移和侵袭能力[14]。
本研究发现,HMGB1通过改变端粒结合蛋白如TPP1(PTOP)、TRF1和TRF2的水平下调端粒稳态,调节肺癌细胞的增殖、侵袭和转移。有研究表明,HMGB1表达降低与端粒损伤和乳腺癌细胞放射敏感性增加有关,提示HMGB1在调节端粒和细胞对DNA损伤的反应中起着关键作用[15]。另有研究表明,HMGB1表达增加通过启动MCF-7细胞的G1期阻滞和凋亡抑制细胞生长,提示HMGB1在乳腺癌细胞中具有肿瘤抑制和放射增敏的作用[16]。本研究发现,HMGB1下调增强了细胞的放射敏感性,降低了端粒长度和hTERT活性,降低的hTERT活性与较高的放射敏感性相关,并可能导致端粒长度的减少。而有研究表明,HMGB1基因沉默后TERT mRNA和蛋白质表达无明显变化[17]。这些结果之间的差异可能是由于所研究的细胞系不同所致。
细胞周期蛋白D1的主要作用是调节细胞周期从G1期向S期的转变,hTERT和细胞周期蛋白D1的积聚可降低肿瘤细胞的放射敏感性,且细胞周期蛋白D1的表达水平与肿瘤细胞的放射抗性呈正相关[18]。本研究发现,HMGB1基因沉默导致细胞周期蛋白D1表达显著降低,辐射敏感性的增强可能是通过调节细胞周期蛋白D1的表达来实现的。此外,由于细胞周期蛋白D1的减少可以抑制G1/S转变,这解释了H-1299-shHMGB1细胞的增殖受到显著抑制的原因,因为M期是细胞周期中对辐射最敏感的阶段,这也可能提高了这些细胞的辐射敏感性。
综上所述,HMGB1下调破坏人肺癌细胞的端粒稳态,下调hTERT蛋白表达,增强放射敏感性,HMGB1和hTERT可能是肺癌放射治疗疗效预测的潜在靶点。

