Epsilon-变形菌趋化信号通路中偶联蛋白CheV 与趋化受体蛋白的CZB 结构域的功能研究
刘煜耿 , 毛颖津 , 章灿川 , 高贝乐
1. 中国科学院热带海洋生物资源与生态重点实验室, 广东省海洋药物重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301;
2. 中国科学院大学, 北京 100049
Epsilon-变形菌广泛分布于自然界中, 包括深海热液喷口富集的Caminibacter、Nautilia、Nitratifractor、Sulfurimonas 和Hydrogenimonas 等属, 水环境或沉积物中分离的 Sulfurospirillum、Sulfuricurvum、Thiovulum 等属和部分Arcobacter 属, 以及人和动物的胃肠道致病菌Campylobacter 和Helicobacter 属 (Campbell et al, 2006)。Epsilon-变形菌是深海热液口生态系统中的优势菌群, 可以占据高达85%的微生物量, 是深海热液口生态系统中重要的初级生产者 (Waite et al, 2017; McNichol et al, 2018)。由于环境分离获得纯培养的Epsilon-变形菌特别是深海极端环境富集的Epsilon-变形菌的数量较少, 目前关于这类菌的研究报道主要集中在两大病原菌——空肠弯曲菌(Campylobacter jejuni) 和幽门螺杆菌(Helicobacter pylori)(Campbell et al, 2006)。因此, 空肠弯曲菌和幽门螺杆菌成为研究Epsilon-变形菌的模式菌。
趋化作用是细菌重要的环境适应机制。细菌通过趋化信号系统感知周围物质浓度变化, 并将胞外的化学刺激转变成鞭毛马达转动方向改变的信号, 促使细菌改变运动轨迹趋利避害(Lertsethtakarn et al, 2011)。经典的模式菌株大肠杆菌(Escherichia coli)的趋化信号转导组分包括5 个趋化受体蛋白MCP (Methyl-accepting Chemotaxis Proteins)、一个偶联蛋白CheW、一个激酶CheA、一个应答蛋白CheY、一个磷酸酶CheZ 和一个由甲基酯酶CheB 和甲基转移酶CheR 两个蛋白组成的趋化适应系统(Chemotaxis adaptation system)(图1a)(张云怡 等, 2011)。E. coli的趋化受体蛋白可以与CheW、CheA 互作在细胞极点形成一个稳定且高效合作的跨膜趋化受体蛋白复合体(Parkinson et al, 2015; Piñas et al, 2016)。细菌通过这种趋化受体复合体感知外界信号并通过蛋白磷酸化反应进行信号传递, 最终磷酸化的CheY 作用于鞭毛并使细菌改变运动方向(Delalez et al, 2010; Porter et al, 2011)。但是, 相较于经典的E. coli 趋化信号系统, 其他细菌的趋化系统呈现复杂性和多样性(Wadhams et al, 2004; Stocker et al, 2012)。比如, Bacillus subtilis 多出一个偶联蛋白CheV 和另一套由磷酸酶CheC 和脱酰胺酶CheD 组成的适应系统(Rao et al, 2008; Alexander et al, 2010); Helicobacter pylori 虽没有经典的CheB 和CheR 适应系统, 却含有3 个CheV (Pittman et al, 2001); C. jejuni 除了具有E. coli 的趋化组分, 还多出一个CheV 和另一种磷酸酶CheX (图1b)(Zautner et al, 2012)。虽然不同细菌的CheV 数量存在差异, 但CheV 是一种保守的双结构域融合蛋白, N 端是CheW 结构域, C 端是REC 结构域。

图 1 大肠杆菌(Escherichia coli, a)和空肠弯曲菌(Campylobacter jejuni, b)的趋化系统示意图 图中字母表示不同的趋化蛋白; FliM 表示鞭毛马达蛋白; Pi 表示磷酸基团 Fig. 1 Schematic diagram of chemotaxis system. The letters represent different chemotaxis proteins; FliM is flagellum motor protein; Pi stands for phosphate group
趋化基因在基因组上趋向于成簇出现, 基因簇内部具有规律的基因排布顺序, 根据基因分布规律将趋化组分划分为不同的类别, 即F 系统, 包括F1~ F17 (Wuichet et al, 2010)。例如, F3 类型趋化系统的基因顺序为cheV-cheA-cheW, 该系统的CheA 因有一个额外的REC 结构域而被称为CheAY, 该类型趋化系统目前仅在Epsilon-变形菌中发现。不同细菌存在不同数量的CheV, 生物信息学研究表明在肠道菌株中CheV 的数量跟趋化受体蛋白的数量存在正相关性(Ortega et al, 2016)。C. jejuni 有且仅有一个F3 类型的CheV (后面用F3-CheV 表示F3 类型的CheV); H. pylori 有3 个拷贝的F3-CheV, 有2 个F3- CheV 不是在cheV-cheA-cheW 基因组结构中。已有研究也表明H. pylori 的3 个CheV 功能具有差异性, CheV1 突变对趋化有很大的影响, 而 CheV2 和CheV3 突变对趋化仅是轻微的影响(Pittman et al, 2001; Alexander et al, 2010)。此外, 不同F 类型CheV的功能存在差异。Salmonella typhimurium 的F7 类型CheV 缺失对趋化的表型影响很小(Alexander et al, 2010)。B. subtilis 的F1 类型CheV 具有跟CheW 类似的偶联功能(Rosario et al, 1994), 其CheV 被磷酸化后能抑制CheA 的激酶活性(Karatan et al, 2001)。因此CheV 是一个分布广泛且发挥重要功能的趋化蛋白, 但是其具体的作用机制还不清楚, 比如CheV跟趋化受体蛋白是否有选择性互作从而参与特定趋化受体复合体的形成?是否所有的 CheV 都能被CheA 磷酸化且磷酸化后的CheV 又有什么样的功能变化?本文将探讨F3-CheV 跟趋化受体蛋白是否有选择性互作。
典型的趋化受体蛋白由多种结构域组成, 包括化学感受器LBD (Ligand Binding domain)、HAMP (Histidine kinases, Adenylyl Cyclases, Methyl- accepting chemotaxis proteins, Phosphatases)和MA (Methyl-Accepting domain)等结构域。而H. pylori的趋化受体TlpD (Transducer-like proteins D)除包含有保守的MA 结构域外, C-末端还存在一个能结合Zn 离子的 CZB 结构域(C- terminal Zinc-Binding domain), 研究表明该结构域有助于H. pylori 应对氧化压力(Collins et al, 2016)。目前发现很多具有CZB结构域的趋化受体都是胞内蛋白, 且部分趋化受体没有经典的LBD 结构域, 因此推测其可能是一个新型的信号感知结构域, 或者CZB 结构域可以通过结合解离 Zn 离子的方式对趋化信号传递进行调节(Collins et al, 2016)。我们通过生物信息学分析发现深海热液口的Epsilon-变形菌均有CZB 结构域的存在, 但有些趋化受体蛋白的CZB 结构域的重要氨基酸位点 H-C-H-H 发生突变, 我们将其命名为CZB-like 结构域。本文对CZB-like 结构域的Zn 离子结合能力和功能进行了初步研究。
1 材料与方法
1.1 试验材料
菌株的基因组信息下载于GeneBank, 空肠弯曲杆菌C. jejuni 81-176、蛋白表达菌株E. coli BL21、细菌双杂交菌株E. coli BTH101 以及质粒均源于实验室保藏。深海热液口虽具有丰富的微生物量, 但大部分是厌氧菌且难以培养(王风平 等, 2013)。我们选取为数不多已经完全测序的深海Epsilon-变形菌菌株进行分析, 并通过文献调研分析这些物种的呼吸类型和是否是纯化培养。菌株信息见表1, 质粒信息见表2, C. jejuni 81-176 相关基因见表3。
1.2 试验方法
1.2.1 生物信息学分析方法
以C. jejuni 81-176 的CheV 和Tlp1 的MA 结构域的氨基酸序列为模板进行BlastP 同源蛋白分析 (Altschul et al, 1997; Schäffer et al, 2001); 用SMART (http://smart.embl-heidelberg.de/)和HHpred (https:// toolkit.tuebingen.mpg.de/tools/hhpred)生物信息数据库预测蛋白的二级结构(Letunic et al, 2018; Zimmermann et al, 2018); 用 MIST 网站(https:// mistdb.com/genomes) 分析趋化组分的 F 类型(Gumerov et al, 2020); 用ClustalX 2.1 进行多序列比对并生成序列对齐图案(Crooks et al, 2004; Larkin et al, 2007); 用UBCG 程序包获取Epsilon-变形菌保守蛋白的比对串联序列(Na et al, 2018)。所有分析均采用默认参数。
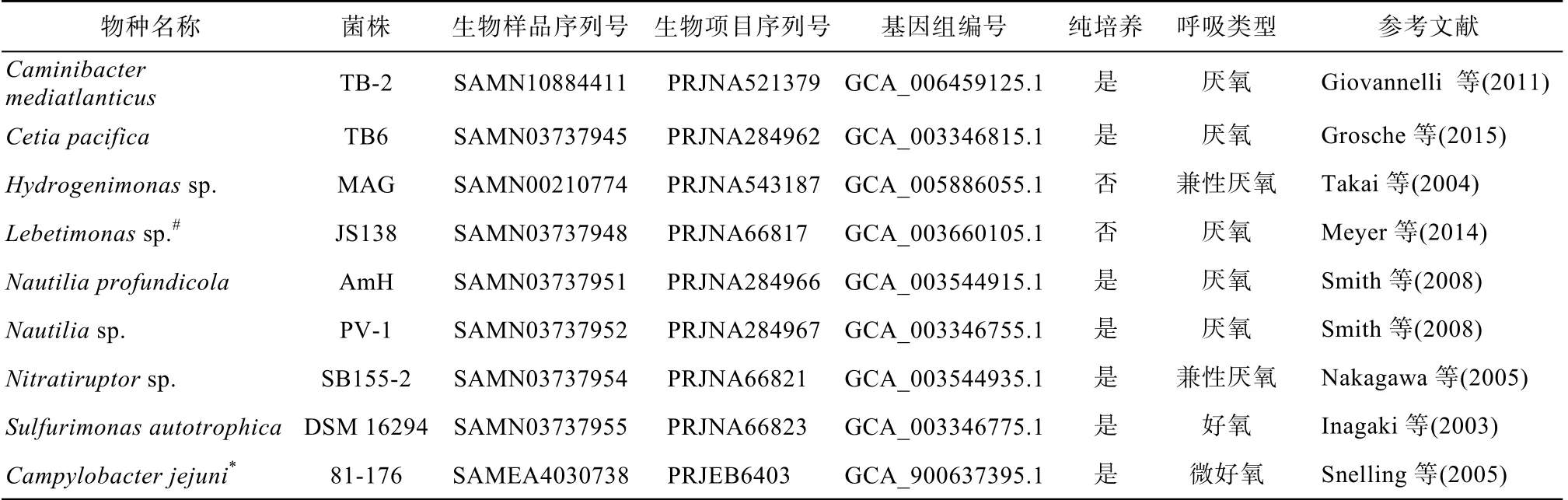
表1 菌株信息 Tab. 1 Strain information

表2 质粒相关信息 Tab. 2 Plasmid information
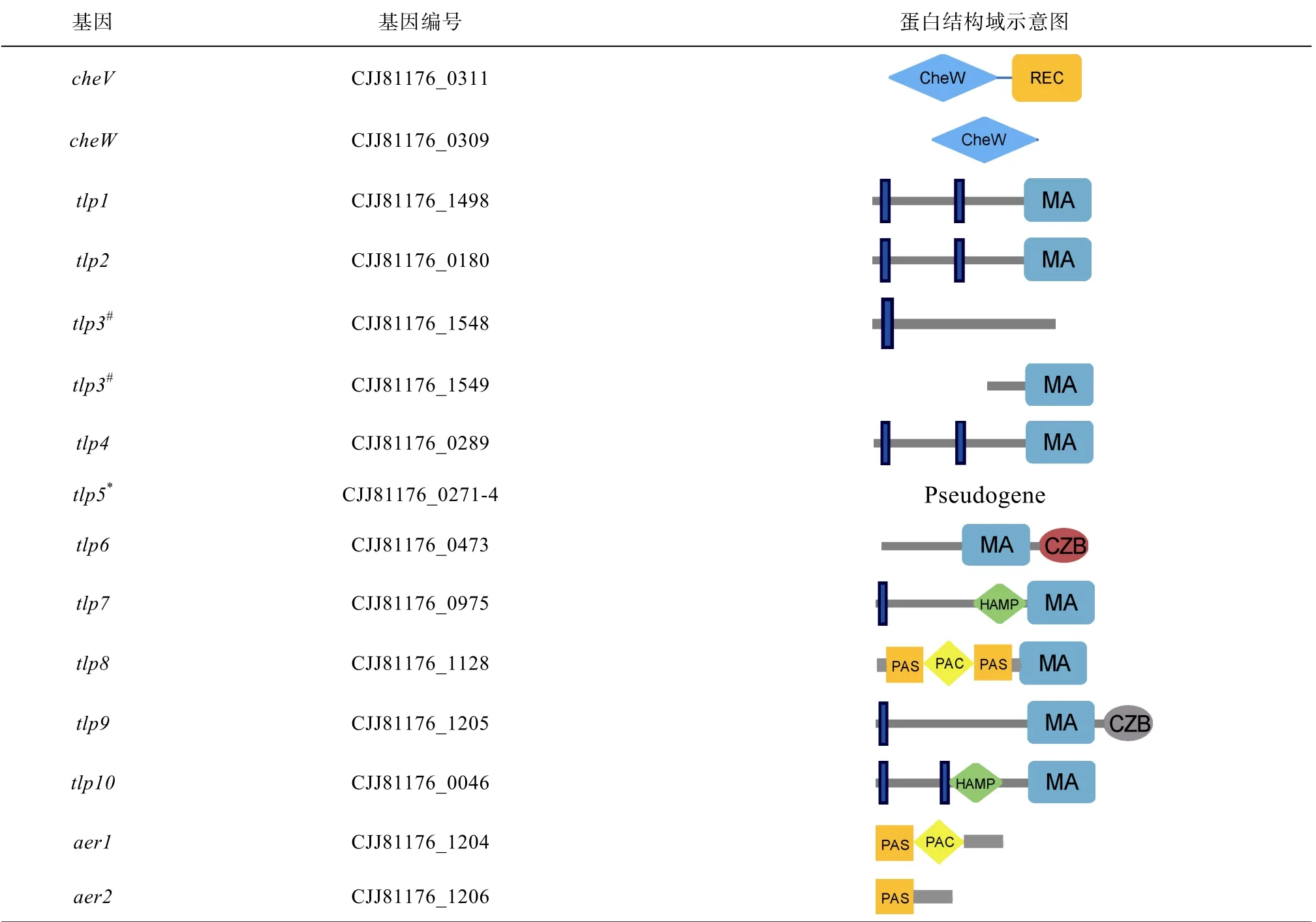
表3 Campylobacter jejuni 81-176 相关基因信息 Tab. 3 Campylobacter jejuni 81-176 related genetic information
CheV 进化距离的分析。将Epsilon-变形菌菌株的所有 F3-CheV 和 Sulfurimonas autotrophica 的F8-CheV 进行多序列比对; 用Epsilon-变形菌的保守蛋白串联序列代表菌株物种进化; 用MEGA7.0的泊松分布模型分别计算CheV 间和物种间的进化距离(Kumar et al, 2016)。
CZB 结构域的分析。因为CZB 结构域结构已解析, 存在于DgcZ 蛋白中[蛋白质结构数据库(PDB)编号: 3T9O], 因此通过BlastP、SMART 和HHpred数据库分析趋化受体蛋白是否存在类似DgcZ-CZB的结构域。根据CZB 结构域的保守氨基酸位点[H] x..x [C] xxx [G] x [W] x..x [H] xxx [H] (H-C-H-H 是结合Zn 离子的重要氨基酸)用多序列比对方法加以鉴定(Zahringer et al, 2013)。
1.2.2 生化试验方法
质粒构建: 采用天根公司的试剂盒提取质粒和C. jejuni 81-176 的基因组, 并设计引物(表4)进行PCR 扩增目的片段, 然后进行Gibson 连接(Gibson et al, 2009)。
细菌双杂交方法: 克隆跨膜趋化受体(Tlp1、Tlp4、Tlp7、Tlp9、Tlp10)的胞内MA 结构域及其C 末端的核酸序列和胞质趋化受体(Tlp6、Tlp8 和Aer1、Aer2)的全长核酸序列至pUT18C 或者pCH363 质粒中, 克隆cheA 或cheW 至pKNT25 质粒中, 然后共转化至双杂交细菌E. coli BTH101 中(图2a、2b)。因Tlp2、Tlp3、Tlp4 的MA 结构域的氨基酸序列100%相似, 因此只用了Tlp4 进行试验; 因为tlp5 基因发生了点突变不能正常翻译, 因此没有用Tlp5 进行试验。将构建好的质粒转化至E. coli BTH101 中, 在 含 有 氨 苄 青 霉 素(1 0 0 μ g·m L–1)+卡 那 霉 素(50μg·mL–1)+IPTG (0.5mmol·L–1)+X-gal (40μg·mL–1) 的固体LB 培养基中30℃培养观察48h, 若菌斑变蓝则证明有相互作用, 如果菌落显白色则表明无相互作用, 通过菌斑的蓝色深浅粗略判断蛋白互作的强弱(Battesti et al, 2012)。

表4 引物序列 Tab.4 Primer sequence
蛋白表达纯化及 Zn 离子的测定: 分别构建Tlp6 全长蛋白、Tlp9 胞内全长蛋白及其不含CZB- like 结构域的胞内蛋白表达载体, 转化至 E. coli BL21 中。蛋白纯化过程中, 先用含60mmol·L–1咪唑的蛋白缓冲液进行洗杂, 最后用不含 NaCl 的300mmol·L–1咪唑蛋白缓冲液洗脱目的蛋白。加入浓硝酸消解蛋白溶液, 后用双氧水(ddH2O)稀释浓硝酸至 1%以下, 使用电感耦合等离子体质谱(ICP- Mass)测定Zn 离子含量。
2 结果与分析
2.1 深海Epsilon-变形菌的F 趋化类型及CheV 蛋白的分析
我们使用MIST 数据库调查深海Epsilon-变形菌的F 趋化系统类型, 发现在所分析的Epsilon-变形菌菌株中, 除Nitratiruptor sp. SB155-2 外, 都具有 F3 类型趋化系统, 而且大部分深海Epsilon-变形菌与C. jejuni 类似, 都是有且仅有一个F3 类型趋化系统(表5)。
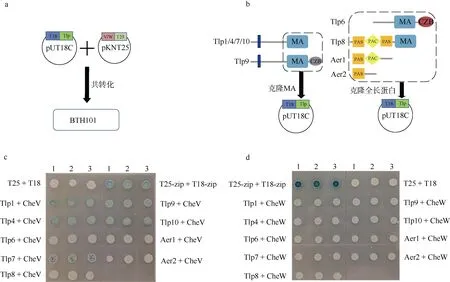
图2 细菌双杂交研究Campylobacter jejuni 81-176 的CheV 与趋化受体蛋白的相互作用 a. 细菌双杂交操作示意图; b. 基因克隆示意图, 左图表示跨膜的Tlp 只截取胞内的MA 结构域及MA 结构域后的序列进克隆, 右图表示胞内趋化受体选取蛋白的全长序列进行克隆; c. CheV 与趋化受体蛋白的细菌双杂交结果; d. CheW 与趋化受体蛋白的细菌双杂交结果。图c 和图d 中颜色深浅代表蛋白相互作用的强弱程度。BTH101 为细菌双杂交系统菌株 Fig. 2 Using bacterial two-hybrid system to study the interaction between CheV and chemotactic receptors in Campylobacter jejuni 81-176. (a) Schematic diagram of bacterial two-hybrid experiment; (b) Schematic diagram of gene cloning. The left panel shows that for transmembrane Tlps, only MA domains and sequences after the MA domain were cloned into vectors. The right panel shows the full-length sequence of the cytolasmic chemotactic receptor was selected for cloning; (c) Interaction of CheV with Tlps by bacterial two-hybrid experiments; (d) Interaction of CheW with Tlps by bacterial two-hybrid experiments. The shade of color in Figure C and D represents the strength of protein interaction. BTH101 is a strain for bacterial double hybrid system
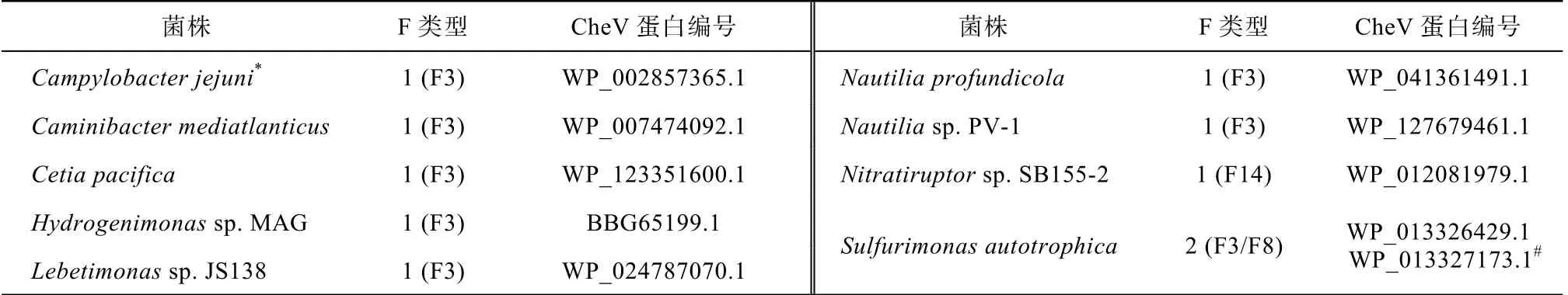
表5 深海Epsilon-变形菌的F 类型和CheV 的分析统计 Tab. 5 Analysis and statistics of F-Class and CheV in deep sea Epsilon-proteobacteria
已知不同细菌的CheV 的数量和功能存在差异。C.jejuni 和大部分深海Epsilon-变形菌只有一个CheV 且都属于F3 类型(表5), 因此C.jejuni 的F3-CheV 很有可能是由深海 Epsilon-变形菌的F3-CheV 垂直遗传的, 而非基因水平转移的结果。为了验证这个猜想, 我们将深海Epsilon-变形菌和C.jejuni 的F3-CheV 以及作为对照的Sulfurimonas autotrophica 的F8-CheV (表5, 8 个F3-CheV, 1 个F8-CheV)进行两两比较, 计算不同菌株的CheV 之间的进化距离; 用UBCG 程序包产生各Epsilon-变形菌的保守蛋白串联序列并以此计算物种间的进化 距离。图3 显示这些菌株两两之间的F3-CheV 进化距离跟物种进化距离一致(斜率接近 1), 而Sulfurimonas autotrophica 的 F8-CheV 与 其 他Epsilon-变形菌的 F3-CheV 间的距离远远大于Sulfurimonas autotrophica 与这些Epsilon-变形菌间的物种距离, 但是同是源自Sulfurimonas autotrophica的F3-CheV 却与物种有相近的进化距离。这表明F3-CheV 可以稳定地在这些菌株中进行基因垂直传递, 而非F3 类型的CheV 如F8-CheV 应该来自水平基因转移(图3)。因此深海Epsilon-变形菌与C. jejuni的F3-CheV 功能应该是同样的。

图 3 深海 Epsilon-变形菌和 Campylobacter jejuni 的CheV 分子间进化距离分析 蓝色表示深海 Epsilon-变形菌的两两比较; 橙色表示深海Epsilon-变形菌与C. jejuni 81-176 的两两比较; 圆圈表示不同菌株的F3-CheV 间的距离; 三角形表示Sulfurimonas autotrophica的F8-CheV 与其他Epsilon-变形菌菌株的F3-CheV 之间的距离 Fig. 3 Pairwise Distances matrix to calculate the evolutionary distance for CheV homologs between deep-sea Epsilon-proteobacteria and Campylobacter jejuni. Blue indicates the evolutionary distance between deep-sea Epsilon- proteobacteria. Orange indicates the evolutionary distance between deep-sea Epsilon-proteobacteria and C. jejuni 81-176. Dot shows the distance between F3-CheV in different Epsilon-proteobacteria, and triangle shows the distance between F8-CheV in sulfurimonas autotrophica and F3-CheV in other Epsilon-proteobacteria
2.2 CheV 与趋化受体蛋白的相互作用
由于深海Epsilon-变形菌难以纯化培养和进行遗传操作试验(臧扬 等, 2017), 从前面CheV 的进化距离分析推测垂直传递的F3-CheV 功能上应该具有相似性, 因此我们选用Epsilon-变形菌的模式菌株C. jejuni 81-176 进行CheV 与趋化受体蛋白的互作研究, 进而推测深海Epsilon-变形菌F3-CheV 的功能。C. jejuni 81-176 具有MA 结构域的完整趋化受体Tlp 和没有MA 结构域但有PAS 结构域的趋化受体Aer (An energy taxis receptor)。我们采用细菌双杂交方法检测CheV 或CheW 是否与趋化受体蛋白之间发生互作, 将 cheV 和 cheW 基因克隆至载体pKNT25 中, 将tlp 或aer 基因克隆至pUT18C 中。已有研究发现趋化受体内只有 MA 结构域参与CheV 和CheW 的互作, 所以对于跨膜趋化受体, 我们只克隆了编码胞内含MA 结构域的C 末端核酸序列; 对于胞内趋化受体, 则克隆编码全长蛋白的核酸序列(图2a、2b)。
从结果可知CheV 与Tlp1、Tlp4、Tlp7、Tlp9、Tlp10 有强烈的互作, 而与Tlp6 和Tlp8 的互作性较弱, 与Aer1 和Aer2 没有互作(图2c)。Tlp1、Tlp4、Tlp7、Tlp9、Tlp 10 都是跨膜蛋白, CheV 与这类蛋白互作很强, 而跟胞内 Tlp6、Tlp8 的互作较弱; Aer1 和Aer2 由于没有MA 结构域, 无法跟CheV互作。CheW 似乎跟所有的Tlp 都有很弱的相互作用, 但是出乎意料的是Aer1 和Aer2 也与CheW 显示有微弱的互作(图2d)。我们猜测由于CheW 蛋白高度保守, 异源表达的CheW 可能会参与E. coli BTH101 自身的趋化受体复合体组装, 从而导致CheW 的细菌双杂交试验结果产生异常。此外, Aer1 和Aer2 的PAS 结构域可能结合到E. coli BTH101 自身趋化受体的HAMP 结构域上间接与CheW-T25 互作, 从而使CheW 与Aer1 和Aer2 产生假阳性结果。
2.3 CZB-like 结构域的Zn 结合能力及在蛋白互作中的作用
H. pylori 的TlpD 的CZB 结构域可以帮助其适应氧化压力。因此我们想了解深海Epsilon-变形菌的趋化受体蛋白是否也含有CZB 结构域来帮助其适应深海的极端环境。首先用 BlastP 分析以及SMART 和HHpred 数据库分析获得含CZB 结构域的趋化受体蛋白, 进一步通过序列比对分析发现Caminibacter mediatlanticus 和Cetia pacifica 两株深海菌株以及C. jejuni 81-176 存在含类似DgcZ-CZB结构域的趋化受体蛋白, 但是缺乏保守位点[H] x..x [C] xxx [G] x [W] x..x [H] xxx [H], 因此我们称这种结构域为CZB-like 结构域; 而其他具有保守氨基酸位点的结构域则确认为CZB 结构域(图4, 表6)。为了进一步确定CZB 结构域的分布, 我们通过BlastP 分析发现Epsilon-变形菌的很多菌株都存在含CZB 结构域的趋化受体蛋白, 但是比例没有深海热液口的Epsilon-变形菌高, 比如C. jejuni和H. pylori 都只有一个含CZB 结构域的趋化受体蛋白。这说明CZB 结构域可能在Epsilon-变形菌适应深海极端环境的过程中发挥重要功能。此外, 我们发现普通水生境的 Arcobacter marinus 和Arcobacter anaerophilus 以 及 致 病 菌Campylobacter hepaticus 也存在含CZB-like 结构域的趋化受体蛋白。
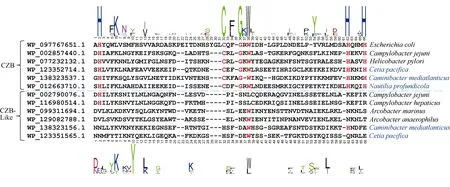
图4 CZB 结构域和CZB-like 结构域的序列比对分析 通过多序列比对寻找保守氨基酸并以此区分CZB 结构域和CZB-like 结构域。蓝色字体代表的是深海菌株, 标红的字母代表CZB 结构域的保守氨基酸位点 Fig. 4 Sequence alignment of CZB domain and CZB-like domain. Blue font indicates deep-sea strain, Red letter indicates conserved amino acids of CZB domain
CZB-like 结构域中对应的H-C-H-H 发生突变后, 是否还能结合Zn 离子, 是否在趋化过程中发挥其他功能?我们通过序列分析发现, C. jejuni 81-176 的Tlp6 的C-末端是一个经典的CZB 结构域, 而Tlp9的C-末端是一个CZB-like 结构域(表3)。为检测CZB-like 结构域的功能, 我们将Tlp6、Tlp9 和敲除CZB-like 结构域的Tlp9 (no CZB-like)克隆至pGEX-6P 质粒上并转化进 E. coli BL21 表达系统 中进行异源表达。通过蛋白纯化、消解及ICP-Mass分析, 我们发现Tlp6 检测到的Zn 离子质量分数在1.00×10-7左右, 而Tlp9 检测到的Zn 离子质量分数在0.25×10-7以下(图5a)。但将Zn 离子质量分数和蛋白质量分数进行计算结合比, 发现Tlp6 蛋白与Zn 的结合比值约为1.5, 证实了一个CZB 结构域大约能结合一个Zn 离子, 说明Tlp6 蛋白具有一个真正的 CZB 结构域(图 5b)。然而 Tlp9 的CZB-like 结构域并没有结合 Zn 离子, 这说明CZB-like 结构域虽然在二级结构上类似于DgcZ-CZB 结构域, 但由于关键氨基酸突变, 已经不能结合Zn 离子(图5b)。
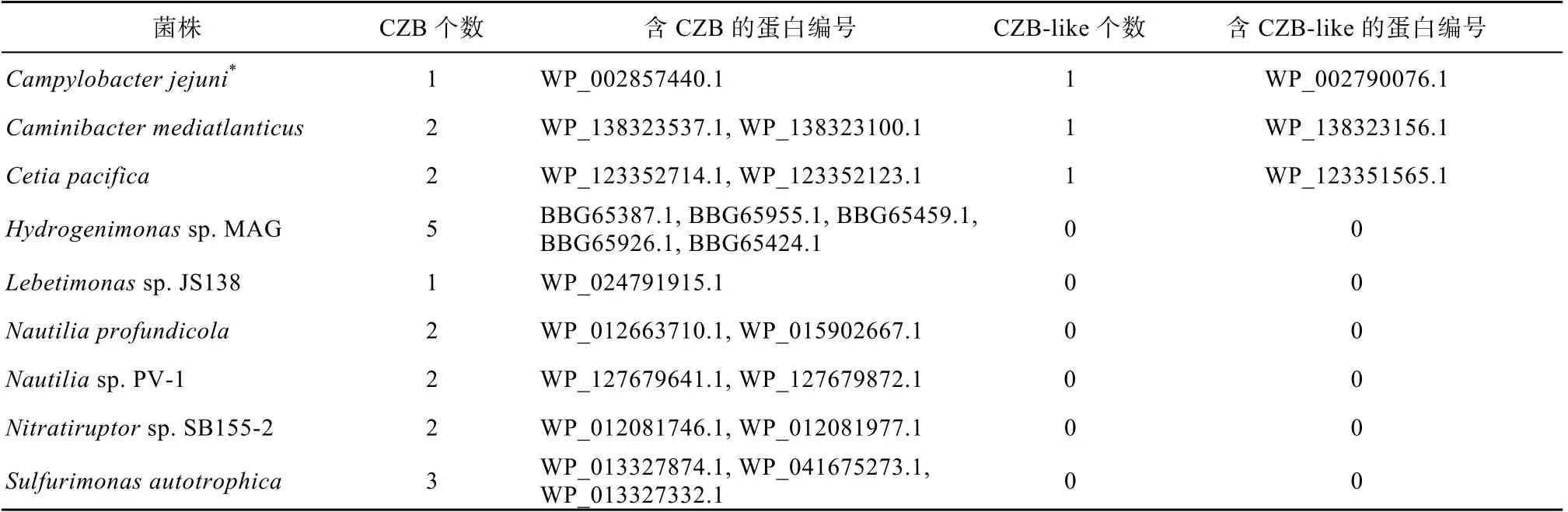
表6 深海Epsilon-变形菌CZB 结构域的分析统计 Tab. 6 Analysis and statistics of CZB domain in deep sea Epsilon-proteobacteria

图5 CZB-like 结构域的Zn 结合能力及潜在功能的研究 a. ICP-Mass 检测CZB-like 结构域的Zn 离子结合能力; b. 根据3 次质谱测定的平均离子浓度和平均蛋白浓度计算蛋白和Zn 离子的结合比例; c 和d. 细菌双杂交研究Tlp9 的CZB-like 结构域能否影响Tlp9 与CheV 和CheW 的相互作用。图c 和图d 中不同颜色分别代表蛋白相互作用的强弱程度 Fig. 5 Study on Zn-binding capacity and potential function of CZB-like domain. (a) Zn concentration measure by ICP-mass; (b) Using the average Zn concentration and average protein concentration, the binding ratio of protein and Zn is calculated; (c and d) To investigate whether the CZB-like domain of Tlp9 can affect the interaction with CheV or CheW by bacterial two-hybrid experiments. The shade of color in Figure C and D represents the strength of protein interaction
趋化受体蛋白跟CheW 或CheA 的互作界面主要是在趋化受体蛋白的MA 结构域, 而CZB-like 结构域就在MA 结构域的后边, 这种蛋白结构有可能介导蛋白互作。为进一步探究CZB-like 结构域的功能, 我们构建了CheV 或CheW 跟Tlp9 及其蛋白截短体的细菌双杂交系统菌株, 研究CZB-like 结构域对Tlp9 和CheV 或CheW 的互作影响。试验结果表明, 由于Tlp9 的CZB-like 结构域存在, Tlp9 跟CheV的互作能力明显很强, 而将Tlp9 的CZB-like 结构域截掉, Tlp9 则丧失与CheV 互作的功能(图5c)。而且, T18 标签如果加在Tlp9 的C 端(即Tlp9 的CZB-like结构域的C 端), 会严重影响Tlp9 与CheV 的互作(图5c)。CheW 与Tlp9 及其截除CZB-like 结构域的蛋白杂交结果并没有显示出差别(图5d), 从图2d 可以看出CheW 在E. coli BTH101 系统中存在问题, 从而影响CheW 与Tlp9 的互作结果, 因此无法下结论。但是从Tlp9 与CheV 的互作结果中可知CZB-like结构域能影响Tlp9 与CheV 的互作。
3 讨论与结论
我们研究发现大部分深海 Epsilon-变形菌的CheV 属于F3 类型, 但CheV 的数量在深海Epsilon-变形菌中是变化的, 大部分只有一个CheV, 少数菌株具有多个CheV, 如Sulfurimonas autotrophica 各有一个F3-CheV 和一个F8-CheV。计算深海Epsilon-变形菌和C. jejuni 两两之间的物种进化距离和CheV 分子进化距离发现F3-CheV 与物种间的进化距离相近。据此可以推测深海 Epsilon-变形菌与 C. jejuni 的F3-CheV 具有垂直传递关系和功能的相似性。
细菌双杂交的结果表明CheV 可以和所有的Tlp互作, 但存在亲和力的差别。CheV 和跨膜的Tlp1、Tlp4、Tlp7、Tlp9、Tlp10 互作亲和力更大, 和胞内Tlp6、Tlp8 亲和力较弱。虽然结果显示CheW 与所有的Tlp 都有弱相互作用, 但由于异源表达的CheW可能会参与E. coli BTH101 的趋化系统复合体组装, 从而导致CheW 与Tlp 的互作结果不可信。有研究表明PAS 结构域可以和HAMP 结构域互作(Elliott et al, 2009), 而Aer1 和Aer2 都有PAS 结构域, 因此可能是Aer1 和Aer2 结合到E. coli BTH101 自身趋化受体的HAMP 结构域上, 且CheW-T25 参与E. coli BTH101 趋化受体复合体的组装, 因此导致Aer1 或Aer2 与CheW 产生间接性互作, 从而使CheW 与Aer1、Aer2 产生假阳性结果。此外, 细菌双杂交系统的基因是超表达状态, 而超表达的蛋白容易产生非特异性互作, 这可能是导致CheW 与Aer1、Aer2产生假阳性的另一种原因。所以该蛋白互作系统不适用于研究CheW 蛋白的互作, 从而无法对CheW与趋化受体蛋白的互作下结论。
E. coli 的趋化受体复合体结构已经得到了解析, 是一个趋化阵列结构, 整个趋化阵列展现出一个非常完美的六元环结构, 两个三聚体形式的趋化受体蛋白与一个二聚体的CheA 和两个CheW 组成一个核心单元, 3 个核心单元又组装成一个晶格单元, 晶格单元彼此相连形成一个很大的趋化阵列(Liu et al, 2012; Cassidy et al, 2015)。由于E. coli 没有CheV, 目前还没有任何CheV 蛋白的结构解析。CheV 如何参与六元环的组装, CheV 的REC 结构域在趋化阵列中处于什么位置, REC 结构域能否被磷酸化以及被磷酸化后在趋化阵列的信号传递过程中发挥什么样的功能, 这些都是相当有意义但又极具挑战的问题。随着冷冻电镜的发展, 可以通过体外重构趋化阵列, 然后用电镜直接观察CheV 是否参与阵列组装, 以及如何影响趋化阵列的信号传递。而很多的Epsilon-变形菌具有单拷贝的CheV 和CheW, 是研究CheV 参与趋化阵列组装的理想对象。
此外, 我们发现所有的深海Epsilon-变形菌中都存在含CZB 结构域的趋化受体蛋白, 且数量要比致病菌 C. jejuni 和 H. pylori 多, 这可能跟深海Epsilon-变形菌适应极端环境相关。我们还发现了一种新的结构域CZB-like 结构域。通过ICP-Mass, 确定了Tlp6 的CZB 结构域能结合Zn 离子, 是一个真正的CZB 结构域; 而Tlp9 的CZB-like 结构域不能结合Zn 离子, 说明H-C-H-H 关键氨基酸的突变, 使CZB 结构域结合Zn 离子的能力丧失, 但是细菌双杂交试验结果表明C. jejuni 81-176 的CZB-like 结构域可以极大促进Tlp9 与CheV 的互作。关于CZB 结构域和CZB-like 结构域如何影响趋化受体的构象进而影响其与其他趋化蛋白的相互作用有待进一步研究。

