香豆素类荧光探针对硫化氢检测的研究进展
刘忠诚 杜美利 韩 翔 薛文海 王瀚姣
(西安科技大学 化学与化工学院,西安 710054)
前言
硫化氢(H2S)是人们发现的第三类生物内源性“气体信使分子”(其他两种分别为CO和NO)。内源性H2S主要是通过非酶催化和酶催化两种途径产生:非酶催化途径包括多硫化合物的代谢及存储硫的释放[1];酶催化途径则是在胱硫醚-β-合成酶(CBS)和胱硫醚-γ-裂解酶(CES)等吡哆醛-5-磷酸盐(PLP)类酶、3-巯基丙酮酸硫转移酶(MST)和半胱氨酸转氨酶(CAT)等多种酶的参与作用下,通过酶解L-半胱氨酸产生[2]。H2S对于呼吸系统、内分泌系统和神经系统的调节有着非常重要的意义,参与一系列生理调控活动,如调节血管舒张、炎症及胰岛素分泌等[3]。但是,细胞内H2S浓度平衡(生理浓度1~10 mmol)一旦破坏可能会导致亨廷顿式舞蹈症[4]、糖尿病[5]、阿尔兹海默症[6]、21-三体综合症[7]及帕金森症[8]等疾病的产生。因此,对H2S的检测尤其是对生物内源性H2S的定量检测有着重要意义,这也使得近年来对内源性H2S的检测与研究成为热点。
目前,常见的H2S检测方法有:分光光度法[9]、电化学法[10]、气相色谱法[11]以及极谱法[12]。这些方法操作简单,但是通常需要破坏样品,局限于细胞外H2S检测。近年来发展的有机小分子荧光探针由于其优良的细胞渗透性、高灵敏度以及原位检测等优点,为H2S和其他生物活性分子内源性检测提供了有效的方法,且涌现出一系列丰硕的成果[13-17]。其中以香豆素为母体的H2S荧光探针,因其具有荧光强度高、溶解性与细胞渗透性好、易于合成与修饰、以及优越的荧光量子产率和光稳定性等优势,备受研究者的青睐。
目前文献中报道的H2S荧光探针的识别机理主要基于三种设计策略:1)叠氮基(—N3)、硝基(—NO2)、羟胺(—NH2OH)的还原反应;2)亲核反应;3)H2S与某些金属结合能力强,如硫化铜沉淀。本文以不同的识别机理综述近三年以香豆素为母体设计的荧光探针对H2S的检测研究。
1 荧光探针法检测H2S
1.1 基于H2S还原性的荧光探针
H2S能够将—N3、—NO2、—NH2OH等基团快速还原为—NH2,其还原速度远高于其他硫醇,从而成为一种有效的H2S识别机制。其中,—N3、—NO2、—NH2OH 等吸电子基团不仅可以作为H2S的识别位点还可以使荧光团的荧光发生淬灭。当被H2S还原之后,荧光团前后“推-拉”电子能力的变化会引起荧光的恢复(探针和客体分子发生光诱导电子转移过程)。基于上述机理,科研工作者充分利用不同取代基的供电子能力,制备出各种各样的用于检测H2S的香豆素类荧光探针。
2020年,Selvaraj Muthusamy等人设计了一种含—N3的香豆素(图1)荧光探针,通过酰胺骨架荧光团与8-氨基喹啉连接,引入杂原子增强了电子离域,从而产生快速的荧光响应和高量子产率。通过波谱和LC-MS分析表明,酰胺骨架-8氨基喹啉(ACAQ)的响应时间为6 min,检测限(LOD)为14.6 nmol/L,对其他可能的干扰物具有很高的抗干扰性。此外,可视化测量结果表明,探针ACAQ能够用于现场样品中H2S的检测[18]。
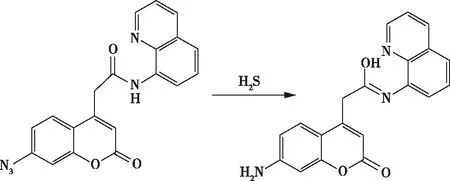
图1 含—N3的香豆素探针的识别位点Figure 1 Recognition sites of coumarin fluorescent probe containing —N3.
2018年,ZHAO等人在7-氨基-4-甲基香豆素和荧光素FRET体系的基础上,设计了一种新型H2S荧光探针Flu-N3(图2),该探针对H2S的检测限为3.1 nmol/L。此外,HepG-2细胞成像和小鼠活体成像实验都表明,探针能够应用于检测生物系统中的H2S[19]。
2019年,解畅等人合成了一种响应速率相当的荧光共振能量转移—分子内电荷转移(FRET-ICT)双反应H2S荧光探针(图3)。该探针是根据双淬灭效应(7-硝基-1,2,3-苯并二唑(NBD)-哌嗪参与的FRET淬灭和—N3参与的ICT淬灭,增加荧光淬灭程度。当探针和H2S反应后,双淬灭效应同时消失,荧光增强明显,有效提高探针的灵敏性。探针可以与H2S发生还原和亲核取代反应(H2S将—N3还原为—NH2,氢离子取代NBD);并且探针中两个反应基团的反应速率相当,探针对H2S的检测限为40 nmol/L。此外,探针能够用于真核细胞内CBS(胱硫醚β-合酶)活性检测和抑制剂筛选,并且可以检测活细胞中的H2S[20]。
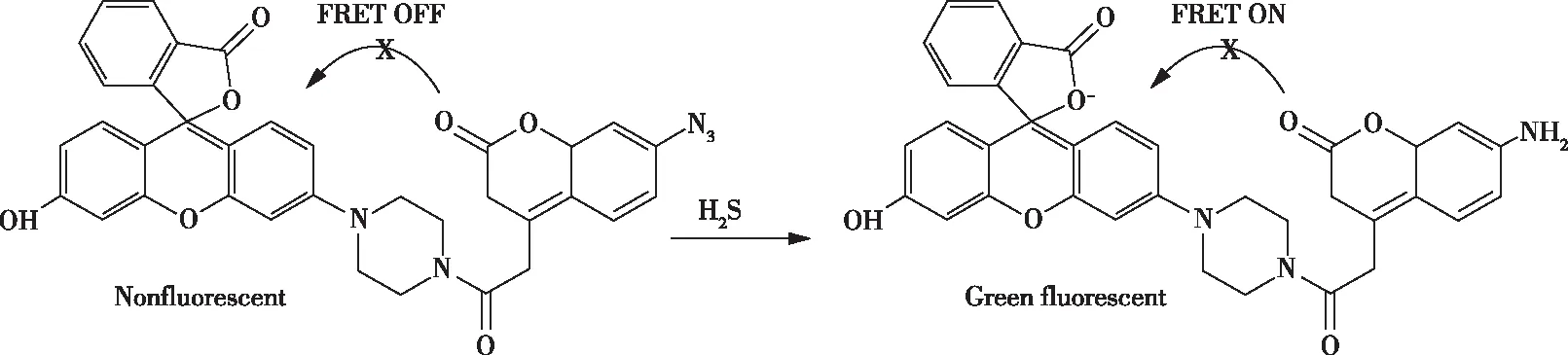
图2 探针 Flu-N3的识别位点Figure 2 Recognition sites of Flu-N3 probe.
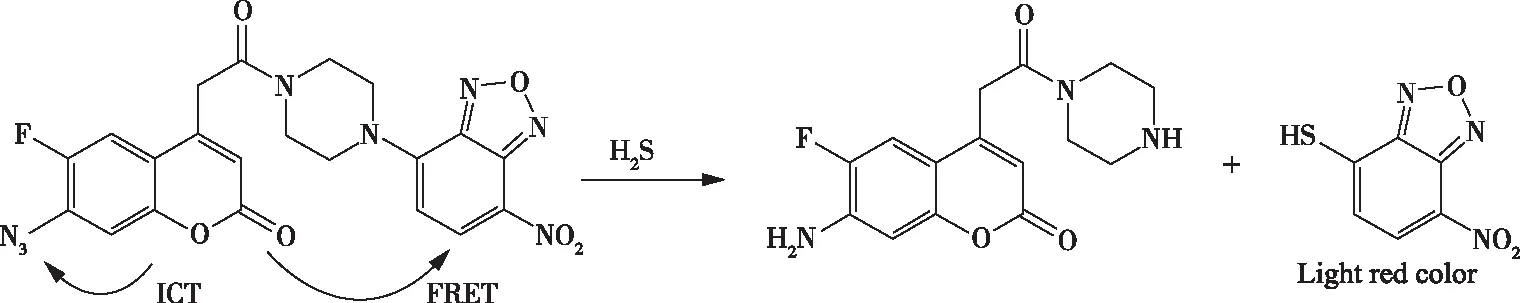
图3 探针的反应位点Figure 3 Reaction site of probe.
2018年,Ewelina Zaorska等人合成了两种用于生物液中H2S检测的自释放荧光探针(图4)。自释放为探针通过H2S介导的叠氮基团还原,生成伯胺,伯胺随后自发发生分子内内酰胺化,释放7-羟基-4-甲基-香豆素和哌啶-2-酮。在相同的反应条件下,化合物2的荧光响应要低得多,这是由于化合物2的逐渐自水解所致。化合物2可用于在生物系统和人体体液,以及在生理pH值和快速响应时间的水介质中估测H2S浓度。最后测量了健康的18~40岁志愿者唾液中的H2S,在获取样本后立即进行浓度测定。健康人的唾液H2S浓度范围为1.641~7.124 mol/L[21]。

图4 荧光探针的结构Figure 4 Structure of fluorescent probe.
2020年,ZHANG等人通过将硝基苯并-2-氧杂-1,3二唑(NBD)的一部分和—N3整合到香豆素平台上设计了一种新型荧光探针(图5),用于生物系统中选择性检测半胱氨酸/高半胱氨酸(Cys/Hcy)和H2S。该探针具有较低的细胞毒性,能够选择性地检测Cys/Hcy和从蓝色和绿色通道得到海拉细胞(HeLa)中的H2S[22]。
1.2 基于H2S亲核性的荧光探针
在生理pH值下,H2S主要以HS的形式存在,与其他硫醇相比,H2S在细胞中具有更高的亲核性,可以更好地参与亲核反应。基于此机制,提出了两种策略,一种是芳香硝基化合物的硫解,另一种是共轭体系的破坏。而采用这两种策略对 H2S 进行检测所遇到的最大困难就是如何使探针分子特异性与 H2S反应。但H2S拥有双亲核性使得这个问题得以解决,研究者们将荧光探针分子用两个亲电中心进行修饰,以达到能够使得H2S与探针发生双硫醇交换机制或者串联迈克尔加成反应机制的目的。利用该机理,科研工作者也设计合成了多种用于检测H2S的荧光探针。
2020年,韩志湘等人用花色素和4-(二乙氨基)水杨醛合成了一种近红外比率荧光探针分子1(图6。结果表明:探针分子1溶液中加入H2S时,因H2S与探针分子1中苯并吡喃部分发生亲核加成反应,破坏了其共轭体系,导致720 nm处的近红外(NIR)发射荧光强度降低;同时,其加成产物含有完整的半刚性香豆素荧光团,在503 nm处的绿色荧光强度显著增强。由于探针1的发射波长与半刚性香豆素的发射波长不同,因此在加入H2S前后有两个完全分离的发射峰,实现了对H2S的有效比率检测。当加入4.0 μmol/L硫化钠时,荧光强度增强了19.2倍。探针分子1对水溶液中的H2S的线性响应范围是0.1~4 mol/L(R2=0.993 9),检测限为57.8 nmol/L。探针分子1对H2S响应时间为110 s,且有较好的选择性。此外,探针分子1还被成功应用于活细胞中内源性和外源性H2S的荧光成像[23]。

图5 探针的识别位点Figure 5 Recognition sites of probe.
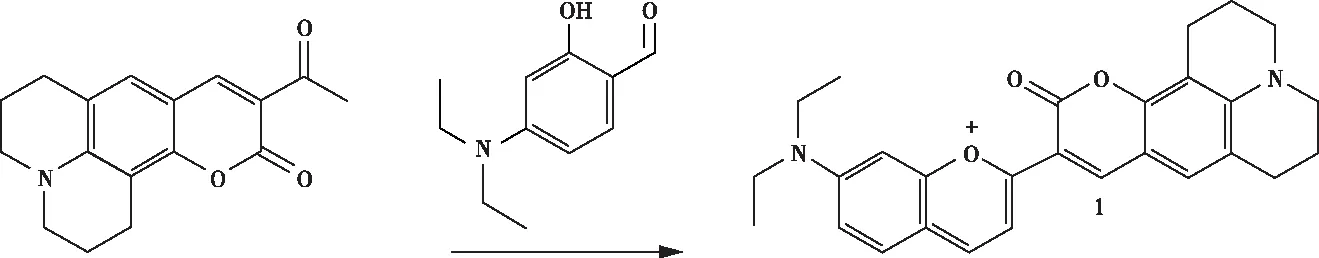
图6 探针的合成Figure 6 Synthesis of probe.
2021年,TANG等人基于罗丹明和香豆素荧光基团,设计了一种新的双识别位点探针SZ(图7)。其中,苯肼和2,4-二硝基苯磺酰分别作为ONOO-和H2S的反应位点。SZ探针对ONOO-和H2S具有良好的选择性和较低的检测限;更重要的是,SZ通过监测ONOO-的波动来评价内源性H2S对羰基胁迫的影响。因此,这种新型的羰基应激标记荧光探针将有助于理解羰基应激的发病机制和解毒药物的开发[24]。
2018年,YANG等人以香豆素为荧光团和二硝基苯基作为高效的荧光猝灭剂设计了一种探针(Cda-DNP) 香豆素-二硝基苯(图8)。该探针结合了高效的开关效率和显著的膜穿越能力,可实现细胞和动物体内自发产生的H2S检测和动态绘图。H2S在生物体内的检测具有以下前所未有的优点:H2S容易进入几乎所有的细胞,整个细胞空间映射H2S;单细胞中自发H2S的动态定位;动物器官中自发H2S的体内成像。该探针对H2S的检测限为0.18 μmol/L,特别是,探针穿越血液/组织/细胞屏障,实现对活斑马鱼代谢器官内源性H2S的定位。本研究的结果将为研究H2S生理和H2S相关疾病提供令人兴奋的机会[25]。

图7 探针的识别位点Figure 7 Recognition sites of probe.

图8 探针的识别机理Figure 8 Recognition mechanism of probe.
2020年,ZHANG等人合成了两种比率型H2S荧光探针(图9),该探针选择香豆素衍生的花青素荧光团作为受体,引入两个绿色荧光团作为供体。该探针在665 nm处表现出强大的近红外发射。HS-与亚胺碳的亲核加成反应破坏了花青素的大共轭体系,导致其吸收能力下降,从而阻断了FRET过程,增加了绿色荧光发射。探针NBD-CMC和Nap-CMC在水溶液中均表现出特定比例的H2S检测能力。对H2S的响应时间分别为60和90 s。此外,探针NBD-CMC还成功地应用于细胞内外源性和内源性H2S的检测,为H2S比值荧光成像探针的研制提供了有力的设计思路,为H2S各种生理和病理功能的研究奠定了基础[26]。
2021年,FENG等人首次设计了一种双功能三位点荧光探针GH(图10),不仅可以将纸条与颜色识别器耦合,对废水中的H2S进行可视化定量分析,还可以对活细胞中的GSH进行灵敏监测,这取决于不同的发射通道和溶液的pH值。通过荧光、紫外-可见光谱、核磁共振氢谱和密度泛函(DFT)计算,证明了GH对H2S/GSH的识别性能。更重要的是,荧光试纸与带有颜色识别器应用程序的便携式智能手机传感平台可以实现低成本、快速的比色水质检测,在环境监测领域显示出巨大的应用潜力[27]。
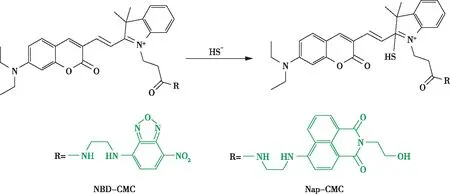
图9 探针的识别位点Figure 9 Recognition sites of probe.
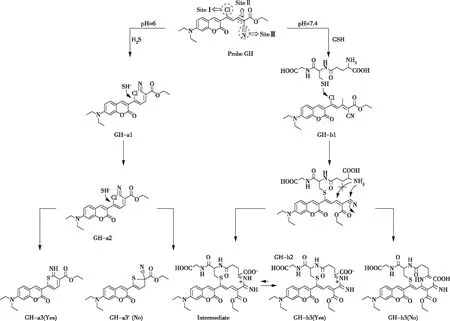
图10 探针的识别位点Figure 10 Recognition sites of probe.
2019年,LEI等人设计了一种基于香豆素的荧光探针IAC(图11),该探针在580 nm具有较强的红色荧光,通过DFT和ESI-MS研究了感应过程,发现亲核反应有助于IAC与H2S之间的红色荧光增强。IAC能快速、选择性地检测H2S,检测限为3.3×10-8mol/L。细胞毒性(MTT)检测和细胞成像结果表明,IAC具有良好的膜通透性和低毒性,这使得IAC可以应用于活细胞和动物检测[28]。
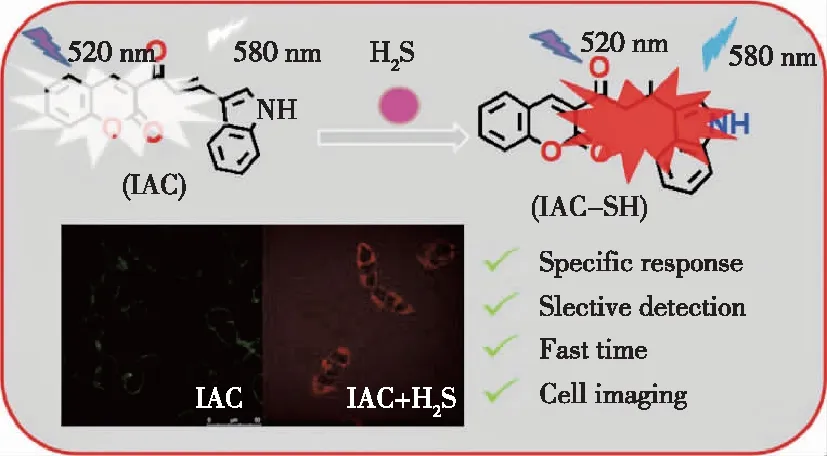
图11 探针的识别位点Figure 11 Recognition sites of probe.
2019年,YANG等人基于α,β-不饱和乙醇香豆素荧光团,设计了用于检测H2S的探针(图12)。乙醇/水缓冲液中DHC的紫外-可见光谱在470 nm处有明显的吸收。加入H2S后,吸收强度降低,从470 nm转移到482 nm,而其他分析物则不能引起上述现象。该探针对H2S的检测限低至5×10-8mol/L,响应时间小于60 s。此外,4~11的宽pH值范围使其能够在生物系统中应用。最重要的是,MTT实验和细胞成像实验表明探针具有低毒和膜透性突出的特点,使探针能够成功成像于H2S小仓鼠肾(BHK)细胞[29]。
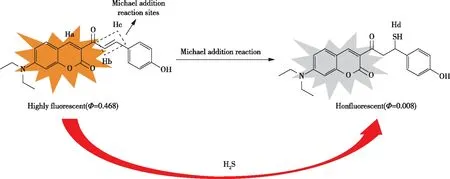
图12 探针对H2S的反应机理Figure 12 Reaction mechanism of probe to H2S.
2020年,ZHAO等人合成了首个线粒体靶向双检测单荧光探针Mit-CM(图13),该探针以花青素-香豆素作为荧光团(花青素的染料不仅可以作为能量受体,而且也可以作为4-氨基苯乙烯基4位ICT的能量供体。香豆素基染料的丙烯酸酯能有效淬灭Cys的荧光,并提供特定的识别位点。具有供电子基团的4-氨基苯乙烯基到吲哚的ICT和香豆素到花青素的FRET可以同时发生)。该探针可分别单独和连续显示H2S、Cys和H2S/Cys的多响应信号。此外,Mit-CM对H2S检测限低至42 nmol/L。因此,我们期望Mit-CM能成为研究复杂多样内部环境中相关生物分子间相互关系的有力分子工具。此外,在特定的细胞器中,合理的设计策略应被广泛应用于构建具有多种功能的单一荧光探针来追踪生物活性物质[30]。
2020年,LI等人研制了一种双通道香豆素荧光探针(图14)。该探针α,β不饱和酮与苯甲醛相邻,建立了空间阻性反应模型。长链GSH既能与探针的α、β不饱和酮反应,又能与醛基反应,从而产生绿色荧光。结构紧凑的H2S首先与α、β-不饱和酮反应,然后巯基与醛发生二次亲核环化反应,形成一个五元环将整个分子接合,使体系发出黄色荧光。实现了两种发射通道对GSH和H2S的高选择性识别检测。该探针对GSH和H2S的检测限分别为7.55和28.55 μmol/L。同时,该探针在选择性、毒性、稳定性等方面表现出良好的性能。细胞实验也证明该探针能同时检测内源性和外源性GSH和H2S[31]。
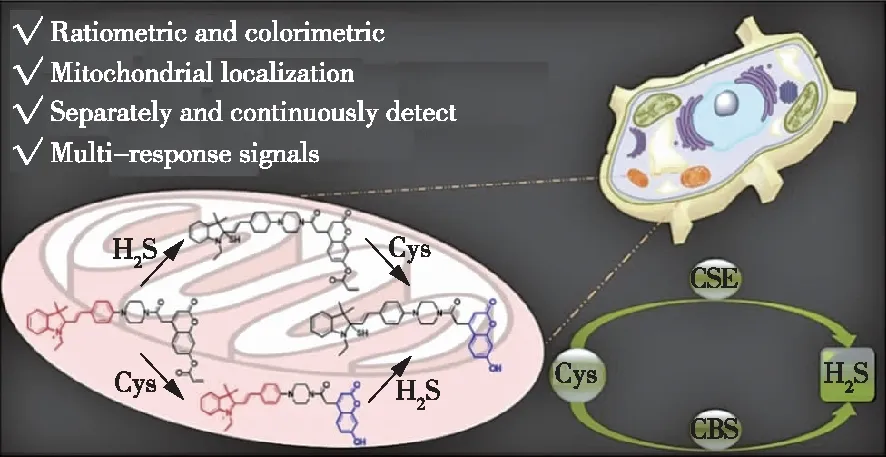
图13 探针的识别位点Figure 13 Recognition sites of probe.
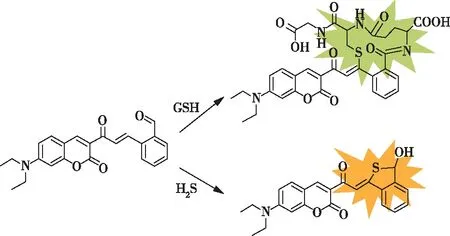
图14 探针的识别位点Figure 14 Recognition sites of probe.
2018年,侯鹏等人以 2,4-二硝基苯基为识别基团,香豆素类染料为信号表达基团,合成了反应型H2S荧光探针(图15)。荧光团与2,4-二硝基苯基之间的光诱导电子转移(PET)过程,导致探针的荧光淬灭,探针本身无荧光或发出很弱的荧光。当加入H2S后,H2S具有较强的亲核性,和探针发生亲核取代反应使识别基团脱离,体系内PET过程失效;生成具有强烈绿色荧光的香豆素类染料。通过反应前后荧光光谱的变化来检测H2S。该探针对H2S具有良好的选择性和灵敏度,可以在生理条件(pH=7.4)下检测H2S。当探针的浓度为10 μmol/L时,其对H2S的检测限为3.0×10-8mol/L,在490 nm荧光强度最大增强75倍[32]。
2020年,JING等人设计了一种新的双发射溶酶体靶向荧光探针CM-NBD(图16),该探针能有效区分Cys和H2S以及Hcy/GSH双色模式。探针遇到生物硫醇时,醚键破裂,释放出香豆素荧光团,在465 nm处发出蓝色荧光,NBD发色团(NBD-cys)发出强烈的绿色荧光,NBD-Hcy表现出非常模糊的绿色荧光,NBD-GSH/NBD-SH在565 nm处没有绿色信号。遇到Cys时,CM-NBD在蓝、绿通道出现明显的荧光增强,而Hcy的加入在绿通道表现出有限的增强,GSH和H2S仅呈蓝色荧光增强。探针CM-NBD对外源生物硫醇进行了成像实验,实现了对HeLa细胞和斑马鱼中Cys、Hcy/GSH和H2S的鉴别。这项工作为Cys的特异性检测以及溶酶体Cys在生物医学和生物学中的相关作用提供了一个潜在的工具[33]。

图15 探针的合成Figure 15 Synthesis of probe.

图16 探针的识别位点Figure 16 Recognition sites of probe.
2020年,Zhang等人设计了一种新型荧光探针FHC-O-NBD(图17),提出了一种实用的荧光鉴别Cys/Hcy和GSH/H2S的方法,特别是对H2S的比色检测。FHC-O-NBD与Cys/Hcy反应在486和550 nm处产生两个荧光信号,而GSH/H2S在486 nm处只产生一个荧光信号。而且,只加入H2S,体系的颜色会从无色变为粉色。因此,它可以作为“肉眼”检测H2S的比色探针。此外,FHC-O-NBD能选择性地区分活细胞中的Cys/Hcy和GSH/H2S[34]。
2018年,ZHANG等人合成一种溶酶体靶向荧光探针Lyso-RC(图18),用于同时区分溶酶体中的Cys/Hcy、GSH和H2S。Lyso-RC对不同的生物硫醇反应时,表现出不同的信号模式(分别为蓝-红、绿-红、红),当Lyso-RC与H2S作用时,相应的醚键被切断,释放出游离的间苯二酚,产生非发射性的巯基香豆素(Lyso-C-SH),从而产生强烈的红色荧光信号。当用GSH处理Lyso-RC时,相应的醚键也被切断,释放出红色的间苯二酚和绿色的硫代香豆素(Lyso-C-S-GSH)。我们希望这一独特的探针能够成为解开溶酶体中生物硫醇的复杂相互作用网络的强大分子工具[35]。

图17 探针的比色检测Figure 17 Colorimetric detection of probe.

图18 探针的识别位点Figure 18 Recognition sites of probe.
2019年,ZHANG等人受多信号组合策略的启发,首次通过醚键将7-二乙基香豆素和间苯二酚结合成功,用于生物硫醇检测和鉴别的单分子荧光探针RC (图19)。同时检测Cys、Hcy、GSH和H2S。令人满意的是,RC在溶液和活细胞中对各自的生物硫醇表现出不同的信号模式(H2S为红色,Cys为蓝色-红色,Hcy为蓝色-绿色-红色,GSH为绿色-红色)。这项工作有可能为发现同时区分不同RSS的荧光探针开辟新的途径,并为阐明生物硫醇复杂的相互作用和确切的生物学功能提供强大的化学工具[36]。

图19 探针的识别位点Figure 19 Recognition sites of probe.
2018年,YANG等人以2,4-二硝基苯和7-硝基-1,2,3-苯并恶二唑两个荧光团通过醚键合成了一种荧光探针NCQ(图20),NCQ有两个反应位点。对于反应位点1,醚键可以被5个硫醇全部切断,底物释放出蓝色的CQ和非荧光的硫取代的NBD中间体。2号位点仅对噻吩有反应,对Cys/Hcy/GSH/H2S无反应。噻吩可以同时裂解DNB和NBD的醚键,释放出蓝色的香豆素1,进而形成红色的TQC。NCQ溶液对Cys/Hcy、GSH/H2S和硫酚呈现明显的荧光信号:Cys/Hcy为蓝色和绿色,GSH/H2S为蓝色,硫酚为蓝色和红色。通过蓝-绿-红发射色组合,可在溶液和活细胞中鉴别检测Cys/Hcy、GSH/H2S[37]。
1.3 基于CuS沉淀机理的荧光探针
向荧光团引入一个含Cu2+的配位基团后,顺磁性的Cu2+金属中心能够有效地将荧光基团的荧光淬灭掉。由软硬酸碱理论,软碱S2-与交界酸Cu2+有较强的亲和力;因此若向该Cu2+配合物中引入H2S,则Cu2+会倾向于生成比配合物更加稳定的CuS沉淀(Ksp=1.26×10-36),从而使得探针主体中的Cu2+被“剔除”,于是荧光得以恢复,就此达成对H2S的识别和检测。
2018年,尹正日利用香豆素酰肼肟荧光配体合成了一个H2S荧光探针1-Cu2+(图21)。配体1和Cu2+的配合作用,容易得到配合物1-Cu2+。由于具有顺磁效应的Cu2+具有猝灭荧光的特点,1-Cu2+的荧光很弱。Cu2+的脱除可以使得荧光配体的荧光得到恢复,表现出对H2S的荧光增强。此探针对H2S显示出很高的选择性。在PBS缓冲溶液中,此探针对H2S的响应时间为5 s,检测限为37 nmol/L。该探针具有可再生利用和抗干扰的特点,具有很强的实用性[38]。
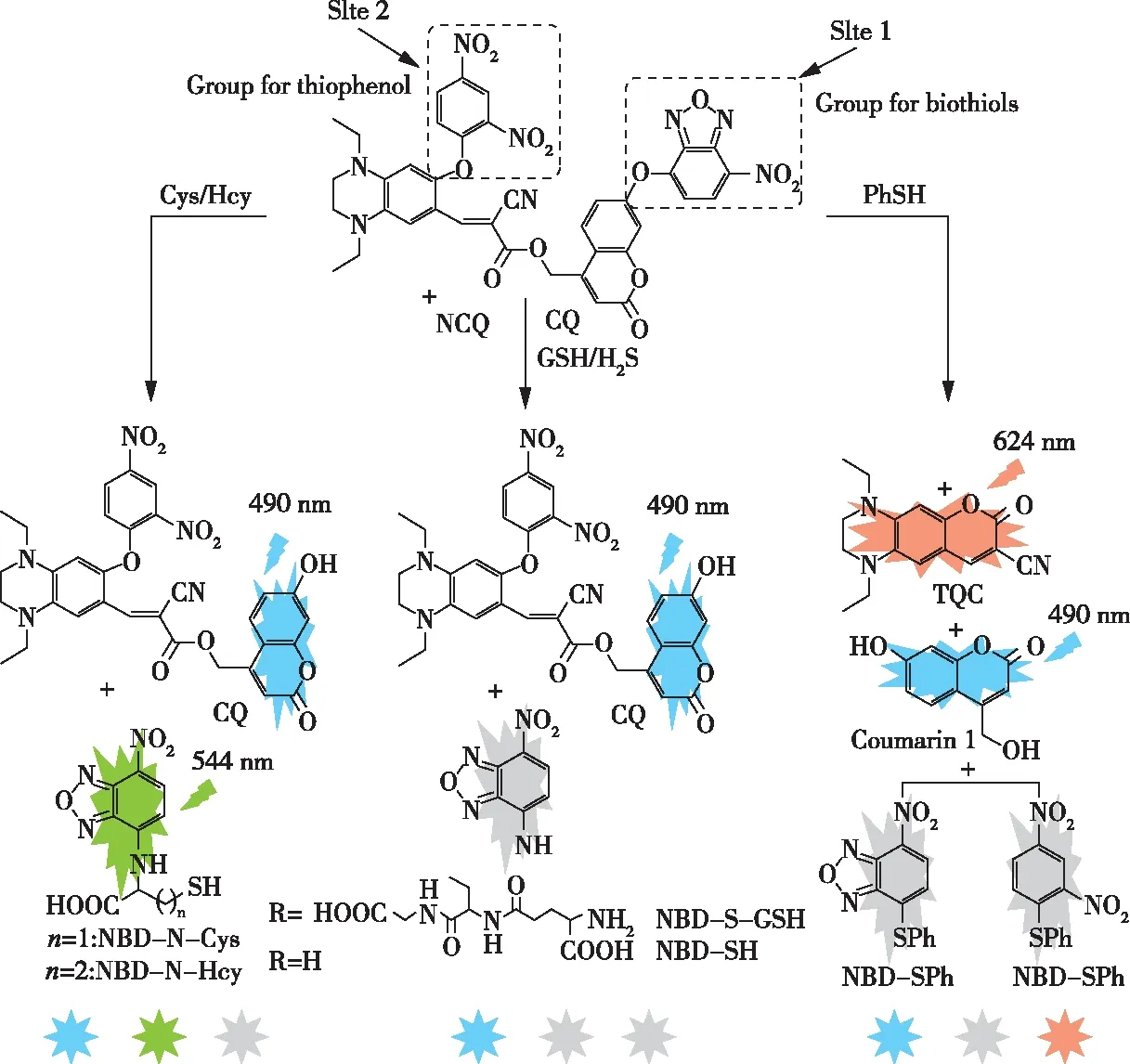
图20 探针的识别位点Figure 20 Recognition sites of probe.
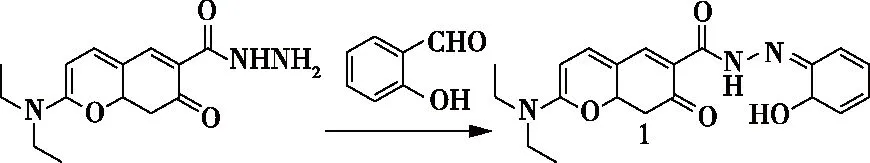
图21 探针的合成Figure 21 Synthesis of probe.
2019年,LIU等人合成一种新型的香豆素荧光探针CMOH(图22),用于检测水介质和活细胞中的Cu2+和S2-。CMOH对Cu2+具有较高的灵敏度和选择性,探针通过1∶1的结合方式与Cu2+形成非荧光络合物CMOH-Cu2+。根据位移法,CMOH-Cu2+的荧光在S2-存在下被恢复,其检测限为11.4 nmol/L。
这种“开-关-开”过程可在1 min内完成,并至少重复5次。此外,CMOH渗透性好,细胞毒性低,可作为检测生物系统中Cu2+和S2-变化的合适工具[39]。
2019年,YAN等人设计一种基于香豆素的“开-关-开”比色荧光探针L(图23),用于连续识别Cu2+和S2-。该探针对Cu2+和S2-的检测限分别为2×10-8和6×10-8mol/L。此外,合适的宽pH值(4~10),表明探针L可以应用于生物检测,MTT实验表明探针的细胞毒性可以忽略,在体内识别Cu2+和S2-的潜力很大,而且可用于测定A375细胞中的Cu2+和S2-[40]。

图22 探针的作用机理Figure 22 Mechanism of probe.

图23 探针的识别位点Figure 23 Recognition sites of probe.
本文从H2S荧光探针的识别机理进行归纳和整理。如表1所示,文献中报道的大多数H2S探针不仅可以用于细胞中内源性和外源性H2S的检测,而且还可以用于气体中检测H2S。
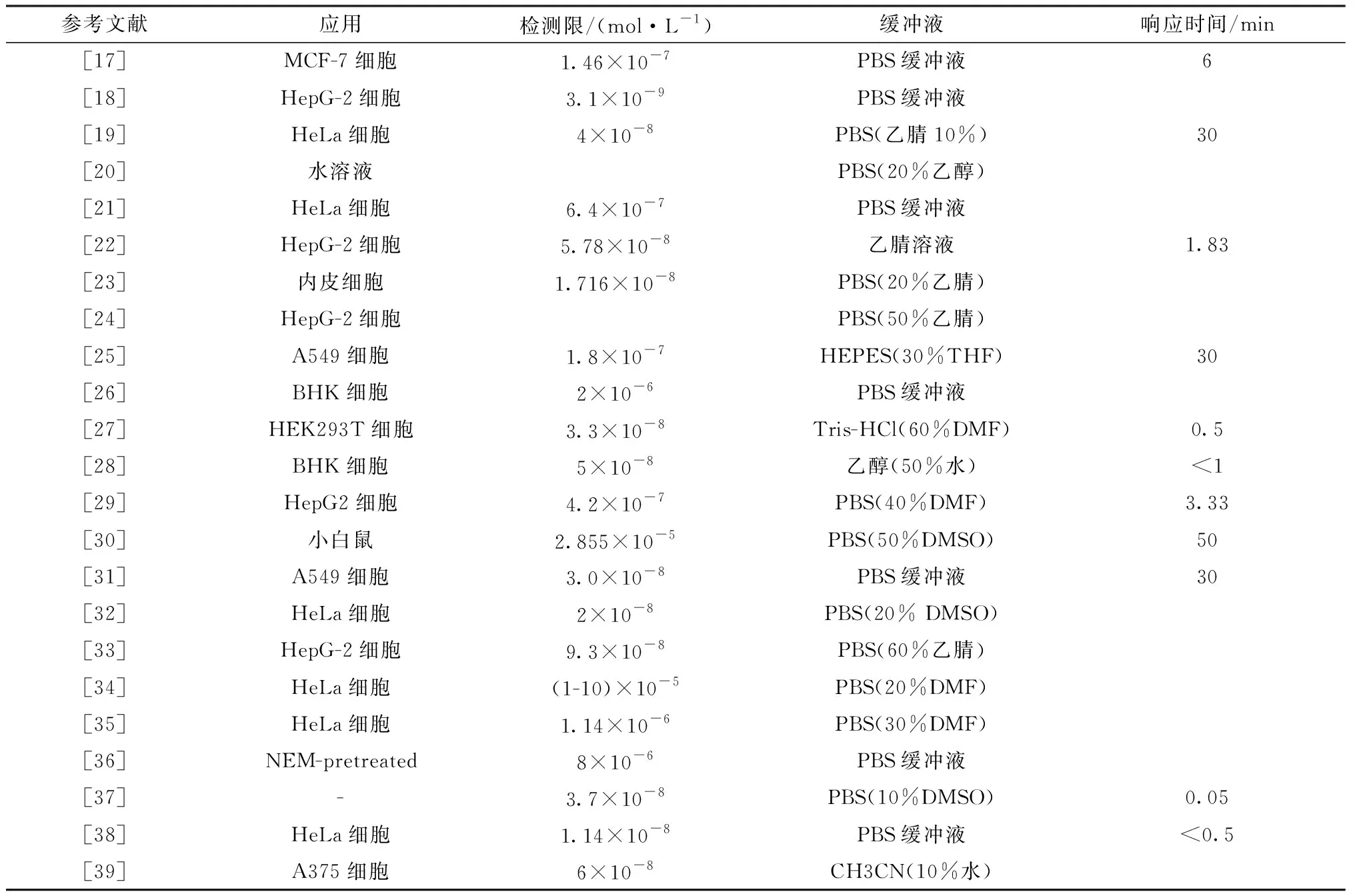
表1 H2S荧光探针汇总
2 结论和展望
近三年来,荧光探针检测H2S报道的不少,但基于香豆素荧光团所设计的H2S荧光探针报道的较少,仍然有大量的创新有待研发。例如,通过在香豆素3、4号位上连接不同的基团用来形成不同的探针,在7号位上连接不同的基团,如羟基,二乙氨基等,这样香豆素基团3、4或7号位上都能连接不同的基团,可以形成同时检测两种物质或者起到协同作用。已有少数科研工作者做了一些研究,但更深入的研究仍需要更多的探索。

