胸主动脉缩窄术复制压力超负荷兔子模型对心肌细胞增殖、血流动力、心肌成纤维增生及心功能的变化
冯卫中 徐鹏 张金堂
[摘要] 目的 探讨胸主动脉缩窄术复制压力超负荷兔子模型心肌细胞增殖、血流动力、心肌成纤维增生及心功能的变化。 方法 随机选取清洁级健康成年新西兰大白兔60只,将兔子随机分为假手术组及模型组两组,每组兔子30只。假手术组开胸后不结扎胸主动脉,模型组开胸后分离胸主动脉。分别测定各组兔子血流动力学和心功能指标水平、心重指数和心肌细胞体积水平、心肌细胞增殖情况、心肌组織形态变化以及各组心肌胶原含量以及各组血清脑钠肽(BNP)、氨基端前脑钠肽(NT-proBNP)水平。 结果 与假手术组对比,模型组兔子LVSP、LVDP、动脉收缩压及动脉舒张压、BNP、NT-proBNP水平、心重指数、细胞增殖指数均明显升高,心肌细胞体积、CVF-V、CVF-NV含量均明显增加,+dp/dtmax、-dp/dtmax水平均明显减低(P<0.05或P<0.01)。假手术组心肌细胞排列正常,细胞核呈椭圆形,心肌间质无明显增生,心肌纤维走形整齐、结构清晰;模型组部分心肌细胞周围结构不清,细胞核固缩,心肌纤维排列紊乱,纤维增生肥大、断裂。 结论 胸主动脉缩窄术复制压力超负荷兔子模型能够抑制心肌细胞增殖、促进心肌成纤维增生,对兔子血流动力及心功能均产生了严重影响。
[关键词] 胸主动脉缩窄术;压力超负荷;心肌细胞增殖;血流动力;心肌成纤维增生;心功能
[Abstract] Objective To investigate the changes of myocardial cell proliferation, hemodynamics, myocardial fibroblast hyperplasia and cardiac function in rabbits with pressure overload replicated by thoracic aortic coarctation. Methods A total of 60 clean healthy adult New Zealand rabbits were randomly selected and divided into two groups: the sham operation group(n=30) and the model group(n=30). The sham operation group was not ligated the thoracic aorta after thoracotomy, while the model group was separated the thoracic aorta after thoracotomy. Hemodynamics and cardiac function index level, cardiac weight index and myocardial cell volume level, myocardial cell proliferation, myocardial tissue morphological changes, myocardial collagen content, serum brain natriuretic peptide(BNP) and amino-terminal pro-brain natriuretic peptide(NT-proBNP) levels in each group were measured respectively. Results Compared with the sham operation group, LVSP, LVDP, arterial systolic pressure and diastolic pressure, BNP, NT-proBNP level, cardiac weight index and cell proliferation index in the model group significantly raised. The myocardial cell volume, CVF-V, CVF-NV content were significantly increased, and +dp/dtmax and -dp/dtmax levels were significantly decreased(P<0.05 or P<0.01). In the sham operation group, myocardial cells were arranged normally, nucleus was oval, myocardial interstitium did not proliferate obviously, and myocardial fibers had regular shape and clear structure. In the model group, the peripheral structure of some myocardial cells was unclear, nucleus shrinked, myocardial fibers were disordered, and fibers proliferated, hypertrophied and fractured. Conclusion The pressure overload rabbit model reproduced by thoracic aortic coarctation can inhibit myocardial cell proliferation and promote myocardial fibroblast hyperplasia, which has a serious impact on rabbits′ hemodynamics and cardiac function.
[Key words] Thoracic aortic coarctation; Pressure overload; Myocardial cell proliferation; Hemodynamics; Myocardial fibroblast hyperplasia; Cardiac function
心肌肥厚是心肌对高血压、瓣膜病、急性心肌梗死等多种原因造成的压力或容量超负荷的一种基本应答,主要表现为心肌细胞体积增大、心肌间质组织增生等,使心脏的顺应性及循环泵功能明显降低[1]。研究发现,心肌肥厚与多种心血管疾病的发展过程密切相关,其在代偿初期往往能够维持正常的室壁张力,但长期的心肌肥厚会明显增加心衰和猝死的发生率,心肌肥厚可作为心肌缺血、心律失常以及猝死等的独立危险因素[2]。心肌肥厚是一个复杂的病理过程,其发生机制尚不明确,认为主要与心肌负荷过重、心肌坏死纤维化、心肌细胞凋亡、神经内分泌、基因改变以及环境等因素有关[3]。据报道,在心肌肥厚的启动机制方面,压力或容量超负荷对心肌细胞膜产生的牵张作用被室壁的机械感受器所感受,经细胞骨架或牵张激活的离子通路转入胞内;此外,压力或容量超负荷还会使细胞因子、生长因子等神经体液因素的释放明显增多[4-5]。目前,心脏瓣膜置换术是治疗瓣膜疾病的主要方式,但其对于部分以主动脉瓣狭窄为主的心脏疾病术后心脏舒张功能的恢复效果不佳,其中,主动脉瓣狭窄为主联合瓣膜病患者心肌纤维化程度尤其严重[6]。因此本组研究主要采用胸主动脉缩窄术复制压力超负荷左心肥厚兔子模型,旨在探讨其对心肌细胞增殖、血流动力、心肌成纤维增生及心功能的影响。
1 材料与方法
1.1 实验动物
随机选取清洁级健康成年新西兰大白兔60只[江苏振林生物科技有限公司,SCXK(苏)2019-0002],月龄4个月,体重(1960.17±132.32)g,在实验室温度(24±3)℃、湿度(45±5)%、昼夜时间各12 h的环境中适应性饲养1周。
1.2 实验器材及试剂
超低温冰箱(北京艾泽信科技有限公司,型号:DW-86L288);电子天平(上海友缜电子科技有限公司,型号:BSM);电子显微镜(济宁市鑫兖矿山机械设备有限公司,型号:SZ-139);电热恒温水箱(苏州凯特尔仪器设备有限公司,型号:K-WHS);石蜡切片机(北京盛科信德科技有限公司,型号:RM2235);低温高速离心机(山东博科科学仪器有限公司,型号:TG-16M);超净工作台(山东博科科学仪器有限公司,型号:BBS-H1100);多普勒超声测定仪(北京中西远大科技有限公司,型号:LSH10-1);全自动生化分析仪(美国美国贝克曼库尔特公司,型号:AU5800);戊巴比妥钠(上海信裕生物科技有限公司,规格:1 mg/mL);二甲苯(张家港泽润欣化工有限公司);苏木素-伊红染液(HE)(上海信帆生物科技有限公司)。
1.3建立实验动物模型
将兔子随机分为假手术组及模型组两组,每组兔子30只。
建立动物模型:将兔子禁食4 h后经耳缘静脉注射30 mg/mL 3%戊巴比妥钠进行麻醉,当兔子后肢脚蹬反射消失后,取仰卧位,将其固定于工作台上。剔除颈部毛发,剪开颈部皮肤进行气管插管。将兔子胸部毛发剔除,消毒,沿胸骨中线偏左剪开皮肤并逐层分离肌肉,打开胸腔(过程中避开肋间动脉),取开胸器固定,暴露升主动脉,分离主动脉弓周围血管及结缔组织。定位分离胸主动脉,使用无菌聚乙烯塑料管垫扎约50%,排除胸腔空气,逐层缝合肌肉及皮肤。当兔子恢复自主呼吸后,拔出气管插管。术后正常饮食,连续3 d注射青霉素防止感染。假手术组开胸后不结扎胸主动脉,其余步骤同模型组相同。
1.4 实验方法
心功能:每组取5只兔子,采用多普勒超声测定仪测定各组左心室舒张压(Left ventricular diastolic pressure,LVDP)、左心室收缩压(Left ventricular systolic pressure ,LVSP)、左心室内压最大上升速率(+dp/dtmax)及左心室内压最大下降速率(-dp/dtmax)变化。
血流動力学:采用多普勒超声测定仪测定各组兔子动脉收缩压、动脉舒张压、心率等的变化。
每组取5只兔子,取出心脏,去除血管、脂肪等多余组织,吸干水分后称重,计算各组兔子心重指数。心重指数=心脏重量/体重。将心脏切碎,离心,在显微镜下观察心肌细胞的长度、厚度及宽度,计算各组心肌细胞体积变化。心肌细胞体积=[π×(宽度÷2)×(厚度÷2)]×1。
采用免疫组化法测定两组兔子增殖细胞抗原(Proliferating cell antigen,PCNA)表达水平。每组取5只兔子,取出心脏,将其放入福尔马林溶液中进行固定,常规制作石蜡切片,将组织切片在60℃烤箱中烤约30 min,使用二甲苯脱蜡、酒精脱水,加入0.01 mol/L柠檬酸钠进行抗原修复,室温下静置30 min,5%羊血清封闭,去除血清加一抗在4℃条件下孵育过夜,加入二抗,使用磷酸盐缓冲液冲洗,免疫组化染色、DAB显色、苏木素复染、脱水、透明、封片。在显微镜下进行观察。取细胞分布均匀的5个视野,每个视野下约200细胞,观察、记录各组阳性细胞数,并计算细胞增殖指数。
采用HE染色法观察各组心肌组织形态变化。每组取5只兔子,取其心脏,常规制作石蜡切片,放入60℃左右烤箱中烤干,使用二甲苯脱蜡、酒精脱水,苏木素染色约5 min,流水冲洗,蒸馏水浸泡10 min,伊红染色3 min,脱水、透明、树胶封片。使用显微镜进行观察记录。
每组取5只兔子,采用组织光度法测定各组心肌胶原含量,心肌胶原含量采用胶原容积分数(Collagen volume fraction,CVF)表示,包括CVF-V、CVF-NV。
将剩余5只兔子取腹主动脉血5 mL,静置离心,取上清液,采用全自动生化分析仪测定各组血清脑钠肽(Brain natriuretic peptide,BNP)、氨基端前脑钠肽(N-terminal pro-brain natriuretic peptide,NT-proBNP)水平。
1.5观察指标
测定各组兔子心功能(LVDP、LVSP、+dp/dtmax、-dp/dtmax)水平、血流动力学(动脉收缩压、动脉舒张压、心率)水平、心重指数、心肌细胞体积、PCNA表达水平、细胞增殖指数、心肌组织形态变化、心肌胶原含量(CVF-V、CVF-NV)以及血清BNP、NT-proBNP水平变化。采用免疫组化法测定两组兔子心肌细胞增殖情况。采用多普勒超声测定仪测定各组兔子血流动力学及心功能指标水平。采用HE染色法观察各组心肌组织形态变化。采用组织光度法测定各组心肌胶原含量。采用全自动生化分析仪测定各组血清BNP、NT-proBNP变化。
1.6 统计学方法
采用SPSS20.0统计学软件进行数据分析,本组研究中计数资料以[n(%)]表示,比较均采用χ2检验。计量资料以(x±s)表示,比较均采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组兔子心功能指标比较
与假手术组对比,模型组兔子LVSP、LVDP水平均明显升高,+dp/dtmax、-dp/dtmax水平均明显减低(P<0.01或P<0.05)。见表1。
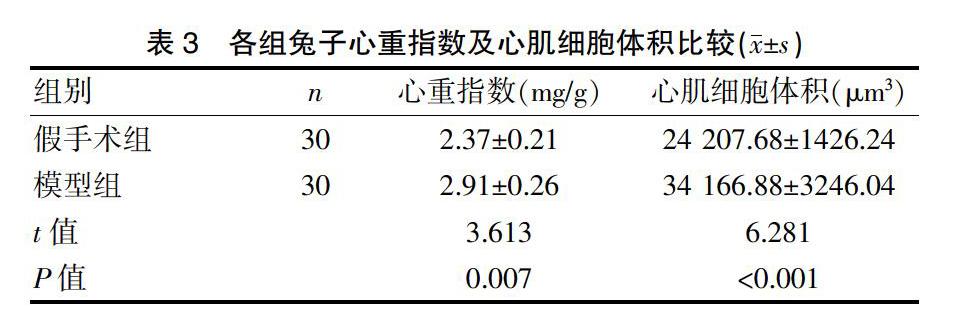
2.2 各组兔子血流动力学比较
与假手术组对比,模型组兔子动脉收缩压及动脉舒张压均明显升高(P<0.01),两组心率比较差异无统计学意义(P>0.05)。见表2。
2.3 各组兔子心重指数及心肌细胞体积比较
与假手术组对比,模型组心重指数及心肌细胞体积均明显增加(P<0.01)。见表3。
2.4 各组兔子心肌细胞增殖情况比较
细胞阳性主要表达于细胞核中,染色呈棕黄色。模型组细胞增殖指数明显高于假手术组(P<0.01)。见表4。
2.5 各组兔子心肌组织形态变化
假手术组:心肌细胞呈杆状,心肌细胞排列正常,细胞核呈椭圆形,心肌间质无明显增生,心肌纤维走形整齐、结构清晰,无扩张及血管壁增厚。模型组:心肌细胞变形、部分心肌细胞周围结构不清,心肌细胞核固缩,心肌纤维排列紊乱,间隙增宽,纤维增生肥大、断裂。见封三图4。
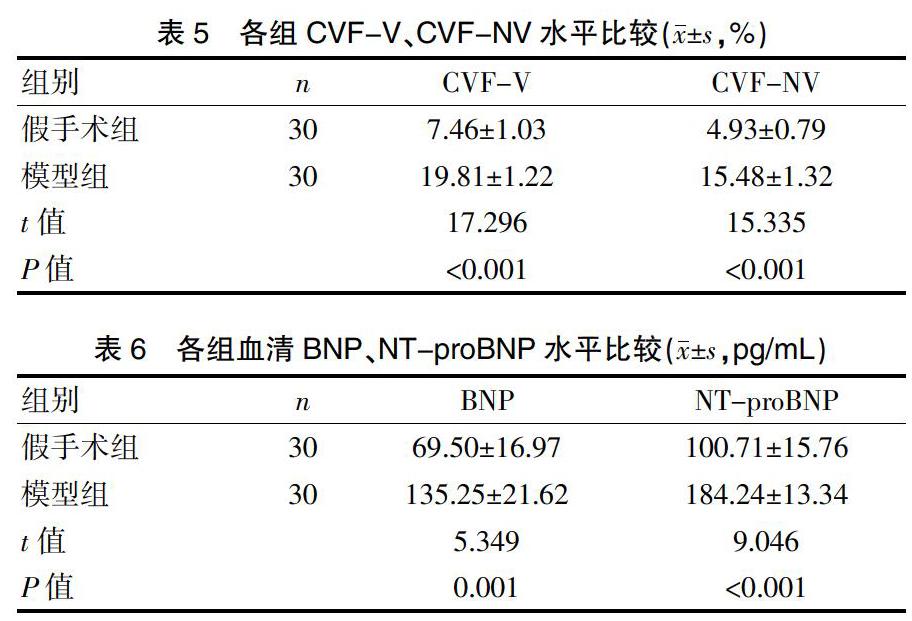
2.6各组CVF-V、CVF-NV水平比较
与假手术组比较,模型组心肌CVF-V、CVF-NV含量明显增高(P<0.01)。见表5。
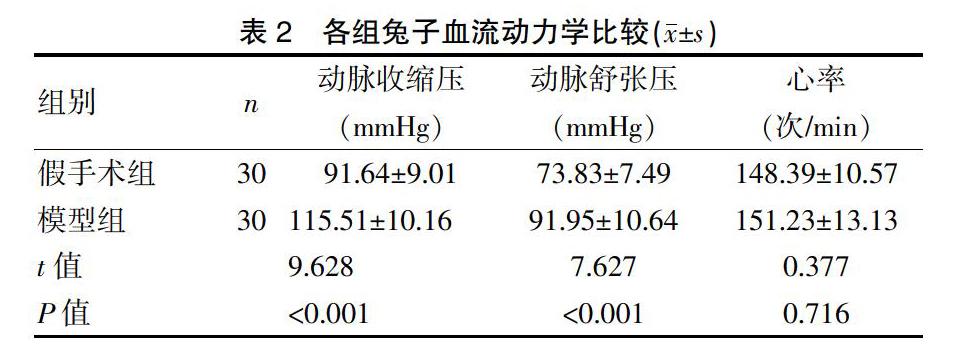
2.7各组血清BNP、NT-proBNP水平比较
与假手术组对比,模型组兔子血清BNP、NT-proBNP水平均明显升高(P<0.01)。见表6。
3 讨论
心肌肥厚是常见于压力负荷长期增加的疾病,如高血壓、主动脉狭窄等,它是心脏的一种代偿性反应,主要表现为心肌细胞增大、间质细胞增生、间质胶原沉积以及心脏重量增加等[7]。心肌肥厚发生的机制是心脏对长期增加的压力负荷产生的适应性反应导致,在负荷过重的刺激下,通过增加肌肉组织的体积,以适应工作负荷的增加[8]。据相关报道,心脏结构性适应不只是有量的增加,还伴有质的变化;不只是心肌细胞、成纤维细胞、血管平滑肌细胞、内皮细胞以及胶原纤维等也发生了明显的改变[9-10]。本研究主要采用胸主动脉缩窄术复制压力超负荷兔子模型,并对其心肌细胞增殖、血流动力、心肌成纤维增生及心功能产生的影响进行分析。
心脏是人和脊椎动物身体血液循环的中枢,也是生命得以维持的基础。它负责提供将血液推进身体各个部分的动力,给身体的组织器官提供充足的血流量,使细胞能够维持正常的代谢及功能[11]。本研究中建立动物模型后,通过超声心电图对心脏进行连续的、反复的观察及血流动力学监测,结果发现,模型组动脉收缩压、动脉舒张压、LVSP、LVDP等均明显高于假手术组,+dp/dtmax、-dp/dtmax均明显低于假手术组(P<0.05),提示胸主动脉缩窄会对血流动力及心功能产生明显影响,LVDP、LVSP、+dp/dtmax、-dp/dtmax等是反映心功能的重要指标。
反映心肌细胞增殖的指标有很多,PCNA又称细胞周期素或DNA聚合酶辅助因子,是主要存在于细胞核中的一种酸性蛋白,它可以作为DNA聚合酶的辅助因子与作为DNA修复相关的辅助因子,在DNA复制和细胞周期过程中起着重要的调控作用,在启动细胞增殖中扮演着重要角色[12-13]。有研究发现,长期的压力负荷除了能够引起心脏、血管结构功能的改变,还可以引起心肌成纤维化增生[14]。心肌成纤维化增生会导致心肌顺应性降低,心肌细胞供氧减少,胶原纤维明显增加;过量增生的胶原纤维会将心肌细胞紧密包围,心肌舒张及收缩功能进一步受损[15-16]。Hui-Hua等[17]研究表明,胶原纤维在维持心脏正常功能方面起着与心肌细胞同等重要的作用,对心肌细胞起支持、排列等作用,是心肌硬度的决定因素。本研究结果发现,胸主动脉缩窄能够使心肌肥厚、心肌细胞体积增大、心肌成纤维增生,对心肌细胞增殖具有明显的抑制作用。
有研究发现,神经内分泌系统过度激活造成的系统反应与心肌肥厚的发生、发展密切相关[18]。BNP、NT-proBNP均为神经内分泌激素,主要由心肌细胞合成,其分泌受神经内分泌系统及血流动力学的调控。当心室功能不全时,BNP、NT-proBNP水平明显升高。BNP、NT-proBNP是反映心力衰竭及其预后的重要预测性指标[19-20]。本研究结果中,模型组BNP、NT-pro BNP水平明显高于假手术组(P<0.05),提示胸主动脉缩窄能够明显使心脏神经内分泌过度激活,促进心肌肥厚的发生,与相关文献[15]研究结果一致。
綜上所述,胸主动脉缩窄术复制压力超负荷兔子模型,能够使心肌细胞明显增大、抑制心肌细胞增殖、促进心肌成纤维增生,对兔子血流动力及心功能均产生了严重影响。
[参考文献]
[1] Kaypakli O,Mustafa Gür,Mehmet Yavuz G?觟zükara,et al. Association between high-sensitivity troponin T,left ventricular hypertrophy,and myocardial performance index[J].Herz,2015,40(7):1004-1010.
[2] Wei X,Wu B,Zhao J,et al.Myocardial Hypertrophic Preconditioning Attenuates Cardiomyocyte Hypertrophy and Slows Progression to Heart Failure Through Upregulation of S100A8/A9[J].Circulation,2015,131(17):1506.
[3] Meng G,Liu J,Liu S,et al.Hydrogen sulfide pretreatment improves mitochondrial function in myocardial hypertrophy via a SIRT3-dependent manner[J].British Journal of Pharmacology,2018,175(8):1126-1145.
[4] Xiong Q,Zhang P,Guo J,et al.Myocardial ATP hydrolysis rates in vivo:A porcine model of pressure overload-induced hypertrophy[J].AJP Heart and Circulatory Physiology,2015,309 (3):H450-458.
[5] Guan P,Liang Y,Wang N.Fasudil alleviates pressure overload-induced heart failure by activating Nrf2-mediated antioxidant responses[J].Journal of Cellular Biochemistry,2018,119(8):6452-6460.
[6] Sos T,Sniderman K,Rettek-Sos B,et al.Percutaneous transluminal dilatation of coarctation of thoracic aorta post mortem[J].The Lancet,2015,314(8149):970-971.
[7] Li J,Cai Y.The dual effects of autophagy in myocardial hypertrophy[J].Acta Cardiologica,2015,70(4):493-498.
[8] Rajapakse NW,Johnston T,Kiriazis H,et al.Augmented endothelial L-arginine transport ameliorates pressure overload induced cardiac hypertrophy[J].Experimental Physiology,2015,100(7):796-804.
[9] Jia Z,Chen Z,Xu H,et al.Pressure Overload-induced Cardiac Hypertrophy Varies According to Different Ligation Needle Sizes and Body Weights in Mice[J].Arquivos Brasileiros de Cardiologia,2018,110(6):568-576.
[10] Chen P,Qiao D,Liu X.Effects and Mechanism of SO2 Inhalation on Rat Myocardial Collagen Fibers[J].Medical Science Monitor:International Medical Journal of Experimental and Clinical Research,2018,24(3):1662-1669.
[11] Ilic A,Ilic D,Tadic S,et al.Influence of Non-Dipping Pattern of Blood Pressure in Gestational Hypertension on Maternal Cardiac Function,Hemodynamics and Intrauterine Growth Restriction[J].Pregnancy Hypertension,2017, 10(10):34-41.
[12] Toischer K,Zhu W,Mark Hünlich,et al.Cardiomyocyte proliferation prevents failure in pressure overload but not volume overload[J].Journal of Clinical Investigation,2017, 127(12): 4285-4296.
[13] Kazunari Sakurai DDSDMSc,Masahiro UDDS,Yumiko TDDS,et al.Increased expression of c-erbB-3 protein and proliferating cell nuclear antigen during development of verrucous carcinoma of the oral mucosa[J].Cancer,2015,89(12):2597-2605.
[14] Takawale A,Zhang P,Patel VB,et al.Tissue Inhibitor of Matrix Metalloproteinase-1 Promotes Myocardial Fibrosis by Mediating CD63-Integrin 1 Interaction[J].Hypertension,2017,69(6):1092-1103.
[15] Talu CK,Cakir Y,Hacihasanoglu E,et al.Inflammatory Myofibroblastic Tumor of the Breast Coexisting with Pseudoangiomatous Stromal Hyperplasia[J].Journal of Breast Health,2016,12(4):171.
[16] Lin Z.Effect of Aerobic Exercise on Myocardial Fibrosis in Aged Spontaneously Hypertensive Rats[J].Journal of Beijing Sport University,2015,44(4):723-729.
[17] Hui-Hua C,Pei Z,Jing T,et al.The effects of Guizhi Gancao Decoction on pressure overload-induced heart failure and posttranslational modifications of tubulin in mice[J].Evidence-Based Complementary and Alternative Medicine,2017,2017(11):1-8.
[18] Li SS,Zhang YG,Cao QM.Effect of recombinant human brain natriuretic peptide on serum inflammatory factors,neuroendocrine hormones and cardiac function in patients with acute myocardial infarction complicated with heart failure[J].Journal of Hainan Medical University,2017, 23(13):14-17.
[19] Alkhawam H,El-Hunjul M,Nguyen J,et al.Natriuretic peptide hormones in congestive heart failure:challenges,clinical interpretation and review of studies[J].Acta Cardiologica,2016,71(4):417-424.
[20] Chalmers JA,Lin SYJ,Martino TA,et al.Diurnal profiling of neuroendocrine genes in murine heart,and shift in proopiomelanocortin gene expression with pressure-overload cardiac hypertrophy[J].Journal of Molecular Endoc-rinology,2018,41(3):117-124.
(收稿日期:2020-04-17)

