牡荆苷对大鼠视网膜缺血-再灌注损伤模型中神经节细胞的保护作用
李漫丽 范珂 崔红培
河南省人民医院眼科 河南省立眼科医院 河南省眼科研究所,郑州 450003
视网膜缺血-再灌注损伤(retinal ischemia-reperfusion injury,RIR)是一种复杂的病理过程,多见于糖尿病视网膜病变、急性闭角型青光眼、视网膜中央动静脉阻塞等缺血性眼部疾病[1]。研究表明,视网膜缺血-再灌注过程中,由于机体抗氧化系统的不平衡,如超氧化物歧化酶(superoxide dismutase,SOD)活性的降低,导致细胞内活性氧簇(reactive oxygen species,ROS)过度堆积,诱发视网膜神经节细胞(retinal ganglion cells,RGCs)凋亡,导致大鼠视力不可逆丧失[3-4]。牡荆苷是金莲花、红草等毛茛科植物的有效成分,属于黄酮碳苷类化合物,难溶于水。研究证实,牡荆苷对脑缺血-再灌注大鼠神经功能具有保护作用,可能与调节辅助性T淋巴(helper T lymphocyte,Th)1/Th2细胞平衡向Th2漂移、减轻脑细胞DNA损伤有关[5]。牡荆苷还可减轻急性脑缺血再灌注大鼠氧化应激反应,推测与调控核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号通路,上调Nrf2的基因和蛋白表达,增强机体的抗氧化应激反应能力有关[6]。然而,牡荆苷对RIR引起的氧化应激损伤是否有保护作用,目前尚未见报道。本研究探讨牡荆苷对RIR模型大鼠视网膜的保护作用及其抗氧化机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性SD大鼠60只,3月龄,体质量(220±10)g,购于北京维通利华公司,饲养于郑州大学动物实验中心,室温20~25 ℃,相对湿度50%~65%,12 h明暗交替。动物饲养及实验过程遵循ARVO要求,本研究经河南省立眼科医院实验动物伦理委员会审核批准(批文号:HNEECA-2019-04)。
1.1.2主要试剂及仪器 牡荆苷标准品(质量分数≥99%,中国国家药品生物制品研究所);丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)、SOD检测试剂盒(武汉博士德生物工程有限公司);TUNEL检测试剂盒、苏木精-伊红检测试剂盒(上海碧云天生物技术有限公司);核蛋白提取试剂盒(美国Sigma公司);托吡卡胺滴眼液(北京华润双鹤药业股份有限公司);荧光金(美国Fluorochrome公司);兔抗大鼠Nrf2多克隆抗体(PA5-68817)、兔抗大鼠血红素加氧酶-1(heme oxygenase-1,HO-1)单克隆抗体(PA5-77833)、兔抗大鼠醌氧化还原酶1(quinone oxidoreductase 1,NQO1)单克隆抗体(39-3700)(美国Invitrogen公司);荧光标记山羊抗兔IgG多克隆抗体(ab205719,英国Abcam公司)。Tono-penXL眼压计(美国Reicherrt公司);荧光倒置显微镜(日本Olympus公司);酶标仪(美国Thermos公司)。
1.2 方法
1.2.1大鼠RIR模型建立 实验大鼠腹腔内注射质量分数10%的水合氯醛(400 mg/kg)行全身麻醉,均取右眼造模,质量分数1%地卡因点眼行表面麻醉,托吡卡胺滴眼液扩瞳,固定头部,将输液器一端连接含无菌生理盐水的输液瓶,另一端连接32G胰岛素针头,取胰岛素针头平行于大鼠身体纵轴,沿眼颞侧角膜缘穿刺进入前房,打开输液器开关,将输液瓶缓慢升高150 cm,用Tono-penXL眼压计测量眼压为110 mmHg(1 mmHg=0.133 kPa),此压力与大鼠体循环收缩压接近;维持此高眼压1 h后将输液瓶缓慢降低至与动物眼球高度平齐,拔出针头,恢复视网膜供血。术后眼表涂抹红霉素软膏1次。
1.2.2实验分组及处理 将60只实验大鼠按照随机数字表法随机分为正常对照组、模型组和牡荆苷组,每组20只,均以右眼为实验眼。取模型组和牡荆苷组大鼠按照1.2.1方法建立RIR模型。将牡荆苷标准品用N,N二甲基甲酰胺(N.N-dimethylformamide,DMF)生理盐水溶液(DMF∶ 生理盐水=1∶ 20)溶解配制成质量浓度为5.0 mg/ml的牡荆苷溶液。取牡荆苷组大鼠于造模后按照25 mg/kg剂量腹腔内注射牡荆苷溶液,每日注射1次,连续给药7 d[7]。取模型组大鼠腹腔内注射相同剂量的DMF生理盐水溶液。取正常对照组大鼠右眼行前房穿刺而不升高眼压,同时腹腔内注射相同剂量的DMF生理盐水溶液。
1.2.3视网膜组织病理学观察 造模后第7天,各组中任意选取5只大鼠,用质量分数10%的水合氯醛(400 mg/kg)腹腔内注射行全身麻醉,摘除实验眼并置于质量分数10%多聚甲醛溶液中固定24 h,去除眼前节组织及晶状体后,常规脱水、透明,石蜡包埋,行视网膜矢状面5 μm厚石蜡切片,常规苏木精-伊红染色,倒置显微镜下观察视网膜组织结构,采用图像分析系统采集图像,应用Image-Pro-Plus 6.0分析系统测定大鼠视网膜厚度。每组随机选取5只大鼠的切片观察RGCs形态和RGCs层至外核层视网膜厚度,每张切片随机选取5个视野,取平均值。
1.2.4逆行荧光金染色标记法检测视网膜RGCs密度 造模后第7天,各组中任意选取5只大鼠,将大鼠麻醉后剪开颞侧球结膜,剪断外直肌,充分暴露视神经,于球后2 mm处剪断视神经,将有荧光金染料的明胶海绵置于视神经断端。标记40 h后,用水合氯醛腹腔内注射处死大鼠,取出眼球,剥离视网膜,制备视网膜铺片,将视网膜进行4个象限的放射状切开,荧光倒置显微镜绿色光源下观察荧光金标记的RGCs并采集图像。用Image-Pro-Plus6.0分析系统计算RGCs密度(个/mm2)。每个视网膜标本选取中心1、2和3 mm处4个象限共12个200倍视野进行RGCs密度计算,取平均值。
1.2.5TUNEL染色法检测视网膜RGCs凋亡情况 取1.2.3部分制作的各组5只大鼠视网膜石蜡切片常规方法脱水,每张切片滴加50 μl体积分数3%过氧化物酶阻断剂,室温孵育10 min,去离子水冲洗3遍,蛋白酶K于湿盒中室温孵育30 min,磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗2次,每次3 min;滴加50 μl TUNEL反应液,湿盒中室温孵育1 h,PBS漂洗3次,每次3 min;滴加50 μl conberter-POD,湿盒中室温孵育1 h,PBS漂洗3次。每次3 min。滴加100 μl BAD溶液,室温孵育10 min,PBS漂洗3次,每次3 min,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。正常RGCs核染色呈蓝色,凋亡RGCs核染色呈棕黄色。于光学显微镜下观察并拍照,每张切片中任意选取5个200倍视野,应用Image-Pro-Plus6.0分析系统计数TUNEL阳性细胞和正常细胞,取平均值,计算RGCs凋亡率=TUNEL阳性细胞数/正常细胞数×100%。
1.2.6大鼠视网膜组织中SOD活性、MDA和NO浓度检测 于造模后第7天,各组中任意选取5只大鼠,过量麻醉法处死后,摘取实验眼并分离出视网膜组织。取视网膜组织,加入视网膜组织质量5~10倍体积提取液进行冰浴匀浆制成细胞悬液,离心半径为3 cm,3 000 r/min离心20 min,取上清液。(1)SOD活性测定 取3 μl视网膜组织上清液用PBS稀释至150 μl,参照SOD活性检测试剂盒说明书配制试剂,将试剂与待测样本混匀,37 ℃孵育20 min,BCA法测定蛋白质含量,应用酶标仪于589 nm波长处测吸光度(A)值,计算SOD活性(U/L,U为商品单位),SOD活性=[(A待测样本-A空白对照)×标准品浓度×24]/[(A标准品-A空白对照)×待测样本蛋白浓度×50]。(2)MDA摩尔浓度测定 取5 μl视网膜组织上清液用PBS稀释到10 μl,按照MDA试剂盒说明书配置试剂,将试剂与待测样本混匀,95 ℃水浴40 min,流水冷却,离心半径为3cm,3 000 r/min离心10 min取上清液,BCA法测定蛋白质含量,应用酶标仪于530 nm波长处检测A值,计算MDA摩尔浓度(μmol/L),MDA摩尔浓度=[(A待测样本-A空白对照)×标准品摩尔浓度×2]/[(A标准品-A空白对照)×待测样本蛋白浓度]。(3)NO摩尔浓度测定 取5μl视网膜组织上清液,按照NO试剂盒说明书配置试剂,将试剂与待测样本混匀,检测589 nm波长处A值,计算NO含量(μmoL/L),NO摩尔浓度=140×(A589+0.010 3)。
1.2.7Western blot法检测大鼠视网膜组织细胞质Nrf2、HO-1、NQO1以及细胞核Nrf2蛋白表达 取1.2.6部分收集的视网膜组织,用预冷去离子水冲洗,滤纸吸干水分,置于液氮中迅速冷冻,后转移至超低温冰箱冻存。取冻存的大鼠视网膜组织标本,加入5~10倍体积的提取液进行冰浴匀浆,10 000×g,4℃离心15 min,取上清,置冰上待测。3 000 r/min离心3 min(离心半径为3 cm),收集沉淀,加入200 μl蛋白抽提试剂,高速涡旋使细胞沉淀分散成单细胞悬液,3 000 r/min离心10 min(离心半径3 cm),上清液中即为细胞质蛋白,采用冻干仪对上清液蛋白进行浓缩,按照核蛋白提取试剂盒说明书步骤,加入200 μl核蛋白提取试剂,高速涡旋30 s,3 000 r/min离心10 min(离心半径为3 cm),上清液中即为核蛋白。BCA法测定蛋白浓度。取蛋白上清液进行聚丙烯酰胺凝胶电泳后,再电转移至PVDF膜上,用质量分数0.5%的脱脂乳粉PBS溶液室温封闭1 h,充分洗涤后分别加入Nrf2(1∶ 1 000)、HO-1(1∶ 1 000)、NQO1(1∶ 1 000)一抗4 ℃孵育过夜,PBS洗涤3次,每次3 min;加入相应二抗(1∶ 5 000)常温孵育30 min,ECL显色,细胞质蛋白以GAPDH为内参,细胞核蛋白以H3为内参,采用ImageJ软件分析各蛋白条带灰度,计算各目的蛋白相对表达量。每组实验独立重复3次。
1.3 统计学方法
采用SPSS 19.0统计学软件进行统计分析。计量资料经Shapiro-Wilk检验呈正态分布,以mean±SD表示,组间资料经Levene检验证实方差齐性。各组间不同指标总体差异比较采用单因素方差分析,多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠视网膜组织病理学表现
正常对照组大鼠视网膜组织中RGCs排列紧密,核边界清晰;模型组大鼠RGCs排列疏松不规则,部分细胞核出现溶解或破碎样;牡荆苷组大鼠视网膜中RGCs异常程度较模型组减轻(图1)。正常对照组、模型组和牡荆苷组视网膜厚度分别为(128.20±5.31)、(90.21±3.55)和(119.65±6.14)μm,各组视网膜厚度总体比较,差异有统计学意义(F=8.344,P=0.011);其中模型组大鼠视网膜厚度明显低于正常对照组和牡荆苷组,差异有统计学意义(P<0.05)。

图1 各组大鼠造模后7 d视网膜组织病理学表现(HE ×200,标尺=50 μm) 正常对照组大鼠视网膜组织中RGCs排列紧密,核边界清晰,模型组大鼠RGCs排列疏松不规则,部分细胞核出现溶解或破碎样,牡荆苷组大鼠视网膜中RGCs异常程度较模型组减轻A:正常对照组 B:模型组 C:牡荆苷组 GCL:神经节细胞层;IPL:内丛状层;INL:内核层;OPL:外网状层;ONL:外核层Figure 1 Histopathological manifestations of rat retina in each group at 7 days after modeling(HE ×200,scale bar=50 μm) RGCs in the normal control group were tightly arranged with clear nuclear boundaries,while the RGCs in the model group were arranged loosely and irregularly,and some of the nuclei were dissolved or broken,and the abnormality of RGCs in the vitexin group was alleviated A:normal control group B:model group C:vitexin group GCL:ganglion cell layer;IPL:inner plexiform layer;INL:inner nuclear layer;OPL:outer plexiform layer;ONL:outer nuclear layer
2.2 各组大鼠视网膜RGCs数量比较
视网膜逆行荧光金标记结果显示,在造模后7 d,正常对照组、模型组和牡荆苷组大鼠视网膜单位面积RGCs数量分别为(2 330.12±15.05)、(1 300.85±14.00)和(1 921.64±11.78)个/mm2,总体比较差异有统计学意义(F=21.034,P<0.001);模型组单位面积RGCs数量低于正常对照组和牡荆苷组,差异均有统计学意义(均P<0.05);牡荆苷组大鼠视网膜RGCs单位面积数量与正常对照组比较差异无统计学意义(P>0.05)(图2)。

图2 各组大鼠造模后7 d视网膜RGCs数量(荧光金 ×200,标尺=50 μm)A:正常对照组大鼠RGCs分布密集 B:模型组大鼠RGCs分布稀疏 C:牡荆苷组大鼠RGCs数量较模型组有所增加 D:各组大鼠RGCs数量量化比较 F=21.034,P<0.001.与正常对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验,n=5)1:正常对照组;2:模型组;3:牡荆苷组 RGCs:视网膜神经节细胞Figure 2 The number of RGCs in different groups at 7 days after modeling(Fluoro-Gold ×200,scale bar=50 μm)A:The distribution of RGCs in the retina of rats in the control group was dense B:The distribution of RGCs in the model group was sparse C:The number of RGCs was increased in the vitexin group in comparison with the model group D:Quantitative comparison of the number of RGCs among different groups F=21.034,P<0.001.Compared with the normal control group,aP<0.05;compared with the model group,bP<0.05 (One-way ANOVA,LSD-t test,n=5) 1:normal control group;2:model group;3:vitexin group RGCs:retinal ganlion cells
2.3 各组大鼠TUNEL阳性RGCs比率比较
造模后7 d,正常对照组大鼠视网膜组织TUNEL阳性细胞数量较少,模型组存在大量TUNEL阳性细胞,牡荆苷组TUNEL阳性细胞数较模型组有所减少。正常对照组、模型组和牡荆苷组TUNEL阳性RGCs比率分别为(3.01±0.18)%、(68.34±5.04)%和(35.51±2.04)%,总体比较差异有统计学意义(F=30.205,P<0.001)。模型组TUNEL阳性RGCs比率明显高于正常对照组和牡荆苷组,差异均有统计学意义(均P<0.05)(图3)。

图3 各组大鼠造模后7 d RGCs凋亡情况(TUNEL ×200,标尺=50 μm)A:正常对照组大鼠视网膜组织TUNEL阳性细胞(箭头)数量较少 B:模型组大鼠视网膜组织中存在大量TUNEL阳性细胞(箭头) C:牡荆苷组大鼠视网膜组织TUNEL阳性细胞(箭头)数量较模型组有所减少 D:各组大鼠RGCs凋亡率量化比较 F=30.205,P<0.001.与正常对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验,n=5)1:正常对照组;2:模型组;3:牡荆苷组 RGCs:视网膜神经节细胞Figure 3 The TUNEL positive RGCs among different groups at 7 days after modeling(TUNEL ×200,scale bar=50 μm)A:The number of TUNEL positive cells (arrow) in retina of the control group was small B:The number of TUNEL positive cells (arrow) in the retina of model group was large C:The number of TUNEL positive cells (arrow) in the vitexin group was smaller than that in the model group D:Quantitative comparison of rat RGCs apoptosis rate among different groups F=30.205,P<0.001.Compared with the normal control group,aP<0.05;compared with the model group,bP<0.05(One-way ANOVA,LSD-t test,n=5) 1:normal control group;2:model group;3:vitexin group RGCs:retinal ganglion cells
2.4 各组大鼠视网膜组织中氧化应激反应指标表达比较
造模后7 d,正常对照组、模型组和牡荆苷组大鼠视网膜中SOD活性及MDA、NO摩尔浓度总体比较差异均有统计学意义(F=11.054、5.347、15.021,均P<0.001)。模型组大鼠视网膜组织中SOD活性低于正常对照组和牡荆苷组,MDA和NO摩尔浓度高于正常对照组和牡荆苷组,差异均有统计学意义(均P<0.05)(表1)。

表1 各组大鼠视网膜SOD活性、MDA和NO浓度比较(mean±SD)Table 1 Comparison of SOD activity,MDA and NO concentration among different groups (mean±SD)组别样本量SOD活性(U/L)MDA浓度(μmol/L)NO浓度(μmol/L)正常对照组5152.35±13.245.11±0.5414.34±1.61模型组5106.44±11.32a8.69±0.76a35.68±1.95a牡荆苷组5133.25±10.36ab6.08±0.52ab18.36±1.02abF值11.0545.34715.021P值<0.001<0.001<0.001 注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验) SOD:超氧化物歧化酶;MDA:丙二醛;NO:一氧化氮 Note:Compared with the normal control group,aP<0.05;compared with the model group,bP<0.05(One-way ANOVA,LSD-t test) SOD:su-peroxide dismutase;MDA:malondialdehyde;NO:nitric oxide
2.5 各组大鼠视网膜组织中Nrf2信号通路相关蛋白表达比较
造模后7 d,正常对照组大鼠视网膜组织细胞质Nrf2蛋白条带灰度在3个组中最强,HO-1、NQO1和细胞核Nrf2蛋白条带灰度在3个组中最弱;牡荆苷组细胞质Nrf2蛋白条带灰度在3个组中最弱,HO-1、NQO1和细胞核Nrf2蛋白条带灰度在3个组中最强。正常对照组、模型组和牡荆苷组大鼠视网膜中细胞质Nrf2、HO-1、NQO1和细胞核Nrf2蛋白相对表达量总体比较差异均有统计学意义(F=8.579、6.347、10.523、12.021,均P<0.001)。模型组大鼠视网膜组织中细胞质Nrf2蛋白相对表达量明显低于正常对照组,HO-1、NQO1和细胞核Nrf2蛋白相对表达量高于正常对照组,差异均有统计学意义(均P<0.05);牡荆苷组大鼠视网膜组织中细胞质Nrf2蛋白相对表达量明显低于模型组和正常对照组,HO-1、NQO1和细胞核Nrf2蛋白相对表达量明显高于模型组和正常对照组,差异均有统计学意义(均P<0.05)(图4,表2)。

图4 Western blot检测各组大鼠视网膜细胞质Nrf2、HO-1、NQO1及细胞核Nrf2蛋白表达1:正常对照组;2:模型组;3:牡荆苷组 Nrf2:核因子E2相关因子2;HO-1:血红素加氧酶-1;NQO1:醌氧化还原酶1;GAPDH:甘油醛-3-磷酸脱氢酶Figure 4 The expression of cytoplasm Nrf2,HO-1,NQO1 and nucleus Nrf2 protein in the retina of rats in three groups by Western blot1:normal control group;2:model group;3:vitexin group Nrf2:nuclear factor E2-related factor 2;HO-1:heme oxygenase-1;NQO1:quinone oxidoreductase 1;GAPDH:glyceraldehyde-3-phosphate dehydrogenase
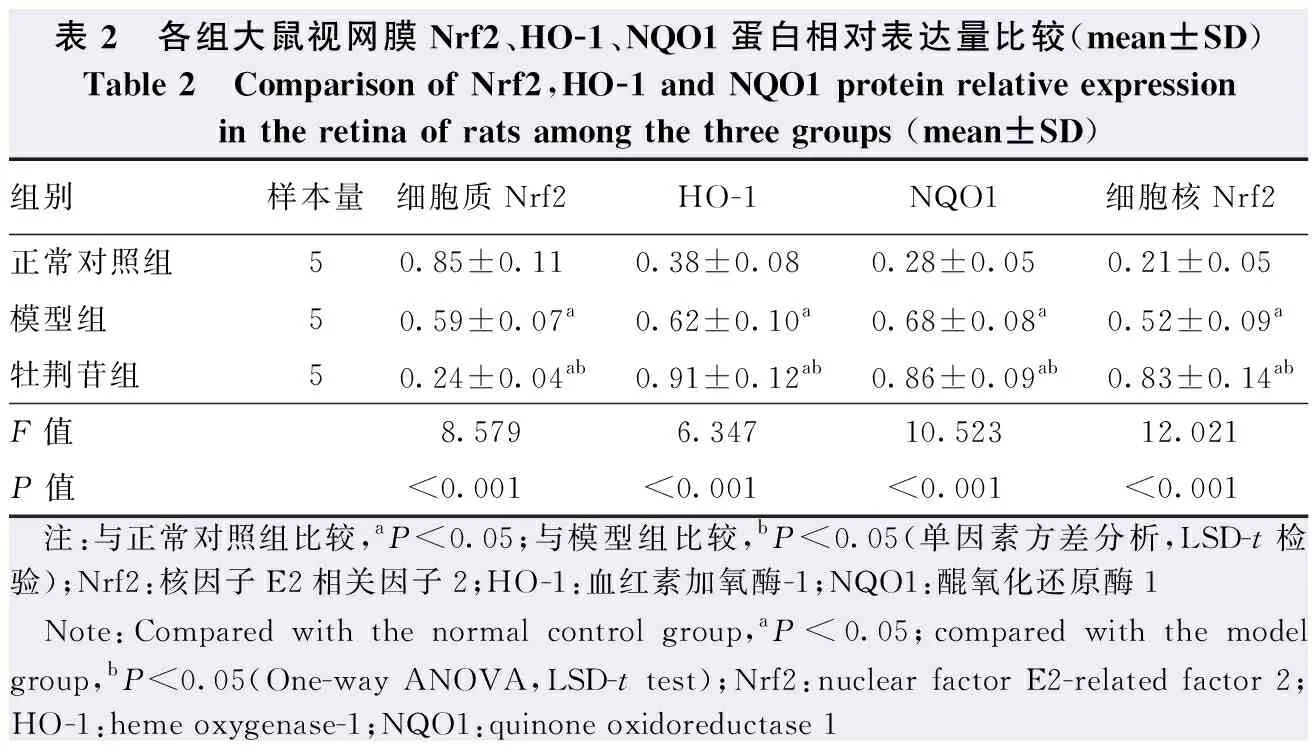
表2 各组大鼠视网膜Nrf2、HO-1、NQO1蛋白相对表达量比较(mean±SD)Table 2 Comparison of Nrf2,HO-1 and NQO1 protein relative expression in the retina of rats among the three groups (mean±SD)组别样本量细胞质Nrf2HO-1NQO1细胞核Nrf2正常对照组50.85±0.110.38±0.080.28±0.050.21±0.05模型组50.59±0.07a0.62±0.10a0.68±0.08a0.52±0.09a牡荆苷组50.24±0.04ab0.91±0.12ab0.86±0.09ab0.83±0.14abF值8.5796.34710.52312.021P值<0.001<0.001<0.001<0.001 注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05(单因素方差分析,LSD-t检验);Nrf2:核因子E2相关因子2;HO-1:血红素加氧酶-1;NQO1:醌氧化还原酶1 Note:Compared with the normal control group,aP<0.05;compared with the model group,bP<0.05 (One-way ANOVA,LSD-t test);Nrf2:nuclear factor E2-related factor 2;HO-1:heme oxygenase-1;NQO1:quinone oxidoreductase 1
3 讨论
视网膜是一种高度分化的神经组织,其内层组织供血来自视网膜中央动脉,对缺氧、缺血非常敏感。视网膜富含不饱和脂肪酸,易受自由基攻击,当视网膜缺血时,氧自由基大量积聚,过量的自由基使组织内不饱和脂肪酸过氧化,形成脂质过氧化产物,继而破坏线粒体功能,导致RGCs的变性和凋亡,损害视网膜组织结构和功能[8-9]。SOD是机体抗氧化防御体系中最重要的自由基清除酶之一,可缓解机体氧化应激损伤[10]。MDA作为自由基与不饱和脂肪酸发生脂质过氧化时的主要代谢产物,其浓度反映了机体遭受自由基攻击的严重程度[11]。NO是精氨酸在一氧化氮合酶催化下生成的内源性产物,过量的NO和组织中超氧化阴离子反应,生成氧化能力强的ONOO-,进而损伤DNA,诱导RGCs凋亡[12]。本研究应用前房灌注方法建立大鼠RIR动物模型,模型组大鼠视网膜内层厚度和RGCs数量较正常对照组减少,RGCs凋亡率增加,SOD活性下降,MDA和NO浓度较正常对照组增加,说明大鼠RIR动物模型建立成功。
牡荆苷属于黄酮类化合物,是金莲花、红草等的主要药效成分,其在多种情况下对氧化应激损伤有调控作用。刘磊等[6]研究证实,牡荆苷可减轻急性脑缺血-再灌注大鼠氧化应激反应造成的脑组织损伤;Nurdiana等[13]报道,牡荆苷可缓解糖尿病大鼠脑组织的氧化应激损伤;Xie等[14]报道,牡荆苷能减轻骨关节炎大鼠内质网应激引发的软骨细胞凋亡和相关炎症,并抑制软骨变性。然而牡荆苷是否对RIR具有调控作用,目前报道较少。本研究采用腹腔内注射牡荆苷治疗RIR模型大鼠,结果显示,牡荆苷能显著改善模型大鼠视网膜厚度,减少RGCs凋亡,恢复RGCs数量,同时,牡荆苷能上调大鼠视网膜组织内SOD活性,降低MDA和NO浓度,提示牡荆苷能缓解RIR引起的RGCs损伤,这种作用可能是通过上调视网膜组织抗氧化应激能力而实现的。
为了进一步探讨牡荆苷缓解RIR氧化应激损伤的作用机制,本研究检测了其对视网膜组织中Nrf2信号通路活性的影响。Nrf2是一种与细胞自我保护相关的转录因子,其介导的信号转导通路在抗氧化应激过程中发挥重要作用。在应激情况下,Nrf2位于细胞质内,与Keap1结合,并介导Nrf2的快速泛素化和随后的降解;在细胞受到ROS攻击后,Nrf2被解偶联而转位至细胞核,与ARE结合,启动下游抗氧化相关基因HO-1、NQO1等的转录,最终起到抗氧化应激损伤的作用[15-16]。Hui等[17]报道,Keap1-Nrf2小分子抑制剂能激活视网膜中Nrf2,对视网膜缺血性损伤有保护作用;Xu等[18]研究证实Nrf2激活剂对RIR视神经损伤有保护作用。已有研究证实牡荆苷对氧化应激条件下Nrf2通路有调控作用。Lu等[19]发现,牡荆苷能通过控制Nrf2通路减轻脂多糖诱导的急性肺损伤;刘磊等[6]证实牡荆苷对急性脑缺血-再灌注大鼠氧化应激反应的减轻作用与Nrf2信号通路调控有关。本研究结果显示,模型组大鼠视网膜组织中细胞质Nrf2蛋白表达低于正常对照组,而细胞核Nrf2表达高于正常对照组,下游HO-1和NQO1蛋白表达也高于正常对照组,说明在RIR条件下,视网膜组织中Nrf2通路活化,抗氧化应激系统启动;同时,牡荆苷组大鼠视网膜组织细胞核Nrf2表达及其下游HO-1和NQO1蛋白表达较模型组进一步增加,而细胞质Nrf2表达较模型组进一步降低,提示牡荆苷能活化Nrf2信号通路,从而增加机体抗氧化应激损伤的能力。本研究存在一些不足,如采用视网膜组织染色切片的方法来测量视网膜厚度,未严格固定测量部位,测量准确度不高,后续研究中将采用OCT仪器对固定部位进行视网膜厚度测量。
综上所述,牡荆苷能缓解RIR模型大鼠RGCs损伤,降低RGCs凋亡率,这一作用可能是通过激活Nrf2相关通路,提高视网膜组织抗氧化应激活性而实现的。
利益冲突所有作者均声明不存在利益冲突

