家蚕滞育关联基因的研究进展
陈艳荣 朱 娟 沈兴家
(1黄山学院,生命与环境科学学院,安徽黄山 245041; 2江苏科技大学生物技术学院,江苏省蚕桑生物学与生物技术重点实验室,江苏镇江 212018; 3中国农业科学院蚕业研究所,农业农村部蚕桑遗传改良重点实验室,江苏镇江 212018)
滞育作为昆虫特殊的复杂生理状态,昆虫滞育时体内各类物质的代谢变化,本质上是基因的表达与变化。家蚕(Bombyxmori)是典型的卵滞育昆虫,其滞育性的研究己有近百年的历史,家蚕二化性品种是研究昆虫卵滞育控制机制的理想模式系统[1]。母体在特定发育阶段接受了不同外界环境信号的刺激,通过体内激素的变化,诱导一系列代谢途径的发生,引起卵内的细胞质组成(卵黄成分、卵黄量、激素、mRNA积累量及酶系统等)发生变化,母体生理代谢差异造成了子代滞育特性的差异,这种差异以卵母细胞“捆绑午餐(binding lunch)”的形式将环境信息传递给子代,决定后代滞育的发生[2]。实际上是昆虫体内基因表达水平的变化决定了这些生理学的变化[3]。
滞育关联基因主要包括滞育各阶段相关的差异表达基因或滞育相关蛋白编码基因,特别是滞育过程中能量、激素、呼吸等相关代谢通路中的特异表达基因[4-6]。滞育关联基因涉及范围较广,有些基因即使没有直接参与滞育进程,也可能间接参与滞育发育调控,基因间相互作用极其复杂[7];目前被证明参与了家蚕滞育的基因仍然较少。本文对家蚕滞育关联基因的功能研究进展进行概述,以期为家蚕滞育机制研究提供思路和参考。
1 家蚕滞育关联基因的种类
按照基因功能可将家蚕滞育调控网络内的关联基因分为三大类:生物钟相关基因、内分泌相关基因和滞育相关基因,三者间有复杂的交叉关系,可能涉及到多个基因的重叠。
1.1 生物钟相关基因
生物钟相关基因可分为核心钟基因、钟控基因和钟相关基因[8]。黑腹果蝇是研究昼夜生物钟的重要模式生物。目前己确认的主要生物钟基因有period(per)、timeless(tim)、clock(clk)及cycle(cyc)、cryptochrome(cry)和环腺苷酸反应元件结合蛋白编码基因(cAMP response element binding protein,creb)等。
1.1.1per生物钟相关基因中第1个被鉴定和克隆出的是per,长13 000 bp,CDS编码1 218个氨基酸,有pers、per01和perL1等3个复等位基因。昼夜节律和超日节律都被per的表达所影响,翻译产物为PER蛋白,它与另一种生物钟蛋白TIM结合形成异源二聚体,作为负调节因子参与生物钟的反馈环路[9]。徐丽等[10]认为家蚕per表达水平与温度和光照对滞育的诱导作用一致,该结果暗示在一个完整世代中,家蚕per的表达水平与诱导后代滞育变化的温度及光照直接相关。
1.1.2tim第2个被确证的生物钟相关基因是果蝇tim。per被发现10年之后,tim的第1个突变体tim0被鉴定,它使果蝇蛹期羽化和活动节律发生异常。BENNA在果蝇中发现2种类型的tim基因,彼此的序列保守性很低,相应的编码蛋白也高度可变[11]。PER蛋白与TIM蛋白结合生成异源二聚体,在生物钟负反馈回路中起重要作用。宋艳[12]认为家蚕诱导滞育的温度和光照的变化,能够直接影响per和tim的表达,她推测per和tim在家蚕滞育诱导影响的基因调控网络中有重要作用。
1.1.3clk与cycCLK最初是从小鼠中分离出来的生物钟转录因子,由clk编码。蛋白结构含有PAS-bhlh(basic helix-loop-helix)结构域,C-末端富含谷氨酰胺Q,该结构域起转录激活作用[13]。果蝇的CLK与CYC通常结合生成异源二聚体,并与per和tim启动子的E-box结合,这种结合能够激活它们的表达,PER和TIM与隐色素(CRY)相互作用,引起相应生物学效应[8]。
1.1.4cryCRY是一种黄素光感受体,对蓝光高度敏感,由cry编码,首先在拟南芥中分离鉴定。作为生物钟的一部分,CRY参与调节动物的日常生理和行为节律,并作为光感受器调节生物钟的指导过程[14]。研究表明,CRY受到光信号刺激后,发生光化学变化,直接与TIM在细胞质、细胞核中发生光依赖性结合,导致PER/TIM复合物失活,终止其在反馈环中的作用[15];朱晓苏等[16]克隆了家蚕2个同源基因Bm-cry1和Bm-cry2的完整开放阅读框,对其蛋白质进行了结构分析和分子进化分析,发现Bm-cry1在不同物种中的保守区几乎覆盖了整个蛋白序列,Bm-cry2的N端保守性较高,C端保守性较低,具有DNA光解酶结合区2个保守的结构域。
1.1.5creb家蚕creb包括至少11个外显子,基因全长约为40 kb,编码的CREB蛋白分子量大约为43 kD,是真核细胞核内转录因子亮氨酸拉链家族中的一员,其分子结构分2个区域,C端区为天冬氨酸,是与启动子结合的部位;N端区为蛋氨酸,与调节转录有关,包含碱性区和亮氨酸拉链模体,合称为bZIP结构[17]。不同细胞中胞外信号能通过多条信号通路,将信号传递给CREB蛋白,并通过蛋白激酶使CREB蛋白磷酸化,调节下游基因表达[18]。
环境诱导家蚕滞育受中枢神经系统的调控,关键期是家蚕胚胎发育的中后期,这些环境信号通过脑接收并记忆保持。有研究表明,家蚕creb在胚胎和蛹脑中的表达量环境诱导滞育性高于非滞育性[19]。张玉等[20]以二化性家蚕为研究对象,对家蚕CREB的表达与环境诱导滞育的关系进行了研究,结果表明家蚕胚胎发育的反转期到催青期表达量逐渐增加,而高温/光照比低温/黑暗环境下表达量高,该结果暗示CREB可能参与环境信号的接收与记忆的调控。
1.2 内分泌相关基因
1.2.1 促前胸腺激素基因(Prothoracicotropic hormone,ptth) PTTH是在家蚕脑外侧神经分泌细胞产生的,经脑—心侧体—咽侧体神经轴索贮存在咽侧体内,然后释放到血淋巴。血淋巴中的促前胸腺激素作用于前胸腺细胞,刺激蜕皮激素(molting hormone,MH)的分泌,调节昆虫的发育。PTTH的释放发生在特定时期,如4龄期最后一次蜕皮,一批调节因子被调动,化学信息被传到脑部神经细胞,激活PTTH的合成并释放到咽侧体[21]。1990年KAWAKAMI等[22]首次克隆到家蚕ptth的全长基因序列,其cDNA编码的蛋白前体包括信号肽、中间肽和PTTH分子,通过切割蛋白水解位点,释放出成熟的PTTH分子;家蚕ptth包括5个外显子和4个内含子,其成熟肽由第3、4、5外显子及第2外显子的一部分组成。
1.2.2 羽化激素基因(Eclosion homone,eh) EH是一种神经肽,包括62个氨基酸,最早从家蚕和烟草天蛾的头部分离而来。体外实验发现它可以触发昆虫成虫蜕皮,所以称为羽化激素[23]。家蚕eh在蛹脑中的二对腹中央v型神经分泌细胞中进行表达,为单拷贝编码mRNA。家蚕的EH蛋白和烟草天蛾的EH蛋白有29%的异源性,每条肽链在其保守位点都含有6个半胱氨酸,并在分子中形成3个二硫键,二硫键对于维持EH蛋白的高级结构和生物活性至关重要,如果它被打断可能使EH完全失活。家蚕和烟草天蛾的EH已确定了这3个二硫键的位点;在肽链N端有1个疏水性的信号肽,用于将EH引导至分泌途径[24]。
1.2.3 滞育激素-性信息素合成激活肽基因(Diapause hormone-pheromone biosynthesis activating neuropeptide,dh-pban) 鳞翅目昆虫dh-pban编码5个神经肽,分别是滞育激素(DH)、性信息素合成激活肽(PBAN)、α-咽下神经节肽(α-SGNP)、β-咽下神经节肽(β-SGNP)、γ-咽下神经节肽(γ-SGNP);这5个神经肽都有共同的苯丙氨酸-X-脯氨酸-精氨酸/赖氨酸-亮氨酸(X为甘氨酸、苏氨酸和丝氨酸)[FXPR/KL(X=G,T,S)]酰胺化的C末端。dh-pban基因主要在咽下神经节中表达,PBAN在鳞翅目昆虫中起到促进性信息素合成的作用[25]。昆虫的大多数激素一个前体会产生一个终产物,而像家蚕dh-pban同时编码并产生DH、PBAN和SGNP等5个产物的现象不多见。
1.2.4 垂体同源框激素基因(Pituitary homeobox,pitx) PITX属于Bicoid家族的转录因子,包含同型盒结构域和OAR (otpa ristaless and rax)结构域,在昆虫生长发育过程中发挥着重要作用。家蚕各种组织中都有pitx的表达,比如咽下神经节和滞育激素神经内分泌细胞。一般作为同源异型转录因子,与相应的调控元件结合并激活dh-pban的表达[26]。
1.3 滞育相关基因
滞育诱导后导致一些特异性基因在滞育准备期表达,神经内分泌和代谢过程出现变化,例如大量合成海藻糖、山梨醇在体液内积累,这些物质既是能源物质,又是很好的抗冻剂,能降低过冷却点,为启动滞育做准备。
1.3.1 滞育激素基因((Diapause hormone,dh) 家蚕DH是由dh-pban编码,它同时还编码PBAN和3个食道下神经肽,这是在家蚕中首次发现1个基因可以编码多个功能蛋白。SATO等[27]克隆了该编码基因,全长6 kb,包含5个内含子和6个外显子;表达调控时,先转录形成1个0.8 kb的前体mRNA,再翻译形成1个C末端包含FXPR/KL结构的酰胺神经多肽前体,经蛋白水解酶作用释放出DH及其它神经肽;dh表达有温度控制和发育时期依赖2种类型,家蚕dh的表达依赖于催青温度的诱导,最终影响家蚕子代滞育性。
家蚕DH最特殊的功能就是调节卵是否滞育。DH能增强卵巢膜的通透性,促进羟基犬尿氨酸从血淋巴转运到卵巢中,导致卵巢内积累大量的羟基犬尿氨酸,被转运至滞育卵内在浆膜上形成眼色素,使卵色加深。家蚕DH还能增强体内海藻糖酶的活性,促使卵巢中糖原的积累而消耗脂肪体中的糖原储备[28]。家蚕中酯酶促进卵黄细胞发生溶胞,使胚胎继续发育,而DH能够抑制酯酶活性,进而阻断胚胎发育。另外,DH能够导致家蚕卵巢中的环磷酸腺苷(cAMP)增加和环磷酸鸟苷(cGMP)减少[29]。
1.3.2 滞育激素受体基因(Diapause hormone receptor,dhr) 家蚕dhr编码436个氨基酸,属于一种G蛋白偶联受体,含7个跨膜结构域。低温催青的二化性家蚕的dhr在蛹期大量表达。它特异性识别DH,能识别胞外的化学信号并通过与其偶联的G蛋白将信号在细胞内进行传递,通过钙离子和蛋白激酶C参与激活下游滞育信号[30-31]。王力刚[32]克隆了家蚕dhr的5种cDNA,证明它们由相同的mRNA转录本通过不同的剪接方式而来,该基因主要在卵巢和血液中表达。
1.3.3 海藻糖酶基因(Trehalase, treh)treh有treh1、treh2等2类,前者表达可溶性海藻糖酶,后者表达膜结合型海藻糖酶(有跨膜结构);TREH1相对分子量为66.6 kD, TREH2为73.5 kD。2种蛋白都具有PGGRFREFYYWDSY和QWDYPNAWPP等2个“标签结构”。可溶性海藻糖酶主要是用来分解细胞内的海藻糖[33];膜结合型海藻糖酶主要是水解食物中的海藻糖,为肌肉运动和取食时的中肠运动供给能量。TREH2的活性增强能够促进滞育激素诱导卵巢产生滞育卵[34]。
二化性家蚕在滞育诱导阶段将感受的环境信号转换为体内相应信号,体内信号再通过整个幼虫期传递到蛹期,在蛹期此信号作用于咽下神经节(SG),促使其大量分泌DH。在滞育决定阶段,通过血液将DH运送到卵巢,与卵母细胞膜上的DHR结合,启动一系列基因的表达,通过鸟苷酸环化酶使cGMP合成受阻,激活海藻糖酶基因表达,合成大量海藻糖酶,增强血液海藻糖的分解反应,生成的大量葡萄糖穿过细胞质膜进入卵母细胞,在卵母细胞中合成糖原,导致滞育卵中糖原的大量积累[35]。
1.3.4 糖原磷酸化酶基因(Glycogen phosphorylase,gpase) GPASE是糖原降解中的关键酶,它的主要功能是催化糖原降解为葡萄糖-1-磷酸,继而转化成葡萄糖-6-磷酸,参与其他大分子的合成。gpase有3种,分别编码M型、L型和B型3种不同的GPASE,彼此互为异构体,可以形成异源二聚体,成熟的GPASE是由2个相同亚基组成的二聚体[36];GPASE的每条多肽链都存在1个氨基末端结构域和1个羧基末端结构域,2个结构域之间形成一条较深的裂缝,裂缝中具有GPASE的作用位点[37]。1938年Gerty发现GPASE有A型和B型2种类型,B型几乎没有催化活性,A型的Ser14被磷酸化而具有活性,脱磷酸化后成为B型(无活性)[38]。
滞育早期卵内的糖原在GPASE的催化下分解,并逐步转化成山梨醇、甘油等物质。滞育启动、维持和结束与糖原山梨醇间的相互转化有着密切的关系,而糖原转化为山梨醇的关键酶是GPASE;在滞育卵中,前3 d GPASE的表达很明显。滞育卵和非滞育卵的糖原变化水平存在着明显差异,GPASE的活性与糖原水平相关[39-40]。
1.3.5 谷氨酰半胱氨酸连接酶基因(Glutamate cysteine ligase,gcl)、谷胱甘肽合成酶基因(Glutathione synthetase,gs) 谷胱甘肽是细胞内重要的小分子抗氧化物质,还原型谷胱甘肽(glutathione,GSH)与氧化型谷胱甘肽(glutathione oxidized,GSSG)的比值反映了细胞的氧化胁迫状况。高GSH/GSSG说明细胞处于还原状态,低GSH/GSSG说明细胞为过氧化状态[41]。GSH是通过2个依赖ATP提供能量的反应,由GCL和GS分2步依次催化合成;GCL是合成第一步酶促反应的催化酶和限速酶,催化谷氨酸和半胱氨酸合成γ-谷氨酰半胱氨酸,GS则负责第二步在谷氨酰半胱氨酸端的羧基与甘氨酸的氨基之间形成肽键,最终得到谷胱甘肽;谷胱甘肽S-转移酶可以催化GSH与亲核物质结合[42]。此外,硫氧还蛋白过氧化物酶(thioredoxin peroxidase,TPX)负责催化GSH被H2O2氧化为GSSG。滞育发动后,卵耗氧率急剧升高,同时大量糖原转化为山梨醇并在卵内积累,卵内为还原性的环境,存在低水平的总谷胱甘肽含量和GSSG及高水平的GSH/GSSG比值,暗示gcl和gs在滞育发动期间的活性增强而gst和tpx则表达抑制[43]。
1.3.6 过氧化氢酶基因(Catalase,cat) 滞育发动期间H2O2的水平依赖于2个方面,一是滞育性蚕卵的呼吸作用,二是CAT对H2O2的清除情况。CAT活性在滞育发动期间迅速升高,有利于清除胚胎内的H2O2,维持H2O2低水平[44]。韩武梅[45]研究了滞育起始时期的cat表达水平,结果表明,高温明催青蚕卵中的catmRNA水平显著高于低温暗催青的catmRNA水平,且在胚胎发育的第21阶段出现峰值,表明高温明催青促进了catmRNA的表达。
1.3.7 山梨醇脱氢酶基因(Sorbitol dehydrogenase,sdh) 在滞育维持期间,家蚕的呼吸量会显著下降,每克卵每小时的耗氧量约10 μL,这是一种“假死”状态。家蚕卵中大量积累的糖原几乎都转换为山梨醇并高浓度地积累。由于山梨醇具有良好的水溶性,因此胚胎细胞和卵黄细胞中的水与游离水结合,致使游离水缺乏,最终导致家蚕所有的活性功能停滞[46]。
SDH是调节山梨醇代谢的关键酶,催化山梨醇脱氢转化为糖原。研究显示,家蚕在滞育过程中sdh基因的转录受到抑制,糖原大量转化为山梨醇,并在滞育卵中积累起来。此过程也与滞育卵中糖原磷酸化a酶活性迅速增加及糖原合酶激酶3β磷酸化水平急剧下降和甘油激酶基因不表达密切相关[47-48]。5 ℃低温冷藏滞育卵(60 d以上)或者短期冷藏后浸酸,能够打破这种抑制,使sdh基因表达,催化山梨醇转化为果糖,解除滞育维持[49]。
1.3.8 脂酶4基因(Esterase,ea4) 家蚕滞育生物钟是一种倒计时型生物钟,EA4是生物钟蛋白质,一种时间间隔测定酶(TIME-EA4)。ea4 cDNA全长605 bp,开放阅读框(ORF)长519 bp,其中第1~48个碱基编码信号肽,至少有4个外显子和3个内含子;促使蚕卵活化所需要的低温时间或盐酸刺激量是家蚕滞育生物钟的计时内容[50-51]。EA4是具有测定5 ℃低温经过时间,即具有测定蚕卵活化所需低温时间(滞育发育时间)功能的酶蛋白,其酶活性峰的出现是依靠EA4蛋白的二级和三级结构的改变感受低温时间变化,出现瞬时ATPase活性,启动家蚕滞育卵活化进程。小分子多肽PIN是EA4活性的抑制物质。PIN与EA4结合,EA4的生物计时作用停止,维持滞育;PIN从EA4脱落,TIME-EA4的生物测时作用启动,进行零点设定,滞育卵开始活化[52]。
家蚕滞育的发生,是生物钟相关基因、内分泌相关基因及滞育相关基因之间的复杂作用的结果(图1)。研究滞育蚕卵活化环境、神经内分泌调节和sod、cat、sdh等滞育基因的互作关系可能是阐明家蚕滞育分子机制、构建家蚕滞育基因网络骨架的一个有效切入点[53]。滞育相关基因往往和内分泌、代谢相关基因交叉调控,比如外界环境信号化为化学信号保留至蛹期,再调控滞育相关基因表达,基因互作网络成员众多,关系复杂,涉及信号通路范围较广,研究困难。随着高通量测序技术和组学的发展,一次性获得大量的序列信息成为可能,为研究该时期基因关系提供了技术支持。

图1 家蚕滞育的基因调控网络
2 滞育关联基因涉及的信号通路
2.1 G蛋白偶联受体(G Protein-coupled receptors,GPCRs)
G蛋白具有GTP酶的特性,G蛋白偶联型受体与G蛋白偶联后产生胞内信使如cAMP、cGMP等,将信号传导至胞内。GPCRs可感知化学信息,是外界环境与神经系统的第一接口[54]。滞育也是通过GPCRs起始的,1 000个以上GPCRs同时受到滞育信息素刺激,相互聚集活化,产生活性因子,继而产生一系列的级联式反应诱导滞育的产生。其下游的偶联反应包括cGMP信号通路、TGF-β(transforming growth factor-β)信号通路和胰岛素/胰岛素样生长因子1(insulin/ insulin-like growth factor-1,IIS)信号通路[55]。家蚕卵巢中克隆出家蚕滞育激素受体基因dhr, ORF长1 311 bp,编码436个氨基酸,就属于一种GPCR,家蚕血淋巴中的DH首先需与家蚕卵巢膜上的DHR结合,才能进入家蚕卵巢内[56]。
2.2 cGMP信号通路
cGMP是GPCRs活化信号的下游直接接受者,对感觉神经传导非常关键。其主要成员包括跨膜蛋白鸟苷酸环化酶DAF-11,cGMP门控离子通道蛋白TAX-2和TAX-4。cGMP途径位于类胰岛素信号途径和TGF-β信号途径的上游(图2)。研充表明,DAF-11特异性地在化感器ASI、ASJ和ASK上表达,cGMP浓度与滞育呈正相关,即cGMP低浓度时虫体进行正常的生长发育,高浓度时虫体进入滞育状态[57-58]。家蚕中DH与卵母细胞上的特异受体结合,使鸟苷酸环化酶活性下降,进而使cGMP的合成受到抑制,结果细胞内cGMP的浓度下降导致膜上海藻糖酶的活性提高,酶分解血液海藻糖成葡萄糖的反应加快,更多的葡萄糖通过膜进入卵母细胞,在卵母细胞中合成糖原[59]。
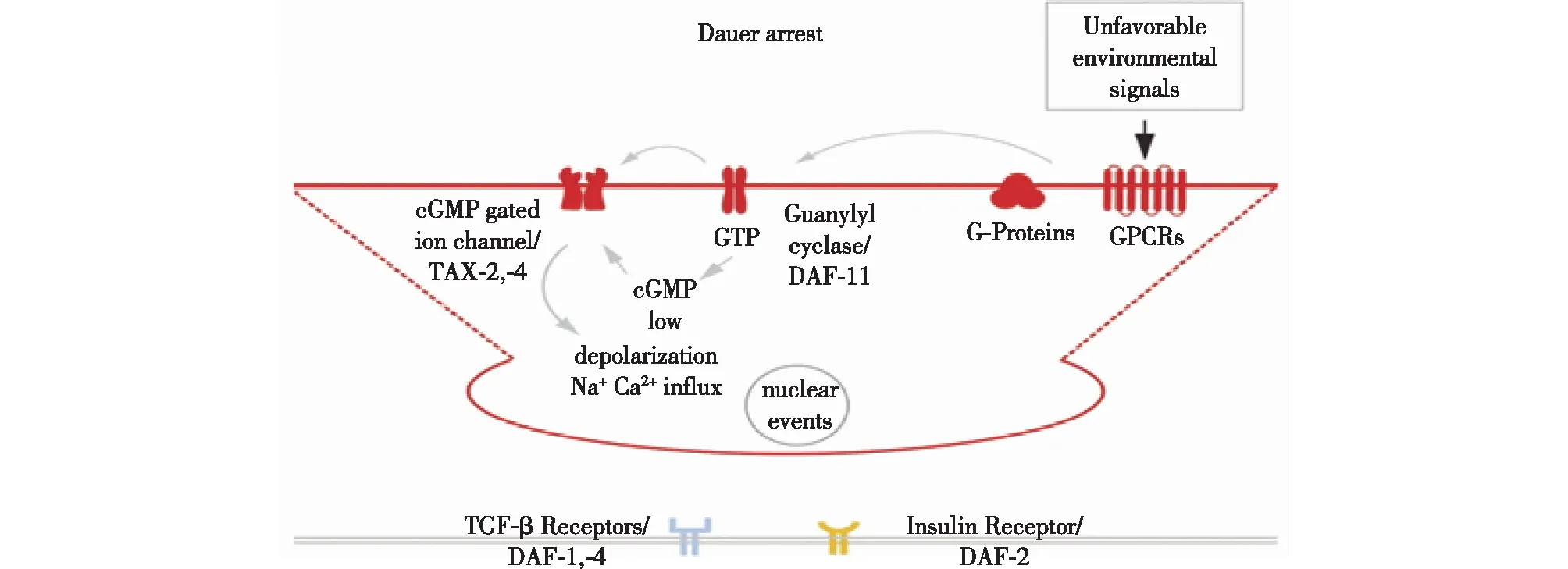
图2 GPCR与cGMP信号通路[56]
2.3 TGF-β信号通路
TGF-β通路中的主要成员包括DAF-7、TGF-β受体(I型和II型)、核受体DAF-3、DAF-8和DAF-14及转录因子DAF-5[60]。作用机理大致如下:在适当的条件下,DAF-7/TGF-β浓度升高,与活化的DAF-1和DAF-4受体结合,DAF-8、DAF-14被受体复合物磷酸化,导致核激活,抵抗复合物DAF-3/SMAD、DAF-5/SNOSKI的作用,抑制DAF-5的功能,导致初始下游基因的转录翻译被阻止,促进能量利用、虫体正常代谢及生长发育。当DAF-7浓度降低或缺乏时,DAF-3/DAF-5启动下游基因的表达,虫体储存能量,减少食物摄取,进入滞育状态(图3)[55,61]。TGF-β信号通路通过控制细胞的大小和细胞的数目来调节家蚕的组织器官形成和早期胚胎发育。家蚕在卵滞育诱导阶段,相关因子会大量表达抑制TGF-β信号通路成员的基因转录,从而阻断信号转导通路,协助滞育卵逐渐停止发育,诱导滞育启动[62]。

图3 TGF-β信号通路[55]
2.4 IIS信号通路
IIS信号通路参与滞育形成。在线虫中,胰岛素受体同系物DAF-2、PI3-激酶/AGE-1的减少都可导致虫体寿命延长1~2倍[63]。其简单的作用模型如下:在适宜的条件下,分泌的IIS与相应的受体DAF-2结合,以此激活AGE-1/PI3K激酶,PIP2在活化的AGE-1作用下产生PIP3;PIP3激活激酶PDK、AKT1和AKT2,活化的激酶促使DAF-16/FOXO被SGK磷酸化,进而使得DAF-16/FOXO被转运至细胞质,与FTT-2/14-3-3蛋白结合保留在细胞质内,最终激活下游众多基因的转录,虫体正常发育;环境不利时,IIS不被激活,DAF-16/FOXO保留在细胞核内,启动抵抗应激及滞育形成相关基因,虫体进入滞育状态(图4)[55,64]。IIS信号通路对昆虫的能量代谢,特别是糖类代谢至关重要。家蚕滞育卵在启动滞育后,卵内胰岛素、类胰岛素因子及中间调节因子PIP3的基因转录都被下调,IIS信号通路被抑制,能量代谢被降低;下游因子FOXO则表达上调,启动一系列细胞和生理过程维持滞育[65]。

图4 IIS信号通路[55]
3 滞育关联基因的研究热点
3.1 利用组学技术挖掘滞育关联基因
滞育过程具有复杂性和整体性,单一针对某些基因的研究难以系统全面地解析昆虫滞育发生发展的复杂机制。随着生物技术的发展,以昆虫整个基因组、转录组或蛋白组为研究对象,同时实现从“因”和“果”2个方向来探究基因调控网络,相互间进行验证,从海量的数据中筛选出关键基因的组学被用来挖掘关键的滞育关联基因、构建其调控网络。华南农业大学的范兰芬等[66]测定了家蚕的滞育卵及非滞育卵的蛋白质组学数据,初步筛选出3个主存储蛋白、9个热激蛋白、37个新陈代谢酶、22个核糖体蛋白,并测定了这些蛋白的编码基因表达水平,验证了部分基因功能;张峰宾等[67]为了研究亲代胚胎是如何接受外界环境刺激,并最终影响子代滞育这一问题,对注定产滞育卵孵育胚胎和注定产非滞育卵孵育胚胎的反转期和点青期进行转录组测序,鉴定到7个滞育候选基因,包括3个热激蛋白基因,2个节律基因及2个TRP家族基因,并利用RNA干扰(RNAi)技术,在个体水平上验证这些基因的功能与滞育有关;陈艳荣等[68]2019年分别对注定产滞育卵和注定产非滞育卵的雌蛹进行转录组测序,鉴定出1个关健的滞育准备期关联基因——akr2e-like,利用Crisp/cas9技术敲除该基因后,使25 ℃孵化的雌蚕产下部分非滞育卵,证明该基因参与滞育调控。
3.2 从表观遗传学的角度研究滞育关联基因
表观遗传学是指不涉及DNA序列改变的基因或者蛋白表达的变化,这种改变可以作为遗传信息传给下一代(跨代遗传),最终在后代中表现出来;主要包括DNA甲基化,组蛋白共价修饰,染色质重塑,基因沉默和RNA编辑等调控机制。最近的研究表明,表观遗传机制在家蚕滞育基因表达调控中具有重要作用,目前相关研究主要集中在各类甲基化酶的表达及滞育关联基因的DNA甲基化修饰2个方向[69-72]。李冰等[69]测定了家蚕的甲基转移酶编码基因(Bmdnmt1和Bmdnmt2)在不同组织、不同胚胎发育阶段和不同品系中的表达水平,结果表明:2种甲基转移酶基因在胚胎发育过程中表达最高,尤其是在胚胎早期;特别是通过HCl处理,在滞育终止卵中表达显著上调。蒋涛等[71]检测了4种不同化性的家蚕品种中N6-甲基腺嘌呤(N6-methyladenosine,m6A)转移酶复合物相关基因在不同阶段的表达水平,并测定了不同浓度的滞育激素或盐酸处理蚕卵中总m6A含量,结果表明,滞育命运组m6A修饰复合体相关基因表达高于非滞育命运组。2020年李冰等[72]又比较分析了家蚕滞育卵与滞育终止卵的DNA甲基化转录组数据,鉴定出364个与甲基化相关的基因,发现滞育命运卵HCl处理后甲基化水平比非滞育卵高0.05%,主要是由于CG甲基化位点较多;通过分析G2/M期特异性E3泛素蛋白连接酶(G2E3),推测甲基化可能通过调节家蚕中的细胞周期而影响胚胎滞育。
4 小结
滞育是受基因控制与外界环境多种因素影响的生物学过程,是昆虫的一种特殊发育阶段。滞育昆虫特殊的复杂生理状态变化、体内各类物质的代谢变化,本质上是基因的表达与变化。研究滞育关联基因有助于了解昆虫的生物学特性,窥探昆虫对环境适应和进化的途径,提高害虫防治效率和昆虫资源利用效率;目前大量研究筛选出一批新的滞育关联基因,将进一步完善家蚕滞育调控的分子网络,有助于阐明家蚕滞育的分子机制,为家蚕育种提供理论依据,更好地开发利用家蚕等经济昆虫,并可为农林害虫的防治新途径研究提供借鉴。

