石墨烯基海绵在止血领域的研究进展
杜芳林,吴冰昕,刘 娇,徐聪聪,李国锋,王 兴
(北京化工大学生物医用材料北京实验室,北京100029)
失血会导致创伤性死亡率升高[1,2],会造成30%~40%患者死亡,在战场上相关死亡率占比高达50%[3]. 尽管人体具有自发凝血机制,可以在一系列凝血因子的作用下促发凝血,但在面对严重的创伤性出血时,人体自身凝血系统无法应对,若不及时进行止血干预,会因大量失血造成失血性休克、器官衰竭等严重后果,甚至直接导致死亡[4]. 因此,使用高效的止血材料实现快速止血,对于挽救创伤患者的生命至关重要.
按照凝血机制,止血材料主要分为三类[5~7]:(1)被动止血材料,如氧化再生纤维素和淀粉等,它们可以快速吸收血浆,使得血液中的蛋白质、血小板和红细胞等富集在伤口表面形成凝血初塞,加速自身凝血机制的激活,达到止血目的[8~10];(2)主动止血材料,如壳聚糖和蒙脱石等,这些止血材料能直接激活血小板和凝血因子,激活内源性凝血级联反应,从而加速凝血[11,12];(3)复合止血材料,如凝血酶/纤维蛋白原复合材料、复合矿物止血材料等[13,14],通过对现有止血材料改性增效或者结合多种止血成分等方式,将主动止血与被动止血机制相复合,弥补了单一止血材料的不足,提高了止血效率和安全性[15~17].
石墨烯(Graphene)是一种二维碳纳米材料[18~21],经氧化、剥离可以得到表面具有丰富含氧官能团的氧化石墨烯(GO),GO 可被还原成还原氧化石墨烯(rGO). 石墨烯及其衍生物由于具有优良的光、电、热、力学性能,且易于功能化[22~24],被广泛应用于生物医学领域,如癌症治疗[25,26]、生物传感[27,28]、生物成像[29,30]、药物递送[31,32]及组织工程[33,34]等. 上述研究主要利用微观尺寸石墨烯及其衍生物,以掺杂或复合的形式实现材料改性和性能提升[35~38],而对宏观石墨烯基材料的应用报道较少. 近年来,研究发现GO与水超亲和特性、独特的二维片层结构、表面易功能化和优异的理化性质在止血方面具有优势,由GO交联得到的石墨烯基海绵可用于外伤止血,主要因为:(1)石墨烯基海绵与水超亲和并具有多孔结构,能够在毫秒级时间内快速吸收液体[8,39~41],具备被动止血材料的固有属性;(2)石墨烯具有独特的二维片层结构且表面易于功能化,这使得石墨烯基海绵可实现多功能复合,有利于发挥协同止血作用;(3)石墨烯基海绵独特的理化性能符合美国陆军外科研究院提出的完美止血剂7项标准,包括2 min内止血、立即使用、使用方便、超轻便携、性质稳定、生物安全、价格低廉[42]. 可见,石墨烯基海绵具有创伤应急处理潜力,将是一类新型的外伤止血材料.
以交联策略构建的具有快速液体吸收特性的石墨烯基止血海绵为基础,通过优化交联剂,使用带氨基的交联分子引入电荷刺激;复合有机凝血因子如凝血酶、原花青素等引入凝血刺激;将无机黏土粒子如高岭土、沸石等嵌入石墨烯基止血海绵的修饰方法引入凝血刺激,不断提升石墨烯基海绵的止血性能,挖掘石墨烯在外伤止血领域的应用潜力. 基于现有研究工作,本文对石墨烯基海绵在外伤止血领域的应用进行综述,按照凝血机制对研究进展进行了归纳和总结(图1),包括快速吸收一元凝血机制、快速吸收和凝血刺激二元协同止血机制,快速吸收、电荷刺激、热刺激三元凝血刺激共同作用止血机制,进而对其发展方向和前景进行了设想和展望.
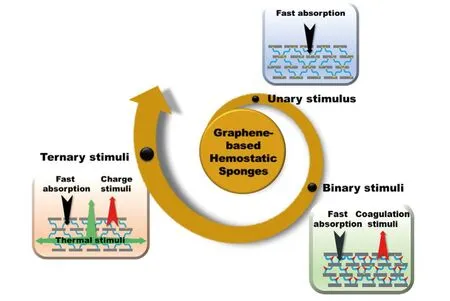
Fig.1 A general outline of this review
1 快速液体吸收的止血机制
率先报道的石墨烯基止血材料是交联石墨烯海绵(CGS),其通过快速液体吸收特性实现快速凝血[8]. Quan 等[8]以乙二胺(EDA)为交联剂,利用EDA 与GO 表面环氧基团的开环反应实现对GO 交联,随后通过冻干、索提、微波膨化得到CGS[图2(A)]. 微波膨化处理使CGS形成大量多级孔道结构,极大增加了材料比表面积[图2(B)]. GO超亲水特性赋予了CGS优异的液体吸收能力,并且其液体吸收速率和吸收能力远优于未经微波膨化的GO气凝胶(GOA),能在40 ms内完整吸收一滴液滴,并可吸收比自身质量重112倍的液体[图2(C)和(D)],拥有被动止血材料的特性.
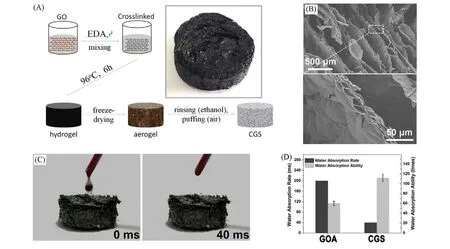
Fig.2 Schematic preparation processes of CGS(the inset is the optical photo of CGS)(A), SEM image of CGS(B), photographs of the blood absorption process on the CGS sample(C),water absorption rate and capability of CGS and GOA(D)[8]
止血机制研究发现,CGS 经微波处理被还原,并不会刺激、激活血细胞和血小板[图3(A)]. 在止血过程中,CGS主要通过快速吸收血浆,富集血细胞和血小板形成细胞初塞,加快血液凝固,从而实现快速止血[图3(B)]. 体外动态凝血实验表明,CGS 具有良好的止血性能,在60 s 内迅速凝结血液[图3(C)]. 动物止血评价进一步证实CGS 稳定的止血性能,在2~4 min 内实现SD 大鼠尾动脉止血[图3(D)]. 与传统的止血材料相比,CGS 具有制备简单、成本低廉、吸收能力强及可长期保存等优点[43]. 上述研究论证了宏观石墨烯基海绵用于体外止血的可行性,为高性能止血材料的研究与开发提供了新材料.
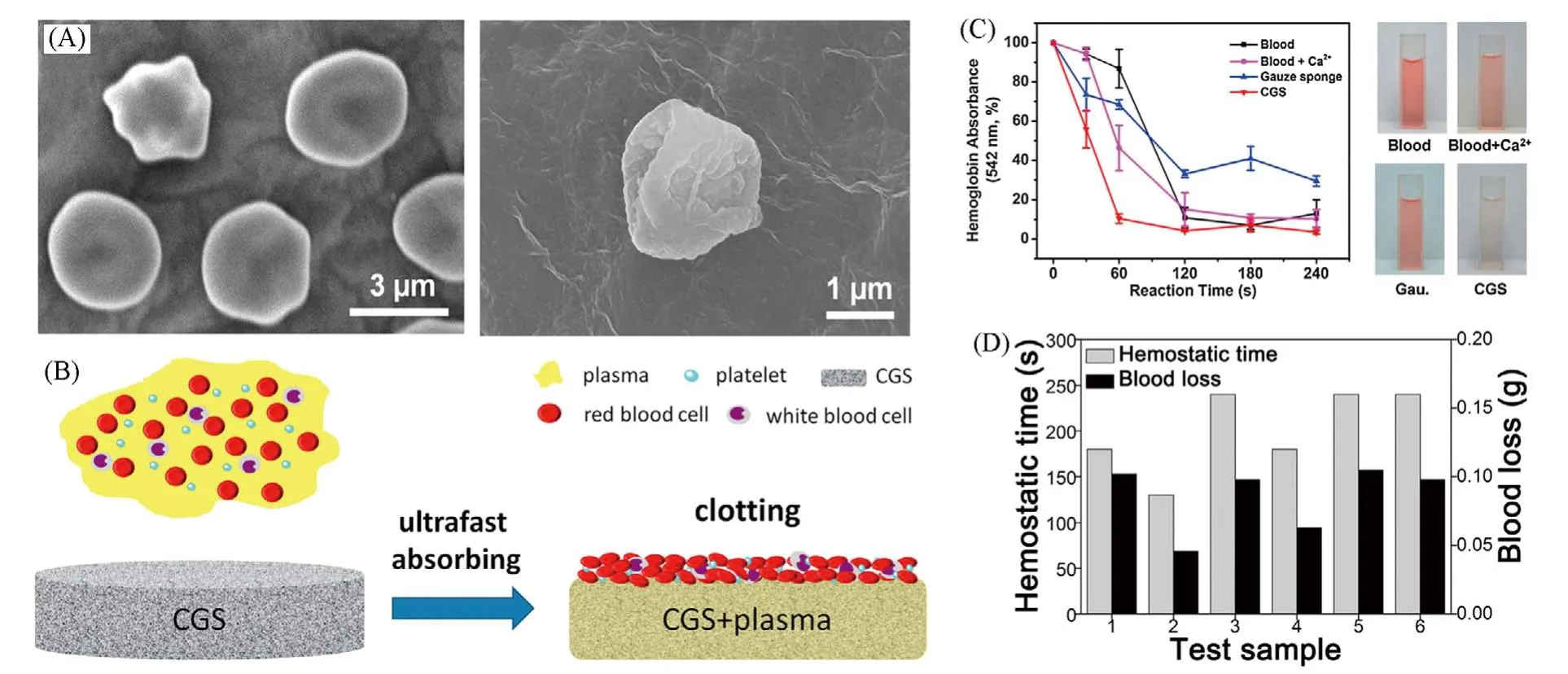
Fig.3 SEM images of blood cells and platelets adhered on CGS(A),hemostatic mechanism of CGS(B), in vitro dynamic whole⁃blood clotting evaluation(C) and in vivo hemostatic performance of CGS(D)[8]
2 快速吸收与凝血刺激的二元协同机制
CGS凝血机制单一,止血效率不足. 为进一步提升CGS止血性能,在保持CGS快速吸收液体特性前提下,后续研究了利用石墨烯二维片层结构及表面易于功能化特性,通过有机/无机复合策略引入凝血刺激,在快速吸收与凝血刺激二元协同作用下,增强石墨烯基海绵凝血刺激,提升材料止血性能[44~47].
2.1 优化交联策略引入电荷刺激
已有研究指出界面刺激能促发凝血级联反应从而加速血液凝结[48,49];而石墨烯易于功能化,通过化学修饰引入特定官能团是增加石墨烯基海绵表面电荷密度、产生界面刺激(电荷刺激)的有效方法.Quan等[9]基于CGS的制备方法,使用2,3-二氨基丙酸(DapA)代替EDA作为交联剂,成功制备石墨烯基海绵(DCGS)[图4(A)]. 相比于EDA,DapA的羧基官能团提高了DCGS氧化度,增强了表面电负势,使DCGS在保留CGS快速液体吸收特性的同时,对红细胞和血小板产生电荷刺激,促发凝血级联系统[图4(B)].ζ-电势检测证实DCGS表面电负势从-18.7 mV(CGS)提高至-24.2 mV. 在负电荷作用下,DCGS表现出较强的凝血刺激作用,诱导红细胞和血小板形态发生明显变化,使它们由原来圆滑形态变为具有伪足的不规则形态,并紧密结合材料,表明DCGS激活了血细胞和血小板,凝血通路被打开. 最终,在快速吸收和电荷刺激二元作用下,DCGS在166 s内实现了快速凝血,止血时间比CGS缩短了35 s. 此外,他们还探究了DapA 手性对DCGS 性能的影响[图4(C)]. 研究发现,DapA 手性能够调控血细胞和血小板的黏附行为,导致材料与血痂的结合力差异,进而影响受试动物出血量;而在止血过程中,血液被动与材料接触,DapA手性对DCGS止血时间并没有显著影响. DCGS止血效率的提升主要得益于羧基基团对血小板、血细胞的电荷刺激作用. 该研究论证了提升电负势可增强石墨烯基海绵电荷刺激作用,快速液体吸收和电荷刺激的共同作用能有效提升石墨烯基海绵的止血性能.
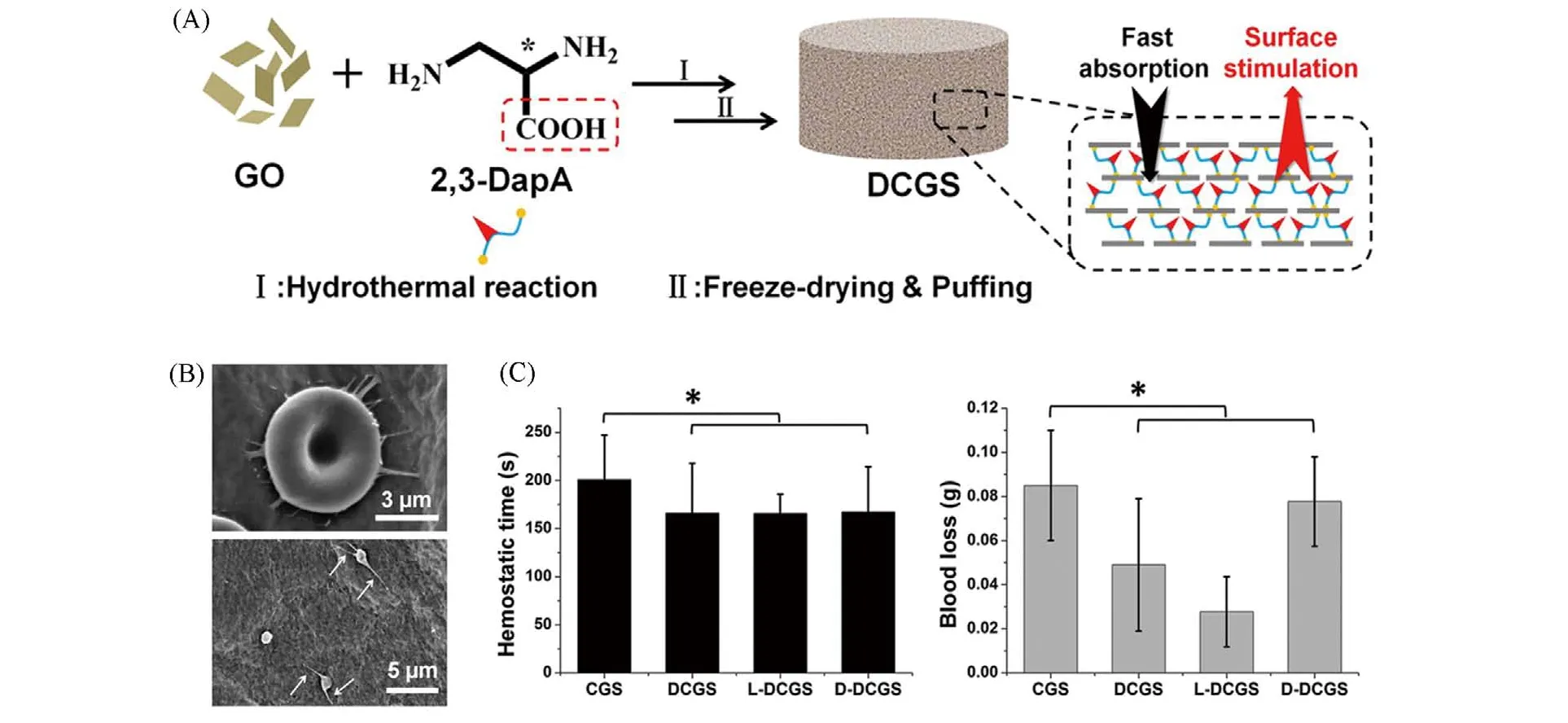
Fig.4 Schematic representation of the preparation route and the hemostatic mechanism of DCGS(A),SEM images of interfacial interaction between blood cells,platelets and DCGS(B)and hemostasis time and blood loss of DCGS(C)[9]
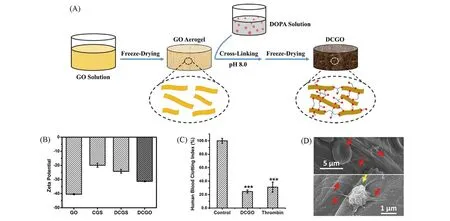
Fig.5 Schematic of the preparation of DCGO(A),zeta potential tests of DCGO(B),human blood clotting index of DCGO and 10 U thrombin(C),selective adsorption of rat blood cells and platelets(D)[50]
GO 含有丰富的含氧基团,电负势高达-40.4 mV,远高于DCGS(-24.2 mV). 然而在CGS 和DCGS的制备过程中,高温水热反应和微波处理使GO被还原,丢失了大量含氧基团而失去电荷刺激作用. 为了进一步增强石墨烯基海绵电荷刺激,Li等[50]采用温和的交联策略制备了聚多巴胺(PDA)交联石墨烯基海绵(DCGO). 首先,将GO溶液冷冻干燥形成自组装海绵(GOA),加入多巴胺溶液并在碱性条件下诱导其自聚合形成PDA网络,PDA与GOA相交联得到DCGO[图5(A)]. 相比于CGS和DCGS的制备方法,多巴胺自聚合交联法操作条件温和,避免了高温反应和微波膨化对GO的还原作用. 因此,DCGO有效保留了GO丰富的含氧官能团,电负势高达-31.3 mV[图5(B)]. 在电荷刺激作用下,DCGO表现出更强的血小板激活作用,活化能力与10 U凝血酶(Thrombin)相当[图5(C)]. DCGO可促进纤维蛋白原转化为纤维蛋白并形成纤维蛋白网络[图5(D)],增强血痂强度,加快凝血过程. 最终,DCGO的止血时间缩短至105 s. 此外,PDA 网络提高了DCGO 机械强度,使海绵在吸收大量液体时维持原有结构,以保障有效的血液吸收能力. 研究证实,进一步增强电负势可有效提高石墨烯基海绵的止血性能.
2.2 复合无机黏土引入电荷刺激
无机黏土是最早被开发的高效外伤止血材料,如沸石(Zeolite)、蒙脱土(MMT)及高岭土(Kaolin)等[51~53]. 无机黏土中,蒙脱土由于具有可膨胀特性和较强的电荷刺激能力,被认为是最有效的无机止血材料[52,54]. 但也因为过强的电荷刺激作用,蒙脱土会导致血管内形成血栓,且造成严重细胞毒性,危及生命[55,56]. 为避免蒙脱土的毒副作用,同时发挥其高效凝血刺激,Li等[57]巧妙地利用石墨烯二维片层结构固定蒙脱土颗粒,制备得到石墨烯/蒙脱土复合海绵(GMCS). 蒙脱土的层状硅酸盐结构具有负电荷表面,晶体边缘因不饱和键带有正电荷[58];而CGS由于其表面上的氨基(EDA)具有正电荷,边缘羧基带有负电荷,这与蒙脱土的电荷分布完美匹配,使得石墨烯片层能通过静电相互作用和氢键紧密包裹蒙脱土. 因此,两者复合并通过交联剂固定,能够有效防止蒙脱土颗粒游离进入血管内,保障了材料安全性[图6(A)和(B)]. 在止血过程中,GMCS快速吸收血浆,使得血细胞和血小板等被浓缩富集在材料与创口界面,加快了血痂的形成. 与此同时,GMCS 海绵内部的蒙脱土会结合并激活随血浆进入海绵内部的凝血因子FXII,随后释放激活态凝血因子FXIIa,促发凝血级联反应,加速形成纤维蛋白网络,加固血痂,实现快速止血[59]. 在石墨烯海绵液体快速吸收能力和蒙脱土凝血刺激的协同作用下,GMCS展现出良好的止血效果,在85 s内可实现兔腹股沟大动脉止血. 血管断层扫描显示止血后的血管内没有血栓或血块形成[图6(C)],兔存活率达到100%. 可见,石墨烯基海绵消除了蒙脱土的毒副作用,使蒙脱土可重新用于创伤安全止血.

Fig.6 Diagram of MMT incorporation in GMCS and its hemostatic mechanism(A), SEM image and TEM image of GMCS(B),CT image of blood flow through the femoral artery of experimental rabbit(C)[57]
尽管GMCS海绵消除了蒙脱土因泄露造成血栓的弊端,但人们对蒙脱土的生物安全性仍有顾虑.为了消除这种担忧,并增强石墨烯基海绵在创伤止血方面的表现,高岭土被筛选用于构建石墨烯/高岭土复合止血海绵(GKCS)[60]. 在快速吸收和电荷刺激的二元作用下,因子XII 和血小板被激活,凝血通路被打通[图7(A)],最终GKCS在73 s内实现了快速止血. 此外,相比于蒙脱土的高溶血,高岭土具有极低的溶血率(低于2%),因此GKCS 具有良好的血液相容性[图7(B)],并且能有效抑制炎性基因IL-1β和IFN-γ的表达[图7(C)],保障创口组织不被感染.
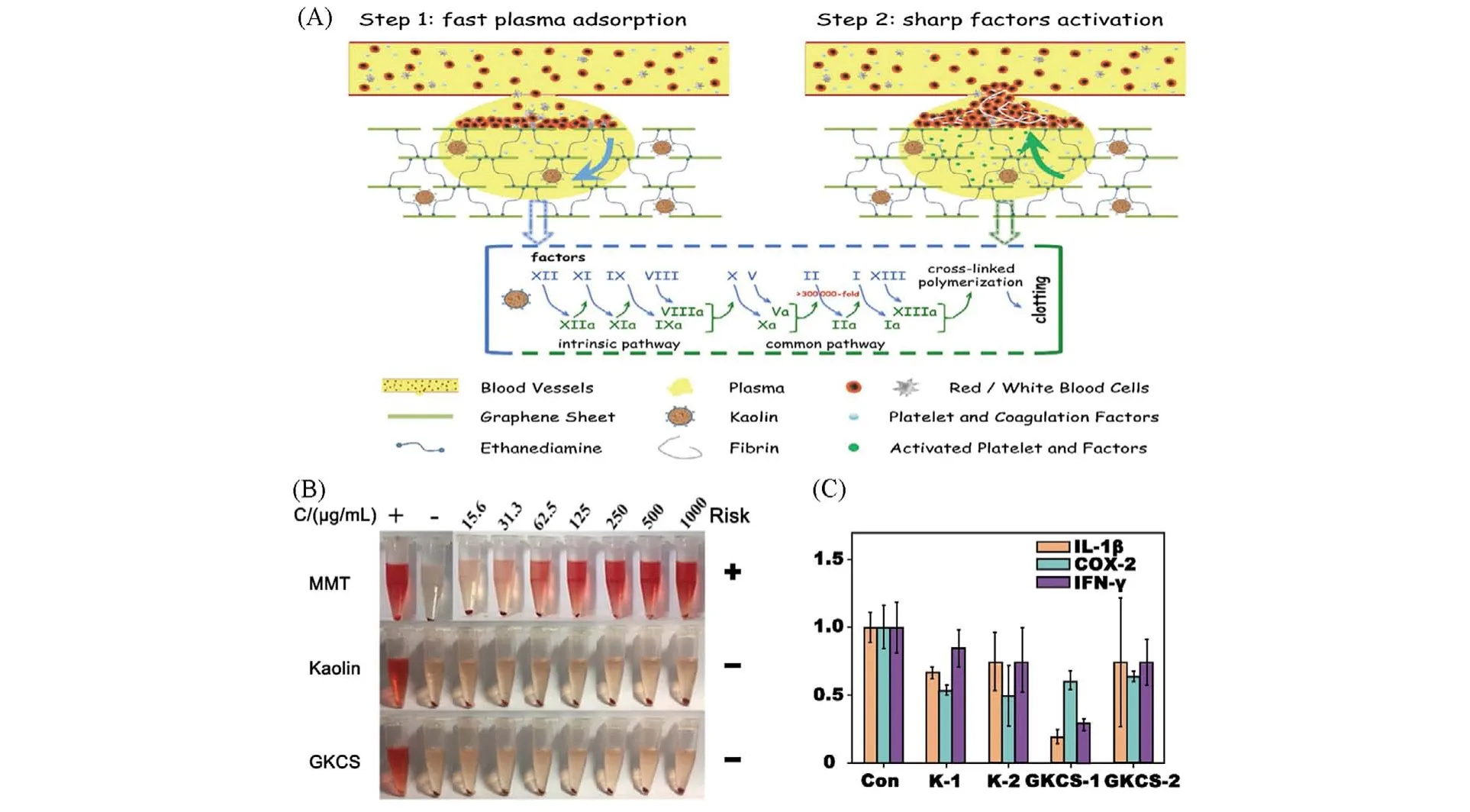
Fig.7 Schematic representation of the hemostatic mechanism for GKCS(A), hemolysis assays for MMT,Kaolin and GKCS(B),the gene expression level of IL⁃1β,NF⁃kB(COX⁃2,IFN⁃γ)for GKCS(C)[60]
2.3 搭载生物分子引入凝血刺激
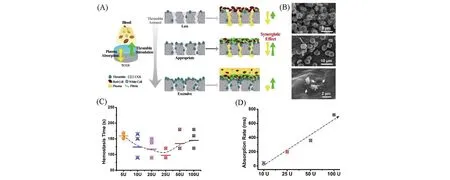
Fig.8 Schematic representation of TCGS constructions and the synergy effect for hemostasis(A),SEM images of blood cells and platelet adhesion on TCGS surface(B), hemostatic time(C) and the absorption rate(D)of TCGS with different added amounts of thrombin(10,25,50,100 U)[62]
凝血酶是一种经典的止血药剂,能够将可溶性纤维蛋白原转化为不溶性纤维蛋白实现快速止血[61]. Li 等[62]以CGS 为载体,采用物理喷淋方式将凝血酶固定在CGS 表面,形成CGS/凝血酶复合海绵(TCGS)[图8(A)],并以此为模型材料深入研究二元协同止血机制. 研究发现,在CGS 快速液体吸收作用和凝血酶凝血刺激共同作用下,TCGS 将止血时间缩短至100 s,性能优于凝血酶或CGS[图8(B)]. 然而,凝血酶添加量(酶活U)与TCGS 止血性能呈现非线性关系:当凝血酶含量低于25 U时,随着凝血酶添加量的增加,TCGS 止血性能逐渐提升;而当凝血酶含量高于25 U时,TCGS 止血性能随凝血酶添加量增加而下降[图8(C)]. 这主要是由于石墨烯基海绵液体吸收性能和凝血酶刺激作用存在平衡关系:在不影响海绵液体吸收能力的前提下,增加凝血酶含量,提高酶活能够加快纤维蛋白网络形成,加速凝血;但喷淋过多凝血酶会堵塞海绵孔道,削弱海绵液体吸收能力,TCGS止血性能也随之减弱[图8(A)和(D)]. 因此,石墨烯基海绵的液体吸收能力和凝血因子的凝血刺激作用既统一又对立,当两者处于协同状态,才能最大限度发挥石墨烯复合海绵止血性能.
在上述研究基础上,Mellado等[63]将葡萄籽提取物,原花青素(PA)作为活性因子添加到GO/聚乙烯醇复合气凝胶中,通过提高凝胶电负势和液体吸收能力增强其止血性能,同时PA的引入还赋予凝胶促伤口愈合的能力. Chen等[64]利用天然止血药白芨多糖(Bsp)与GO的氢键相互作用力对GO进行交联改性,得到的BGCS海绵具有较高电负势(-27.3 mV)和快速液体吸收作用,能在50 s内实现鼠尾动脉的高效止血.
3 快速吸收、电荷与热刺激的三元作用机制
以上研究采用有机/无机复合,直接添加凝血刺激因子等方式实现二元凝血刺激作用;而石墨烯本身具有极佳的热传导效应[65],可利用其导热性能平衡热刺激,实现多元凝血刺激共同作用.
沸石具有较强的液体吸附能力和丰富的表面电荷,作为第一代QuikClot止血敷料,被广泛应用于止血领域[66]. 但是由于沸石在吸收液体后会释放大量热量,导致伤口温度高达70 ℃,会对伤口组织造成严重灼伤,沸石逐渐被其它材料取代[67~69]. 然而,沸石适当的热释放有利于激活凝血级联反应,加速凝血[70,71]. 因此,如何平衡沸石热刺激和热损伤是一个具有挑战性的难题. 基于上述石墨烯基海绵二元协同止血研究,结合石墨烯材料优异的热传导性能,Liang 等[72]设计构建了一种沸石/交联石墨烯海绵(Z-CGS). Z-CGS中石墨烯二维片层结构完美包覆沸石,避免了沸石与伤口直接接触. Z-CGS吸水后具有温和的放热过程和良好的导热特性[图9(A)和(B)],可以有效防止沸石放热产生的局部高温对伤口造成二次伤害.
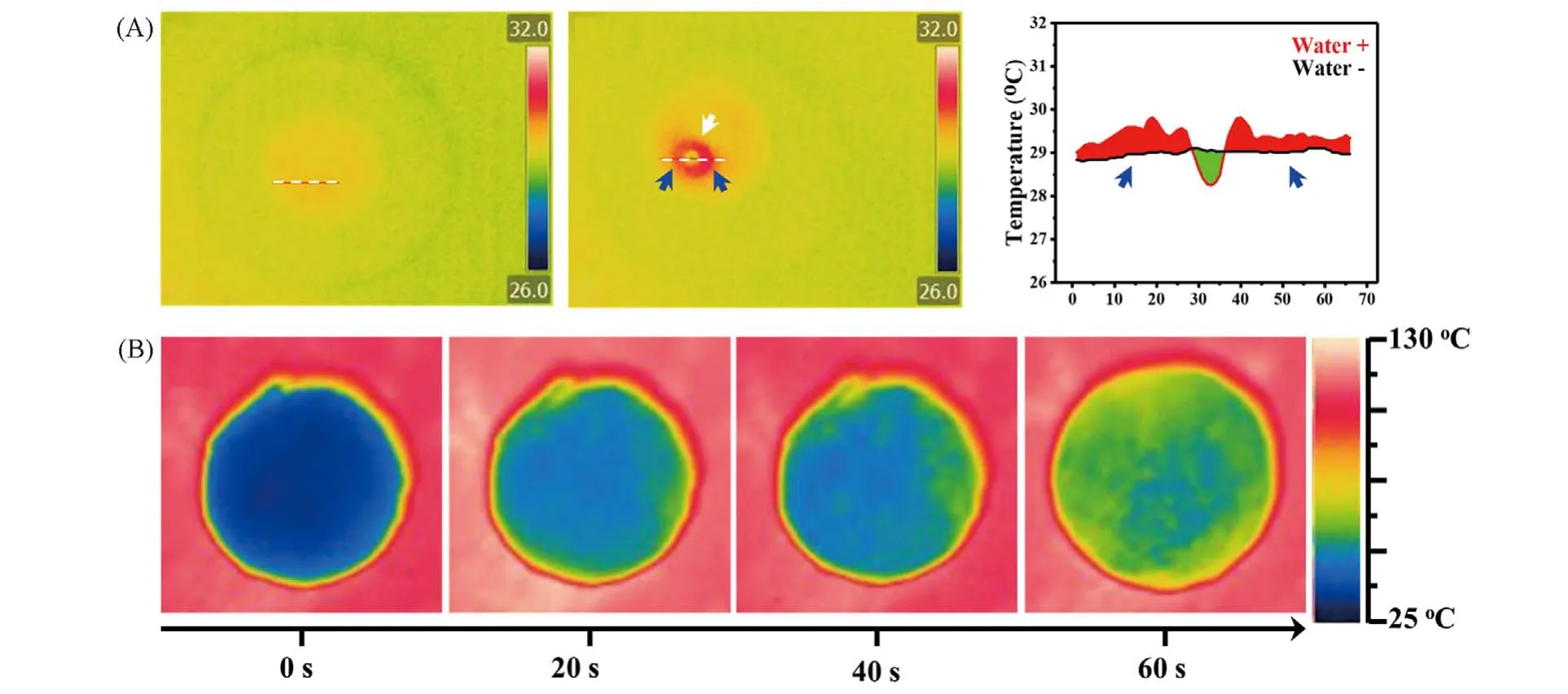
Fig.9 IR image of Z⁃CGS before or after liquid absorption(A),thermal conductivity of Z⁃CGS(B)[72]
此外,血液凝固指数(BCI)结果显示,具备电荷刺激但不具备放热能力的沸石对照物ZSM-5 嵌入CGS后,Z-CGS(ZSM-5)BCI相比于CGS有所下降[图10(A)],证明沸石的电荷刺激特性增强了CGS的凝血能力. 在物理吸附作用、热刺激和电荷刺激三元凝血刺激共同作用下,Z-CGS[图10(A)中Z-CGS(5A)]表现出更为出色的止血性能,BCI降低至40%,数值远低于其它含一元或二元凝血刺激作用的石墨烯基海绵. 体内止血评价进一步证实:Z-CGS 能在69 s内停止大鼠大动脉出血,性能优于商售止血产品QuikClot Combat Gauze(QCG)[图10(B)]. 跟踪止血过程中材料的放热情况发现[图10(C)~(E)],沸石组会在1 min内升温至70℃,并持续高温将近9 min,严重灼伤伤口组织. 然而,Z-CGS并不会引起明显的局部高温,在整个止血过程中,Z-CGS 表现出温和的放热反应,伤口组织温度不超过42 ℃,这有利于激活凝血因子加速止血而不会对伤口造成灼伤.

Fig.10 In vitro(A)and in vivo(B)hemostatic performance of Z⁃CGS,IR images of hemostatic pro⁃cess in the SD rat artery injury model of zeolite(C) and Z⁃CGS(D),temperature curve of wound tissue after application of different hemostats(E)[72]
基于以上结果,Liang等[72]深入分析了Z-CGS三元凝血刺激共同作用促进止血的过程. 首先,血液被Z-CGS快速吸收,血细胞及血小板富集在材料与伤口界面形成细胞初塞;血浆被快速吸收进入材料内部,血浆中的凝血因子被沸石电荷刺激作用激活,促发凝血级联反应. 与此同时,沸石吸收血浆并放出热量,热量经石墨烯快速传导至周围和界面处,激活血小板,增强血痂强度并进一步强化凝血级联反应. 因此,在三元凝血刺激共同作用下,Z-CGS实现了安全、高效止血. 可见,多元凝血刺激共同作用能够有效提升石墨烯基海绵的止血性能,石墨烯的导热性为沸石安全高效地应用于止血领域开辟了一条新途径.
4 总结与展望
石墨烯基海绵是具有发展潜力的新兴止血材料,在创伤应急方面具有潜力和优势.(1)石墨烯基海绵具有强大的液体吸收性能,可以快速吸收血液,是优秀的被动止血材料;(2)石墨烯基海绵易功能化特性与独特的二维片层网络结构,使其可以通过复合策略引入凝血刺激,增强止血性能,最快在69 s内实现止血,同时具有很高的生物安全性,可用于快速安全止血;(3)石墨烯基海绵操作简单、使用方便,无需进行预处理,将海绵持续按压于伤口即可实现止血;(4)石墨烯基海绵质地轻可压缩、性质稳定,方便携带并可长时间储存.
本文根据止血机制,对石墨烯基止血海绵的研究工作进行了归纳和总结:(1)石墨烯与水超亲和,石墨烯基海绵能快速吸收血浆,富集血细胞、血小板实现止血;(2)利用石墨烯二维片层结构和表面易于功能化的特性,采用有机/无机复合,直接添加活性因子等策略,在石墨烯基海绵基础上引入凝血刺激,协同海绵快速吸收作用,提升了石墨烯基复合海绵的止血性能;(3)基于二元凝血刺激并结合石墨烯导热性能,实现了快速吸收、电荷刺激以及热刺激的三元刺激凝血作用,进一步提升了石墨烯基海绵的止血性能.
石墨烯基海绵在创伤止血领域具备独特的优越性,显示出积极的发展态势:(1)多机制协同增效,实现石墨烯基海绵安全、高效止血. 上述研究论证了多元凝血刺激复合策略是提升石墨烯基止血海绵性能的切实可行的方法,为高性能石墨烯基止血材料的研究与发展指明了方向,奠定了理论基础. 但多机制协同增效的内在机理目前仍需要深入挖掘,对于即统一又对立的多元凝血刺激作用该如何平衡与调节,发挥它们最大的促凝血作用是值得探讨和挖掘的关键科学问题. 此外,石墨烯基海绵快速吸收作用与凝血刺激存在动态平衡关系,单纯通过添加多种凝血刺激客体分子会牺牲海绵快速吸收作用,难以实现有效的多机制协同作用. 因此,利用石墨烯基材料独特的物理化学特性,如光学性能、导电、导热性能等,在保障石墨烯基海绵快速液体吸收作用的前提下,发掘更多的凝血刺激作用,实现多机制协同止血并阐明多机制协同的内在机理,对发展高性能石墨烯基止血海绵具有重要的意义.(2)多功能复合提升石墨烯基海绵的综合性能. 高性能止血海绵开发的根本指标在于高效止血,但与此同时,其它性能如复杂伤口适应性、促伤口愈合性及抗感染性等在实际应用中也不可或缺. 石墨烯基海绵是一种优异的平台化载体材料,利用其独特的二维片层结构可有效搭载功能性客体分子,实现多功能复合. 因此,复合策略实现石墨烯基海绵多功能化,用于应对复杂伤口、避免伤口感染、加速伤口愈合等是石墨烯基止血海绵发展的另一个重要方向和趋势. 在保障石墨烯止血海绵快速止血性能前提下,如何同时实现抑菌、促愈合等多功能具有重要的研究价值.
总而言之,石墨烯基海绵是一类新兴的外伤止血材料,由二维石墨烯纳米片层构筑形成,具有多级孔道结构、快速液体吸收能力、易于表面功能化等特性,可作为平台式载体实现多凝血机制协同及多功能复合,性能有望优于美国陆军外科研究院提出的完美止血剂7项标准,在外伤止血具体领域发挥不可替代的作用. 石墨烯基止血海绵的不断发展不仅开辟了石墨烯基材料应用的新方向,而且为军民医疗和应急救护提供了一种使用便捷且安全高效的新型止血材料,也为高性能外伤止血材料的理论研究提供了新见解.

