反应时间对镁铝水滑石制备及其吸附性能的影响
胡 盛,张明浩,胡卫兵
(湖北民族大学化学与环境工程学院,生物资源保护与利用湖北省重点实验室,恩施 445000)
0 引 言
盐酸四环素(tetracycline hydrochloride)是一种广谱抗生素,其在生物体内吸收不完全被排出体外,且残留在土壤环境中的盐酸四环素因结构中含有萘酚环而不易被生物降解[1-2]。由于盐酸四环素疗效确切,在很多国家被广泛使用。而近年来在医药、畜牧等方面的不恰当使用已导致盐酸四环素大量进入土壤环境,对土壤产生毒性,对生态环境造成威胁[3]。由于吸附法过程简单、经济、高效、价廉等特点,成为处理盐酸四环素废水的有效途径,常用的吸附材料主要有石墨[1]、沸石[3]、高分子球[4]、二氧化钛[5]等。
水滑石是由带正电荷的金属氢氧化物层和带负电荷的层间阴离子构成的层状双羟基金属氢氧化物(layered double hydroxides,LDHs),是一类结构可调的特殊阴离子型层状化合物[6],由于其组成可控、层板结构可调变、层间阴离子可交换和比表面积大等特点,具有很强的吸附能力,被广泛用作催化、阻燃、吸附材料[7-9],但目前的研究报道主要聚焦在催化剂[7]和磷化合物[10]吸附,用于抗生素药物的吸附报道较少。材料的组成、微观结构决定了材料的宏观物理化学性能,共沉淀法工艺简单、反应易控制、设备要求低、易工业化生产,因此成为合成水滑石的常用方法[11]。制备过程中反应时间对水滑石晶体的形成、组成、微观结构有重要影响,因此研究制备过程中反应时间对水滑石物相、微观结构及其吸附性能对土壤污染治理和修复具有重要的现实意义。
本文在前期研究基础上[12-13],以价格低廉的硫酸镁和硫酸铝为原料,尿素作沉淀剂,采用共沉淀法制备对盐酸四环素具有较好吸附效果的镁铝水滑石,并通过XRD、SEM、FT-IR对沉淀产物进行结构表征,重点探讨反应时间对镁铝水滑石物相组成、微观结构和吸附性能的影响,初步建立水滑石对盐酸四环素的吸附动力学和热力学。
1 实 验
1.1 主要原料
无水硫酸镁,分析纯,天津市福晨化学试剂厂;十八水合硫酸铝,分析纯,国药集团化学试剂有限公司;尿素,分析纯,西陇科学有限公司;盐酸四环素,达美国药典级,阿拉丁试剂公司;自制蒸馏水。
1.2 镁铝水滑石的制备过程
按nMg2+∶nAl3+=3 ∶1称取MgSO4和Al2(SO4)3溶于50 mL蒸馏水,尿素用量与硫酸根的摩尔比(nCO(NH2)2∶nSO2-4)为4 ∶1,在反应温度为383 K时,分别电动搅拌8 h、10 h、12 h、14 h,抽滤,蒸馏水洗涤后转入烘箱,在353 K干燥,研磨即得不同反应时间的反应产物。
1.3 样品的表征及性能测试
采用德国Bruker公司生产的D8 Advance型X射线粉末衍射仪对反应产物进行测试,测试条件:靶材Cu,管电压40 V,管电流40 mA,扫描范围为10°~80°,采用连续扫描,扫描速度为10(°)/min。
通过美国Thermo Nicolet公司产Avatar370型傅里叶变换红外光谱仪,测试不同反应时间对反应产物官能团的变化,产物经过KBr压片,测试的波数范围为400~4 000 cm-1。
利用日本电子株式会社生产的JSM-6510LV型扫描电子显微镜,观察不同反应时间反应产物微观结构的演化,喷金处理,工作电压为20 kV。
采用吸附率评价吸附性能,具体的测试方法参考文献[13]。
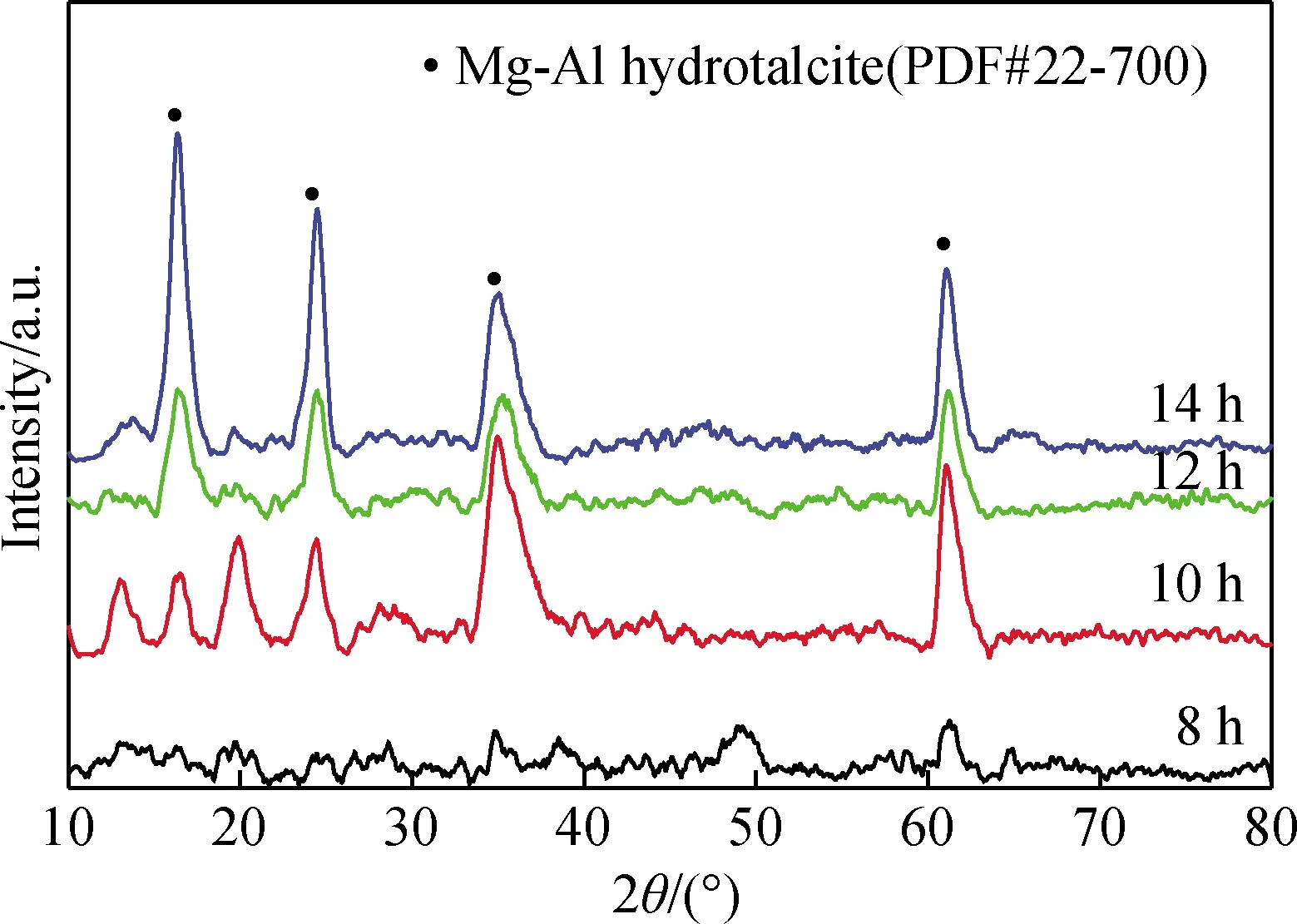
图1 不同反应时间对产物XRD谱的影响Fig.1 Effect of reaction time on XRD patterns of products
2 结果与讨论
2.1 反应时间对产物物相的影响
图1为不同反应时间对产物物相组成的影响。从图1可以看出,当反应时间为8 h得到的产物未出现镁铝水滑石(下文简称水滑石)特征衍射峰;反应时间超过8 h得到各产物在2θ为16°、24°、35°和61°附近均出现强烈衍射峰,分别对应硫酸根型镁铝水滑石的(003)、(006)、(009)、(110)晶面衍射峰,表明反应产物的主要物相为镁铝水滑石。但反应时间为10 h,反应产物具有明显的杂质相,随着反应时间的延长,产物的杂质相逐渐消失,水滑石的特征峰进一步增强且更加尖锐,这些结果表明,反应时间超过8 h才能形成水滑石产物,且在此基础上延长反应时间,衍射峰的相对强度略有增加,峰型变得尖而窄,有利于水滑石的生长。
2.2 反应时间对产物FT-IR的影响
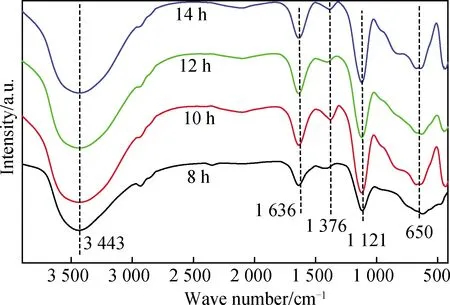
图2 不同反应时间对产物FT-IR谱的影响Fig.2 Effect of reaction time on FT-IR spectra of products
图2为反应时间对产物FT-IR谱的影响。由图2知:不同反应时间的产物在3 443 cm-1处出现强烈的-OH伸缩振动峰;在1 636 cm-1附近为水分子的弯曲振动峰;在1 376 cm-1左右为尿素产生的CO2-3吸收峰;在1 121 cm-1和650 cm-1处的两个吸收峰为SO2-4吸收峰[12]。同时发现:当反应时间为8 h时,产物在630 cm-1处的SO2-4吸收峰出现右移[13];当反应时间超过8 h后,反应产物在436 cm-1左右新出现了Mg-O和Al-O的特征峰[14]。表明反应时间为8 h时,有部分反应发生,但还未形成水滑石,超过8 h后,合成了水滑石,与XRD分析基本一致。
2.3 反应时间对产物微观形貌的影响
图3为反应时间对产物微观形貌的影响。从图3可以看出:反应时间为8 h的产物结构不明显,有部分粉末化,表明反应不完全;当反应时间延长超过8 h,反应产物逐渐出现较规则的结构,且随着反应时间的增加,水滑石的粒径越来越大。

图3 反应时间对产物微观形貌的影响Fig.3 Effect of reaction time on SEM images of products
2.4 反应时间对产物吸附性能的影响
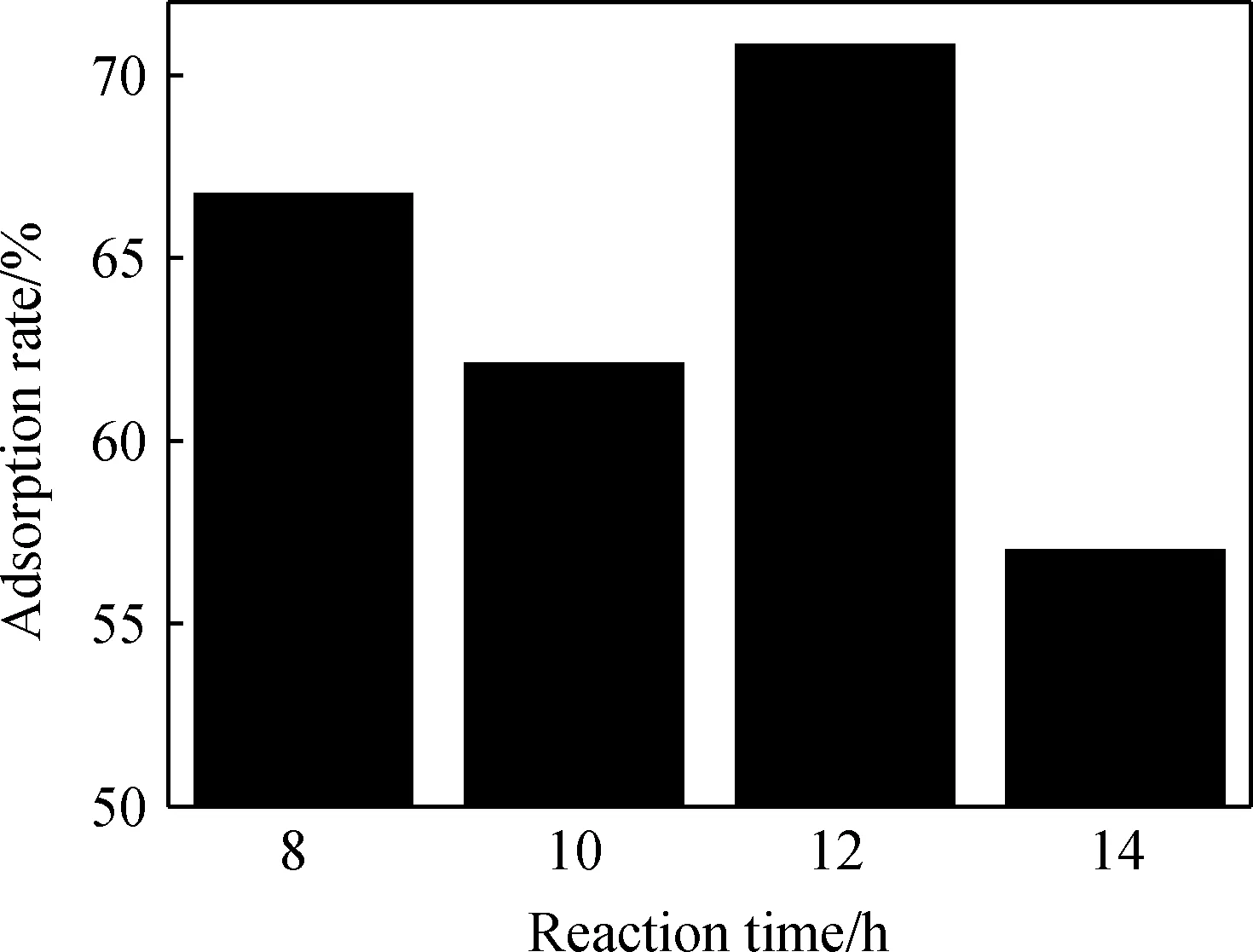
图4 不同反应时间对产物吸附盐酸四环素的影响Fig.4 Effect of reaction time on adsorption capacity of tetracycline hydrochloride of products
图4为反应时间对产物吸附盐酸四环素的影响。从图4可以看出,当反应时间为8 h比反应时间为10 h和14 h生成产物的吸附性能好。结合XRD(图1)和SEM(图3)的分析,反应时间为8 h时,未形成水滑石,主要靠固体粉末的大比表面积来吸附盐酸四环素,水滑石吸附主要取决于层间调控[13],当反应时间为12 h时,水滑石具有较好的结构调变、阴离子交换和大比表面积,此时对盐酸四环素有最大吸附率,为70.82%。当反应时间增加到14 h时,随着反应时间的延长,晶体结构渐趋于完成,粒径增加,使得水滑石对盐酸四环素的吸附性能下降。
为进一步证实水滑石吸附与层间调控密切相关,对反应时间为12 h制备的水滑石吸附盐酸四环素前后的物相变化和红外光谱进行了测试,其结果如图5~6所示。从图5可以看出,水滑石的晶型没有被破坏。但水滑石的(003)、(006)晶面衍射峰吸附后衍射强度相对增强,均说明吸附的盐酸四环素已进入水滑石层间[15]。
从图6可以发现,水滑石吸附前后在3 440 cm-1、1 636 cm-1、1 376 cm-1、1 121 cm-1、650 cm-1、436 cm-1处吸收峰依然存在;水滑石吸附盐酸四环素后在1 360 cm-1附近产生一个新的吸收峰,为盐酸四环素上-CH3特征吸收峰,说明盐酸四环素已被水滑石层间吸附。
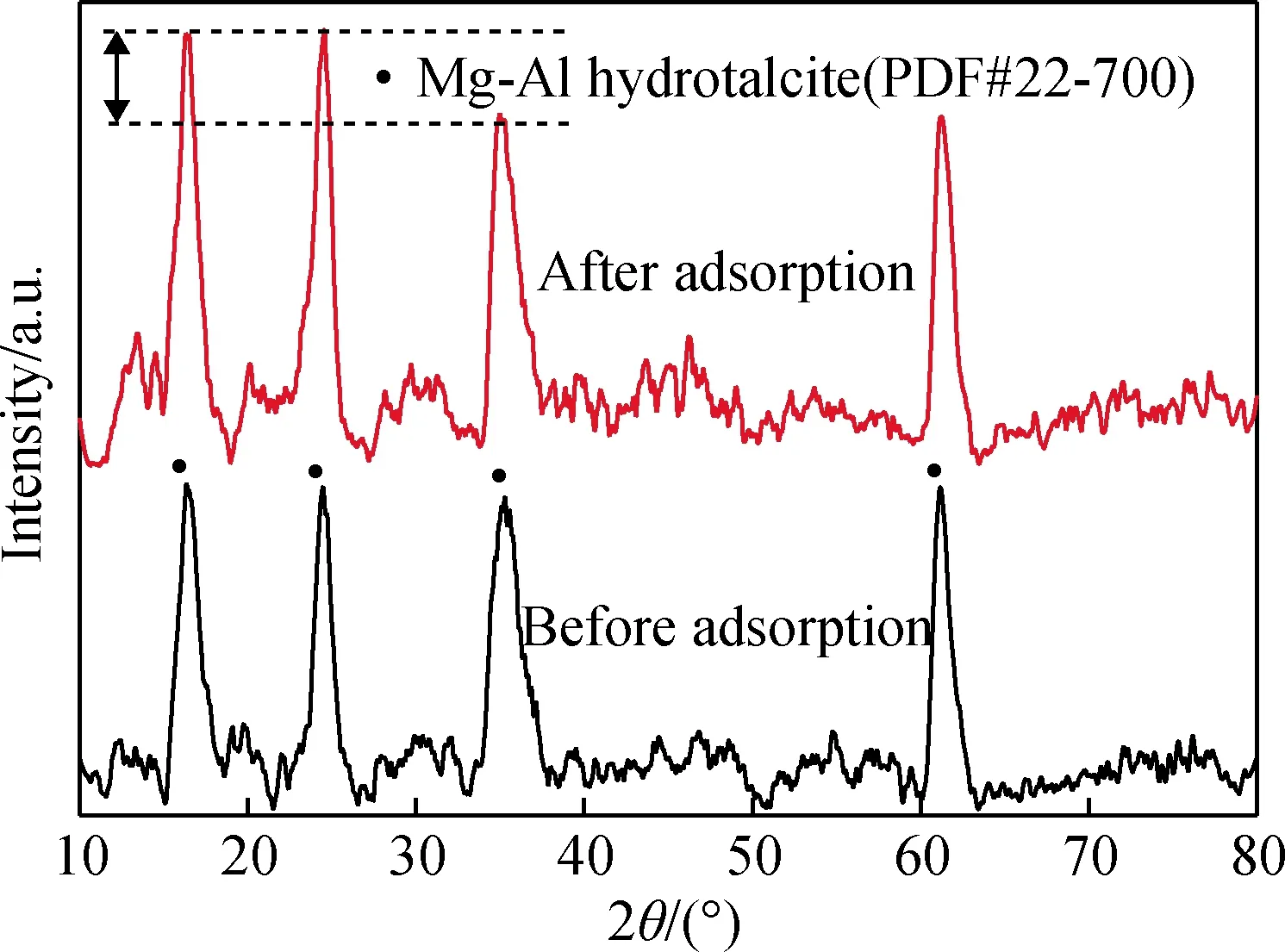
图5 镁铝水滑石吸附盐酸四环素前后的XRD谱Fig.5 XRD patterns of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
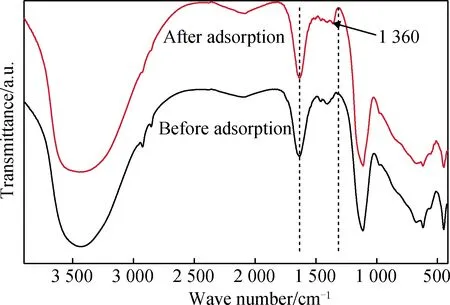
图6 镁铝水滑石吸附盐酸四环素前后的FT-IR谱Fig.6 FT-IR spectra of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
2.5 水滑石对盐酸四环素的吸附动力学
在反应时间为12 h的条件下制备了水滑石,进一步研究水滑石对盐酸四环素的吸附过程。分别用准一级动力学方程和准二级动力学方程(见式(1)~(2)),构建不同温度下水滑石对盐酸四环素的qt-t关系,并利用Origin软件对其数据进行拟合,如图7所示,拟合后的相关参数见表1。
ln(qe-qt)=lnqe-K1·t/2.303
(1)
t/qt=1/(K2·q2e)+t/qe
(2)
式中:qe为平衡吸附量,mg/g;qt为t时刻的吸附量,mg/g;K1、K2为常数。
从图7可以看出,随着温度的升高,水滑石对盐酸四环素的吸附等温线越高,表明水滑石对盐酸四环素的吸附是吸热反应,升温有利于吸附的进行。从表1动力学拟合相关系数可知,准一级动力学方程的拟合系数R2值更接近于1,表明水滑石对盐酸四环素的吸附过程更符合准一级动力学方程,并且发现K1随着温度的升高而增大,再次说明升温有利于吸附反应的进行。

图7 镁铝水滑石对盐酸四环素吸附速率拟合曲线Fig.7 Adsorption rate fitting curves of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
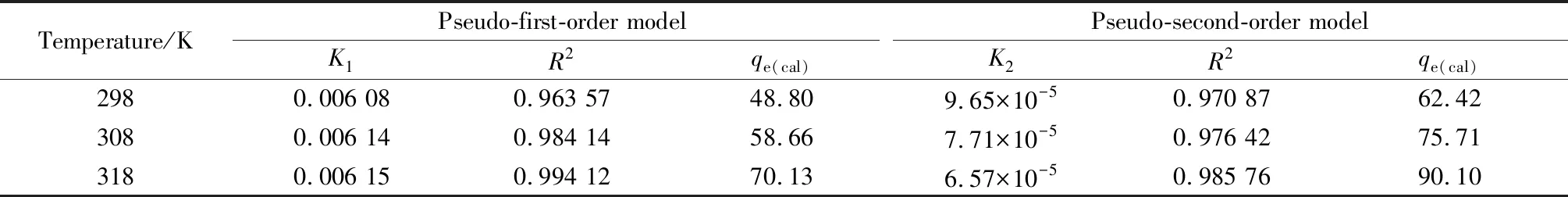
表1 水滑石对盐酸四环素吸附动力学拟合相关系数Table 1 Adsorption kinetic fitting correlation coefficient of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
2.6 水滑石对盐酸四环素的吸附热力学
利用Langmuir等温式和Freundlich等温式(见式(3)~(4)),来评价水滑石对盐酸四环素的吸附行为[16],如图8所示,分别作不同温度的水滑石的Langmuir等温吸附线(即qe-Ce的关系曲线)和Freundlich等温吸附线(即lnqe-lnCe的关系曲线)。
Ce/qe=1/(KL·qm)+Ce/qm
(3)
lnqe=lnKf+1/nlnCe
(4)
式中:qe为平衡吸附量,mg/g;Ce为溶液的平衡浓度,μg/mL;qm为理论最大吸附量,mg/g;KL、Kf、n为常数。
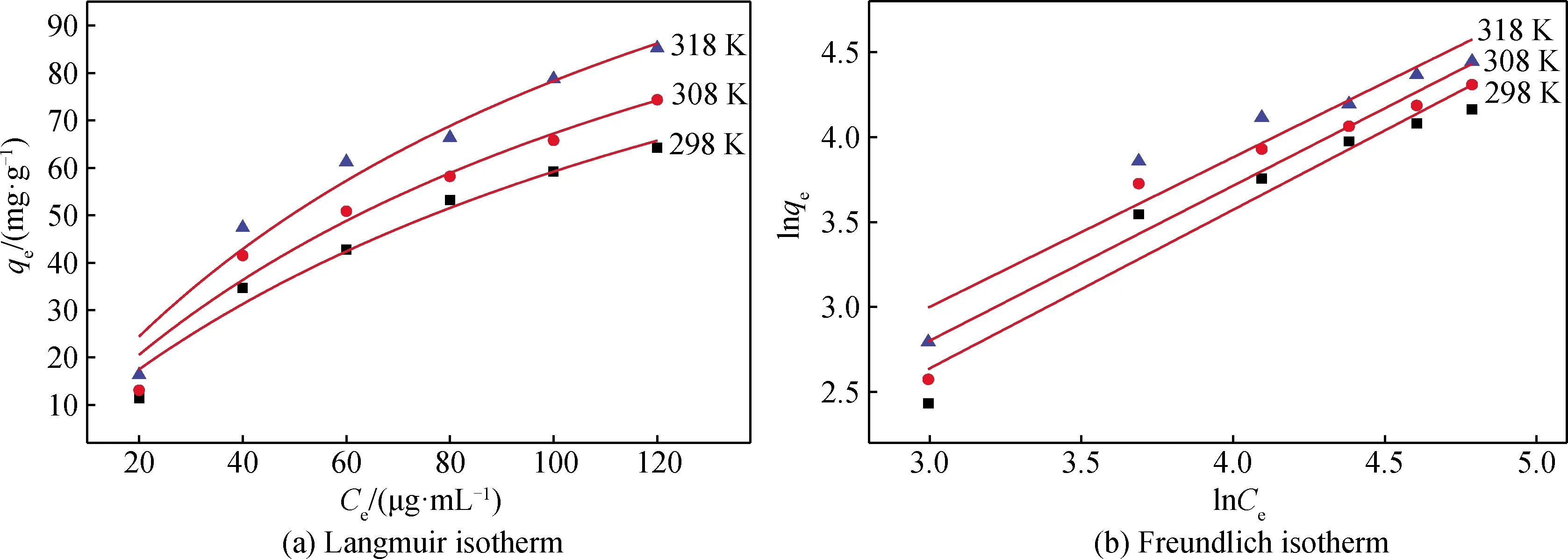
图8 镁铝水滑石对盐酸四环素吸附等温线Fig.8 Adsorption isotherm of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
通过Origin软件进行数据拟合,水滑石对盐酸四环素在不同温度下的吸附常数和相关系数见表2。从表2分析可知, Langmuir等温式更适合描述水滑石对盐酸四环素的吸附行为。
吸附热力学参数有吸附自由能变(ΔGO)、吸附熵变(ΔSO)和吸附焓变(ΔHO),其相互关联式有:
ΔGO=-R·TlnKL
(5)
ΔGO=ΔHO-T·ΔSO
(6)
lnKL=ΔSO/R-ΔHO/(R·T)
(7)
式中:ΔGO为吸附自由能变,kJ/mol;ΔHO为吸附焓变,kJ/mol;ΔSO为吸附熵变,kJ/(mol·K);R为气体摩尔常数,R=8.314 J/(mol·K);T为热力学温度,K。
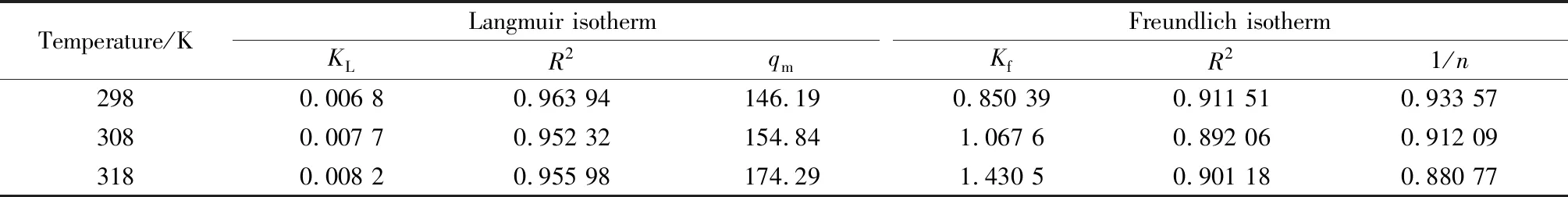
表2 镁铝水滑石对盐酸四环素吸附常数及相关系数Table 2 Adsorption constants and correlation coefficients of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
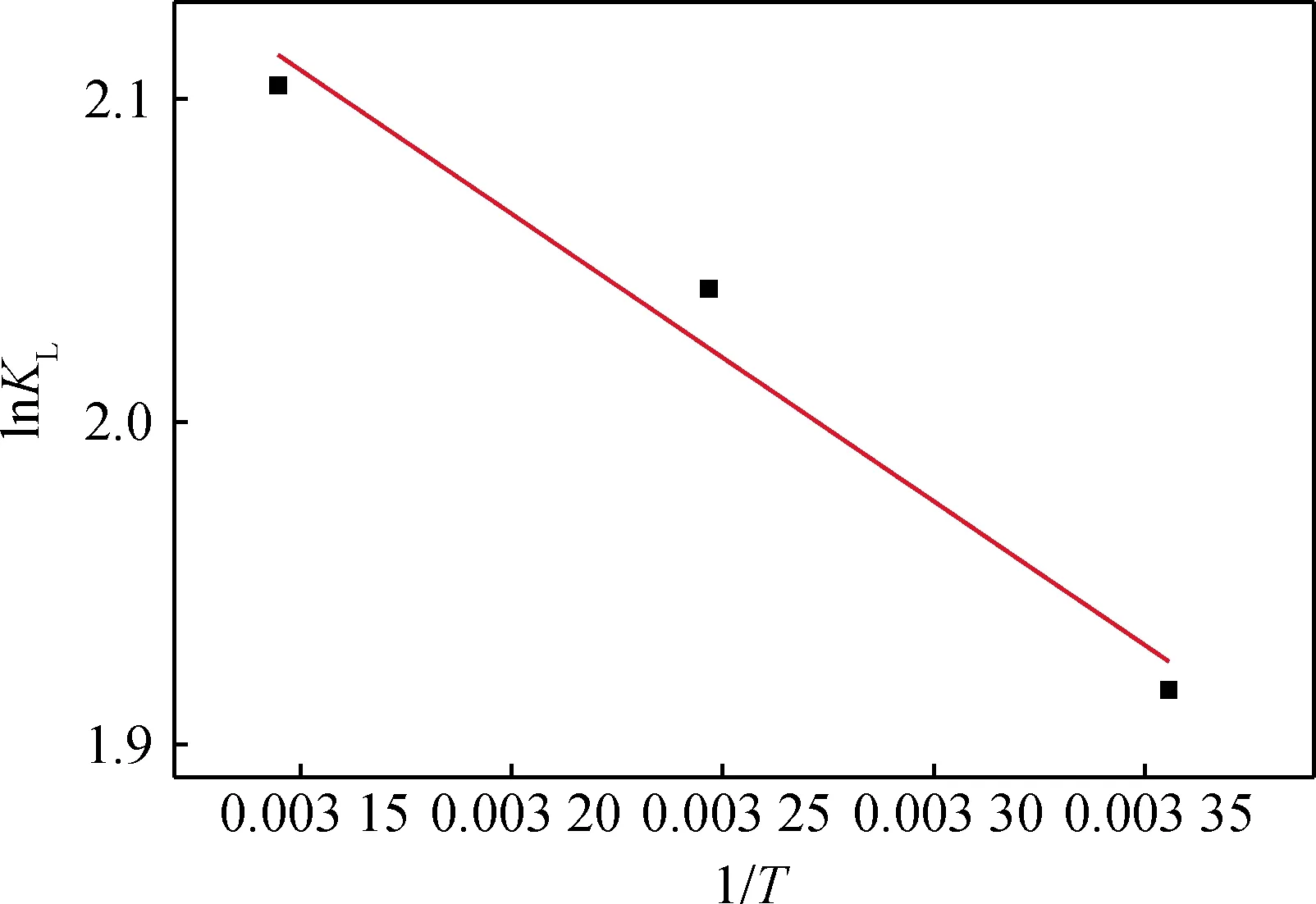
图9 lnKL与T-1 的关系Fig.9 Relationship of lnKL and T-1
lnKL与1/T的关系见图9,通过Origin软件进行线性拟合,拟合曲线的R2为0.943 85,通过上述相互关联式计算ΔGO、ΔSO和ΔHO,见表3。
一般情况下,范德华力引起的ΔHO为4~10 kJ/mol,氢键引起的ΔHO为2~40 kJ/mol,配位基交换的ΔHO为40 kJ/mol,偶极间作用力引起的ΔHO为2~29 kJ/mol,化学键作用力引起的ΔHO大于60 kJ/mol。水滑石对盐酸四环素的ΔHO为7.40 kJ/mol,ΔSO为40.82 J/(mol·K),说明吸附过程以物理吸附为主,既有水滑石与盐酸四环素的分子间氢键作用,也有水滑石层间调控后电子云改变[17]对盐酸四环素的静电吸附,且以静电吸附为吸附主要作用力。从表3可知,ΔGO<0,说明水滑石对盐酸四环素的吸附是自发过程,同时发现ΔHO>0,再次表明反应是吸热反应,与试验结果中温度升高有利于吸附反应的分析一致。

表3 镁铝水滑石对盐酸四环素吸附热力学参数Table 3 Adsorption thermodynamic parameters of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
3 结 论
(1)采用共沉淀法成功制备了硫酸根型镁铝水滑石。当反应时间为12 h时制备的水滑石对盐酸四环素吸附效果较好,吸附率达70.82%。
(2)水滑石对盐酸四环素的吸附过程更适合准一级动力学模型,物理吸附以静电吸附为主,其吸附行为符合Langmuir等温式,其ΔHO为7.40 kJ·mol-1,ΔGO小于0,ΔSO为40.82 J/(mol·K),该吸附是吸热、自发过程。

