氢氧直接合成过氧化氢用催化剂的研究进展
梁海瑞,王涖,刘国柱
(1 中海石油气电集团有限责任公司,北京100028;2 天津大学化工学院绿色合成与转化教育部重点实验室,天津300072)
过氧化氢(H2O2)为无色透明液体,具有较强的氧化能力,氧化过程中,自身生成水,无其他副产物,是一种绿色无污染的强氧化剂[1]。由于工业对过氧化氢有较强的需求,过氧化氢被广泛应用于化学品的合成、印染造纸、污水处理等各个领域。过氧化氢的制备方法主要包括电化学法、蒽醌法、异丙醇法和氢氧直接合成法等[2]。目前,由于蒽醌法安全高效等优势,工业上95%过氧化氢生产方法为蒽醌法,但蒽醌法制备过氧化氢也存在着能耗、环境等问题。直接合成过氧化氢是指氢气和氧气直接反应产生过氧化氢,该反应一般由贵金属催化剂催化,过程的唯一副产物是水。相对于现有的复杂蒽醌工艺,该过程只需一步反应,避免了有害的反应条件、化学品和副产物,是一种清洁的工艺过程,因而在商业上有良好的前景。本文从催化直接合成过氧化氢反应途径、催化用金属、催化用载体等方面,主要总结了近五年来直接合成过氧化氢用催化剂的研究进展。
1 直接合成过氧化氢反应途径
直接催化合成过氧化氢的过程存在4种化学反应(见表1)。对比各反应的吉布斯自由能可看出,H2和O2直接生成H2O的反应、H2O2加氢反应、H2O2分解反应与生成H2O2的反应存在明显的竞争。

表1 直接合成过氧化氢过程中存在的反应
目前,贵金属催化剂是氢氧直接合成过氧化氢反应中使用最多的催化剂。针对贵金属的催化机理研究中,普遍认为H2O2的合成过程存在着以OOH为中间体的两步氢化过程。Lunsford等[4]利用同位素分析直接合成H2O2过程,通过提供18O2/16O2=1∶1,分析发现反应产物中不存在H18O16OH,说明在反应过程中O2并不存在解离,直接合成过氧化氢过程为氧分子与氢原子非解离加氢生成H2O2。目前普遍认为的反应路径为:首先,H2和O2分别在金属颗粒表面吸附;其次,H2在金属表面解离,吸附的O2得到H2解离释放的电子生成中间产物(OOH*,*为反应活性位点);最后,生成的中间产物与解离后的H结合并从金属表面脱附,得到H2O2(见图1)。
2 直接合成过氧化氢催化剂用金属
贵金属催化直接合成过氧化氢的活性金属一般有Pd、Au、Pt 等贵金属以及它们的合金。H2O2合成过程中的活性和选择性与各反应物及反应产物的吸附/脱附能和生成/解离活化能相关。Ford 等[6]基于周期性密度泛函理论(DFT-GGA)计算,采用周期性平板模型(Slab)计算得到若干不同金属的(111)晶面的解离活化能如图2 所示。Pd 和Pt 表面上OOH 中间体和H2O2的解离活化能与H2O2的生成活化能和脱附能相比更低,说明Pt(111)晶面上容易发生O—O键的断裂,使得反应选择性低,而Au表面上H2O2的生成活化能和脱附能比OOH 中间体和H2O2的解离活化能要低,使得Au的选择性较高,然而由于反应物H2和O2在Au 表面的吸附能很高,使得Au反应活性很低。
2.1 单金属Pd催化直接合成过氧化氢
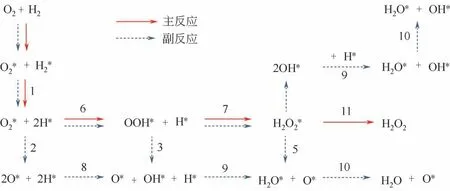
图1 氢氧直接合成过氧化氢反应途径[5](*为反应活性位点)
目前,氢氧直接合成过氧化氢的研究主流为Pd 基催化剂,针对Pd 金属活性位的研究众多。Tian等[7]通过DFT计算分析了Pd金属不同晶面对于反应能垒的影响,发现Pd(111)晶面与其他晶面如Pd(100)、Pd(110)等相比,Pd(111)晶面的配位饱和度更高,Pd(111)表面原子间d 电子轨道重叠较高,靠近费米能级(Fermi level)的电子态密度较小,从而更难反馈给O22π 反键轨道(2π*)电子,使得Pd 表面OOH 中间体和H2O2的解离活化能较高,即O—O键较难在Pd(111)表面解离,Pd(111)晶面具有最高的反应选择性;此外,在Pd 晶面的台阶位如Pd(211)表面的(100)台阶位,O2和H2O2的解离活化能均很低,且H2和O2吸附能很低,使得Pd晶面的台阶位选择性很低。这一结论表明制备高选择性催化剂需要抑制Pd颗粒台阶位(边缘和角落位置)对于O2和H2O2的解离活化。
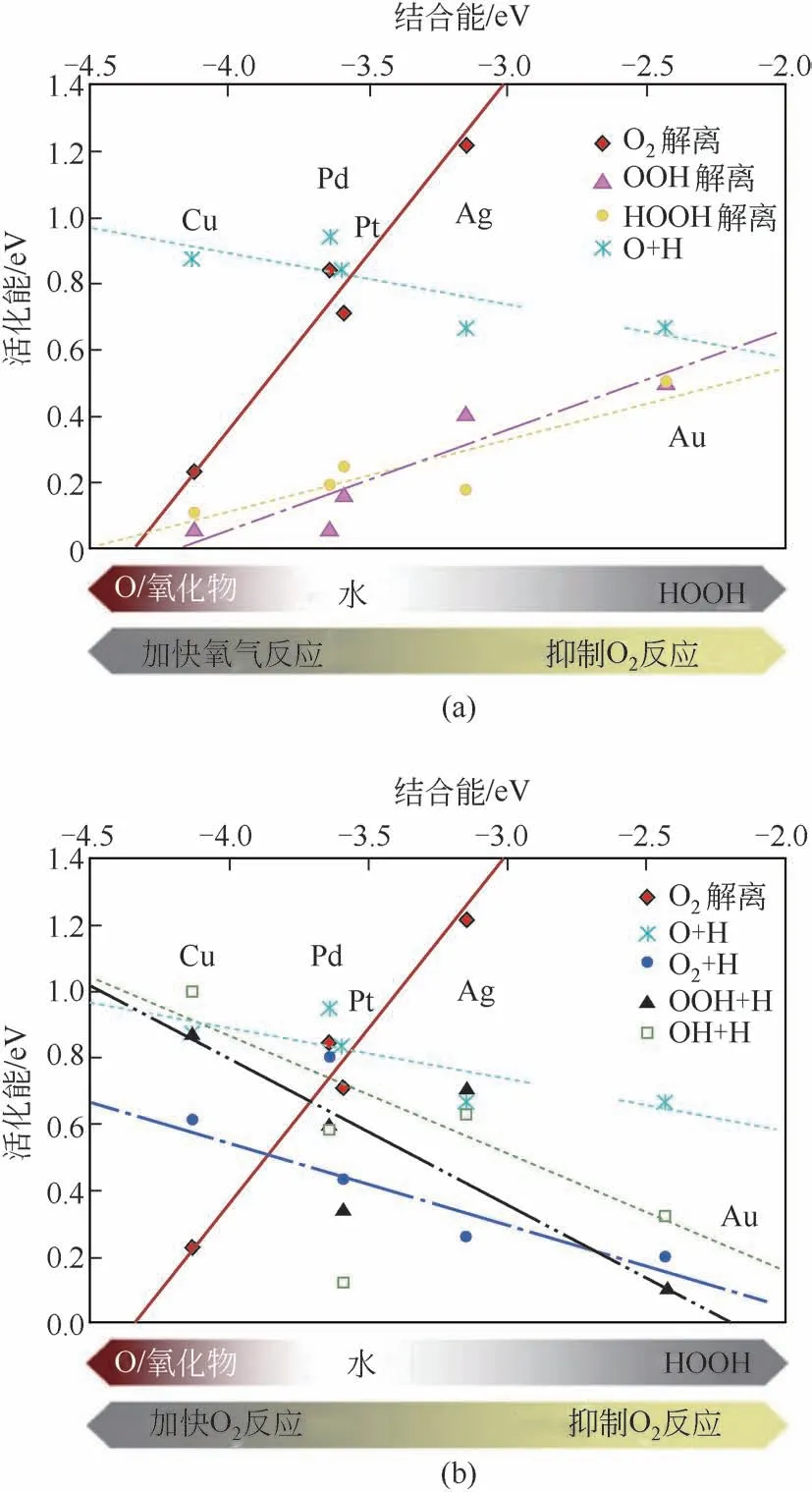
图2 不同贵金属催化合成过氧化氢解离活化能[6]
对于金属Pd直接合成过氧化氢,普遍认为Pd0对于H2和O2有着较强的断键能力,是反应的活性位点。然而,Pd0含量并非越高直接合成过氧化氢催化性能越好,Han 等[8]制备Pd/TiO2催化剂直接合成过氧化氢,在不改变粒径(直径约为2.4nm)的情况下通过Pd负载量(1%~5%Pd,质量分数,下同)精确调整改变Pd 颗粒结构性质,实验表明1.0% Pd 催化效果最佳,其单质Pd 含量为52.4%,H2O2选择性达到了61%,比5.0%Pd(单质Pd含量64.8%)选择性高了20%,他们通过DFT 计算分析认为直接合成过氧化氢的活性位点是Pd-PdO 界面(见图3),不完全还原的Pd 颗粒中存在Pd-O-Pd结构,与Pd0颗粒中的Pd-Pd 结构相比Pd-O-Pd 结构对O2和H2O2的解离活化能更高,使得不完全还原的Pd颗粒与完全还原的Pd颗粒相比合成H2O2选择性提高。

图3 Pd-PdO界面直接合成过氧化氢机理[8](1Å=0.1nm)
2.3 双金属催化直接合成过氧化氢
在Pd基催化剂上引入双金属如Au等,可以有效调变Pd颗粒表面的电荷密度,抑制Pd金属颗粒对O2和H2O2的解离活化,从而提高H2O2选择性。常见的用于直接合成过氧化氢的双金属有Pd-Au、Pd-Pt、Ru-Pd、Ru-Au等[9-12]。
Li等[13]研究了Au-Pd负载于微孔分子筛上的催化直接合成H2O2活性,实验表明2.5%Au-1.8%Pd/HZSM-5 的反应产率达到了138.3mmol/(gcat·h),远高 于4.3% Au/HZSM-5 的 产 率[4.73mmol/(gcat·h)]。Edwards 等[14]制备了Au-Pd 双金属负载于TiO2上用于合成H2O2,实验表明2.5%Au-2.5%Pd/TiO2的反应 产 率 为64mmol/(gcat·h), 高 于5% Pd/TiO2的31mmol/(gcat·h),证实了Au-Pd 双金属催化剂具有更高的催化产率。Nugraha 等[15]通过DFT 理论计算分析了Pd-Hg 合金催化选择性比Pd 更高的原因,DFT 计算表明O2吸附可以发生在超氧和过氧通道,而与Pd 相比Pd-Hg 具有更多的超氧通道;Pd6Hg3/Pd(111)中的Hg使得其具有与Pd(111)不同的电子表面结构和更低的O2吸附能;由于Pd-Hg 表面Hg 的存在带来的几何和电子效应,Pd 金属表面与O2具有很强的表面相互作用,不易断键,所以Pd-Hg合金应用于直接合成过氧化氢具有更高的选择性。
Hutchings等[16]合成了不同比例的Au-Pd-Pt催化剂,得到三种合金的活性三相图(见图4)。研究表明,当比例为2.28%Au-2.28%Pd-0.45%Pt/CeO2时,催化剂具有最高的反应产率[670mmol/(gcat·h)]。总的来说,双金属或多金属合金催化剂相对于单金属催化剂来说有更高的反应选择性,这对于多种金属催化剂用于直接合成过氧化氢的研究具有指导意义。
在Pd 基催化剂的基础上引入其他相对惰性的非贵金属(如Te、Sn 等),也可以有效降低Pd 颗粒边缘角落位点的电子云密度,提高O2和H2O2在其上的解离活化能,从而抑制O2和H2O2解离等副反应提高H2O2选择性。Hutchings 等[17]制备了不同比例的Pd-Sn/SiO2双金属催化剂,并对还原后的催化剂进行了二次氧化,分析测试了还原和氧化前后不同催化剂对于直接合成过氧化氢的反应活性(见图5)。实验结果表明,2.5%Pd-2.5%Sn/SiO2与单金属Pd 基催化剂相比H2O2产率显著更高,说明Pd、Sn 之间存在协同效应;二次氧化后的催化剂与一次氧化催化剂相比,H2O2产率仍稳定在较高水平,而H2O2氢化率降至接近于0,H2O2的选择性最高为95%,说明催化剂中添加适量Sn 产生了显著的协同效应,抑制了H2O2中O—O键的断裂。该作者认为,循环氧化后的催化剂倾向于生成SnO2包封Pd颗粒的结构,使得Pd表面原子电荷密度降低(即配位数升高),有利于提高H2O2选择性。在此基础上,Han 等[18]通过制备Pd-Te 双金属催化剂并采用DFT理论计算分析了Pd-Te双金属颗粒的反应能垒,印证了这一看法。高配位的Pd-Te活性位点与低配位饱和度的Pd 颗粒边角位相比,其O2解离活化的反应能垒更高,对催化剂直接合成过氧化氢的测试也证实了这一计算结果。
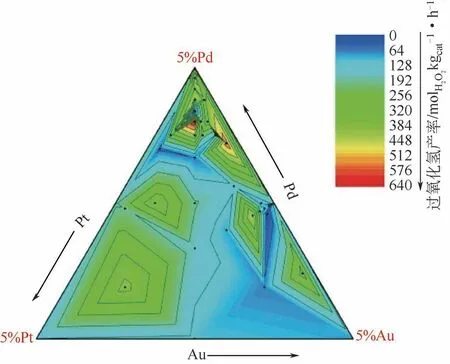
图4 不同组成的Au-Pd-Pt三金属催化剂反应活性[16]
Pizzutilo 等[19]利用电化学的方法对Au-Pd 催化剂进行了改性,通过施加不同的电压,使得Au-Pd颗粒表面的Pd和Au原子以不同的速率溶解在溶液中,得到了不同结构的Au-Pd 颗粒。随着电压的升高,金属表面首先开始解离出Pd,Au 的表面含量增加,再增加电压,Au、Pd 同时析出,但是析出数量上Pd>Au,所以金属会形成Au 壳(如图6所示)。实验表明施加电压为1.6V 时,Au-Pd 颗粒表面形成了Au 包裹的Au-Pd 颗粒,此时直接合成过氧化氢的选择性达到了最高(85%)。
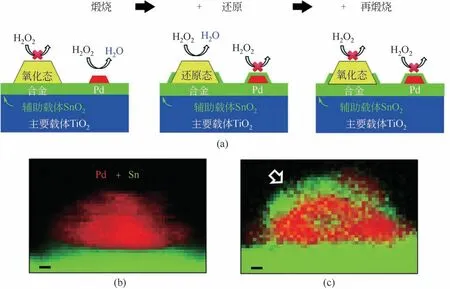
图5 Pd-Sn/SiO2多次氧化还原反应机理(a)、合金煅烧前后Pd、Sn分布对比[(b)、(c)][17]
目前大部分双金属催化剂采用制备策略为同时负载法或覆盖法,前者难以有效覆盖Pd颗粒边缘角落位点,后者覆盖了大部分活性位点使得反应活性急剧降低。Liang等[20]合成了纳米片层状的HZSM-5分子筛,随后按不同顺序负载1.5%Pd和0.5%Au,得到了不同结构的纳米片层状金属催化剂(见图7)。将制备的不同双金属催化剂用于直接合成过氧化氢,分析不同的金属结构对于合成H2O2催化性能的影响。在分子筛限域作用下从纳米片载体片层间引入双金属Au得到双金属纳米片催化剂Au-Pd/ZN,实现区域选择性覆盖Pd纳米片边缘角落位点,可进一步抑制副反应。实验发现,与同时负载的AuPd纳米片催化剂AuPd/ZN 相比,在相同反应条件下,Au-Pd/ZN 的反应转化率较AuPd/ZN 低20%,Au-Pd/ZN 的H2O2选择性相较AuPd/ZN 提高了40.4%,Au-Pd/ZN表现出更高的反应产率。

图6 电化学溶析制备的Au-Pd催化剂[20]
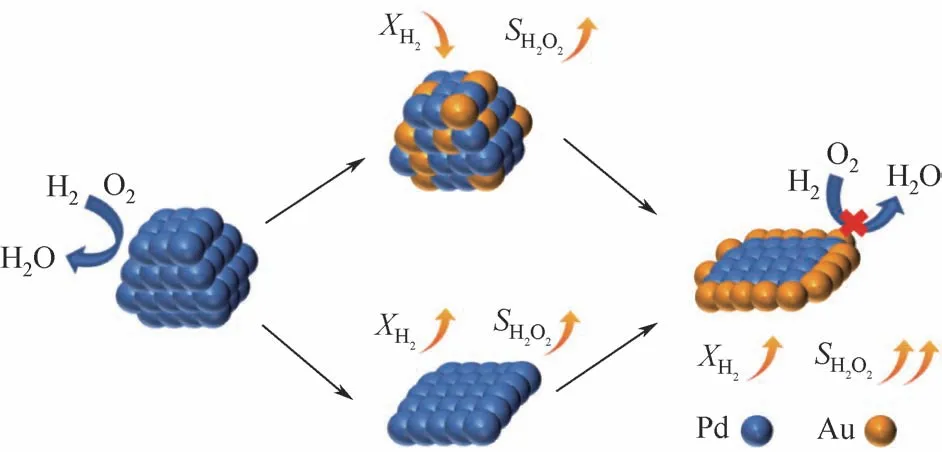
图7 边角位点覆盖Au的双金属AuPd催化剂[20]
3 直接合成过氧化氢催化剂用载体
对于直接合成过氧化氢来说,载体的性质是一个关键因素。在之前的报道中,使用的载体材料有分子筛[21]、金属氧化物[22]、碳材料[23]、SiO2[24]、杂多酸[25]、膜材料[26]等。
3.1 载体酸性
在反应过程中,反应体系的酸性对于直接合成过氧化氢的性能有显著影响。质子酸的存在可以抑制H2O2氢化和直接分解,从而提高反应的选择性[27]。同时,H+的存在可以增强反应的活性,Wilson 等[28]提出了一种类似二电子氧还原(ORR)的理论,认为H+参与了直接合成过氧化氢的中间步骤,可以提高过氧化氢产率(见图8)。他们认为在Pd金属内部存在电子转移通道。H2在Pd颗粒表面吸附断键,氧化生成H+扩散到溶液中;H2氧化生成的电子e-在Pd 颗粒中通过质电通道转移;O2吸附于Pd颗粒表面接受e-还原生成O2-2 后与溶液中H+结合生成H2O2并脱附。该文通过改变溶剂中H+浓度,发现质子对H2O2生成是重要的。然而目前为止还没有进一步的工作验证该理论。
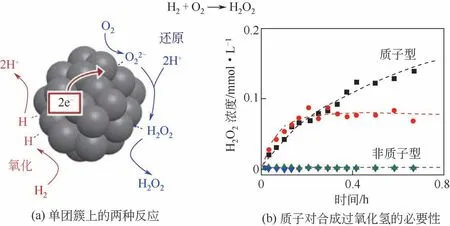
图8 氢离子在合成过氧化氢中的作用[28]
研究中常在溶剂中添加无机酸以提高反应的选择性和活性,但是无机酸的引入会造成活性金属浸出流失、反应器腐蚀等问题,使用酸性载体替代无机酸是目前直接合成过氧化氢研究方向之一。Park等[29]制备了一种SO3H官能化的SiO2载体并负载Pd。实验发现,SO3H 官能团的引入不仅提高了H2O2的收率,还使得在反应过程中不使用无机酸,避免了金属的流失等问题。Kim 等[30]将树脂K2621 接枝含硫烷基长链后,离子交换制备SO3H 官能化树脂后负载Pd 得到Pd/K2621,在持续的半间歇反应中最后得到了8.9%的H2O2,产率为180g H2O2/(gPd·h)。另外一种常见的提高载体酸性的方式是直接使用酸性载体。Hutchings 等[31]制备了Cs 交换的磷钨酸CsxH3-xPW12O40作为固体酸助剂,探究了多种不同酸添加剂对Au-Pd/TiO2(2.5% Au-2.5% Pd,质量分数) 的直接合成H2O2性能的影响,发现ZrO2、HZSM-5、CsxH3-xPW12O40几种助剂能够有效地提高H2O2的产率,这一研究可有效地指导选择直接合成H2O2的载体。
3.2 载体表面性质
除载体酸性外,载体的其他表面性质对直接合成过氧化氢也存在一定影响,如含氧官能团、亲疏水性等。Gudarzi 等[32]研究了含氧基团对影响H2O2催化分解的影响,发现碳载体上含氧表面官能团可以稳定溶液中的H2O2,减少其分解和氢化反应。Blanco 等[33]通过在SiO2表面接枝不同酸性基团发现,接枝羧基Si-COOH 的H2O2选择性为22%,比接枝磺酸基团的Si-SO3H 选择性(55%)显著更低,分析认为Pd 颗粒与磺酸基团的相互作用更强使得反应选择性更高。此外,载体的亲疏水性对反应的影响也不可忽略。直接合成过氧化氢反应过程中气相通过液相体系到达催化剂活性中心,而研究表明溶剂对氢气和氧气的溶解度很大程度决定了反应产率,证明反应受传质影响严重[34]。
Giacomo 等[35]利用十六烷基-2-羟乙基-二甲基磷酸二氢铵(HHDMA)作为Pd纳米粒子的封装剂(见图9)制备了Pd-HHDMA/TiO2用于直接合成过氧化氢。随着HHDMA的加入直接合成H2O2选择性由10% 提升至80%,且与聚乙烯封装相比,HHDMA能够稳定包裹在Pd颗粒外,而聚乙烯随着反应进行有机物流失严重;DFT分析表明,反应形成的中间体H2O2*在金属表面吸附时,在没有配体的情况下,H2O2*与Pd吸附是相对自由的,而有配体时由于配体的静电相互作用,会使H2O2*成键呈垂直状,可以有效地提高副反应的活化能,防止H2O2*与表面接触而分解或者过度氢化。为此,对催化剂金属进行针对性的修改改性,可加快反应的扩散或提高Pd颗粒的O—O键解离活化能,对于提高反应活性和H2O2选择性具有重要意义。
3.3 载体掺杂物
催化剂载体中的掺杂物也会影响直接合成过氧化氢反应。Abate 等[36]研究了N 掺杂的碳纳米管负载金属Pd 和Au-Pd,发现N 掺杂的纳米管载体能够有效的提高Pd 纳米颗粒的分散度和稳定性,提高H2O2的收率,此外N掺杂的基团的引入还能提高催化剂表面的酸性,增强H2O2的稳定性。Hutchings 等[25]利用杂多酸载体掺杂金属阳离子(Cs+、Rb+、K+、Ag+),发现含Cs+、Rb+的催化剂能有效提高H2O2反应活性。
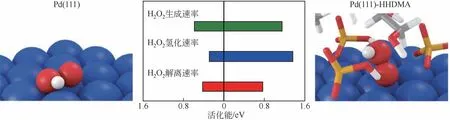
图9 烷基长链作用机理图[35]
3.4 载体结构形貌
载体的结构形貌对催化剂直接合成过氧化氢的性能也会有影响。Song 等[40]通过将Pd 颗粒负载在两种不同的介孔硅分子筛MCM-41 和SBA-15 上,分析了介孔孔径和壁厚对于催化剂性能的影响[见图10(a)]。分子筛MCM-41介孔孔径较窄(2.9nm),负载金属后得到一部分小Pd 纳米颗粒(通道中约2nm)和一部分大Pd 颗粒(位于支撑通道外部,数量少但质量大)。小Pd纳米颗粒表现出极强的反应活性,但是对应的选择性很低,此外MCM-41的薄壁厚度也使得催化稳定性存在一定问题。分子筛SBA-15介孔孔径较大(8.4nm),负载得到的Pd纳米粒子90%处于孔道内,平均粒径在4.5nm 左右,高分散性使得反应活性较高,与负载MCM-41的催化剂相比反应选择性也较高。同时,SBA-15 的适宜的孔径使得溶剂和产物容易扩散,SBA-15 负载型催化剂的较厚壁厚也使得催化剂具有良好的机械稳定性和可重复使用性。
针对载体结构的特异性设计有助于提高直接合成过氧化氢的催化性能。Kim 等[41-42]制备了一种球形SiO2包裹Pd 颗粒的结构Pd@SiO2,[见图10(b)],表征发现该载体负载的金属具有良好的分散性(分散度43%),均一的粒径(约4nm),实验表明Pd@SiO2与Pd/SiO2和Pd/Al2O3相比具有很高的反应活性,说明通过核壳结构提高少配位的Pd 颗粒分散度,进而提高H2O2产率是有效的。Kim等[43]还制备了中空的核壳结构催化剂Pd@Void@ZrO2,实验发现Pd@Void@ZrO2的活性为Pd@SiO2的1.2 倍。Kim 等[43]制备了一种介孔SiO2壳包封的Pd-纳米晶体接枝的SiO2的纳米珠[见图10(c)],在活性测试中壳层越薄直接合成H2O2反应活性越好,但壳层厚度应适当,否则壳层太薄会使Pd 颗粒在煅烧还原过程中发生团聚。实验表明,具有介孔的M(2)活性约为微孔S(2)的4倍。
3.5 金属载体相互作用
不同载体的催化剂直接合成过氧化氢的活性不同也可能是受到金属和载体间的相互作用的影响。Park 等[44]合成了Pd/SiO2和Pd/TiO2用于直接合成过氧化氢,实验发现Pd/TiO2的选择性比Pd/SiO2高,而活性更弱,因为Pd 纳米颗粒与TiO2形成的Pd-O-Ti 相互作用强于Pd-O-Si,使得Pd/TiO2中Pd 表面的电荷更低,电荷密度越低其金属颗粒对反应物的断键能力越弱,使得活性较低而选择性升高。
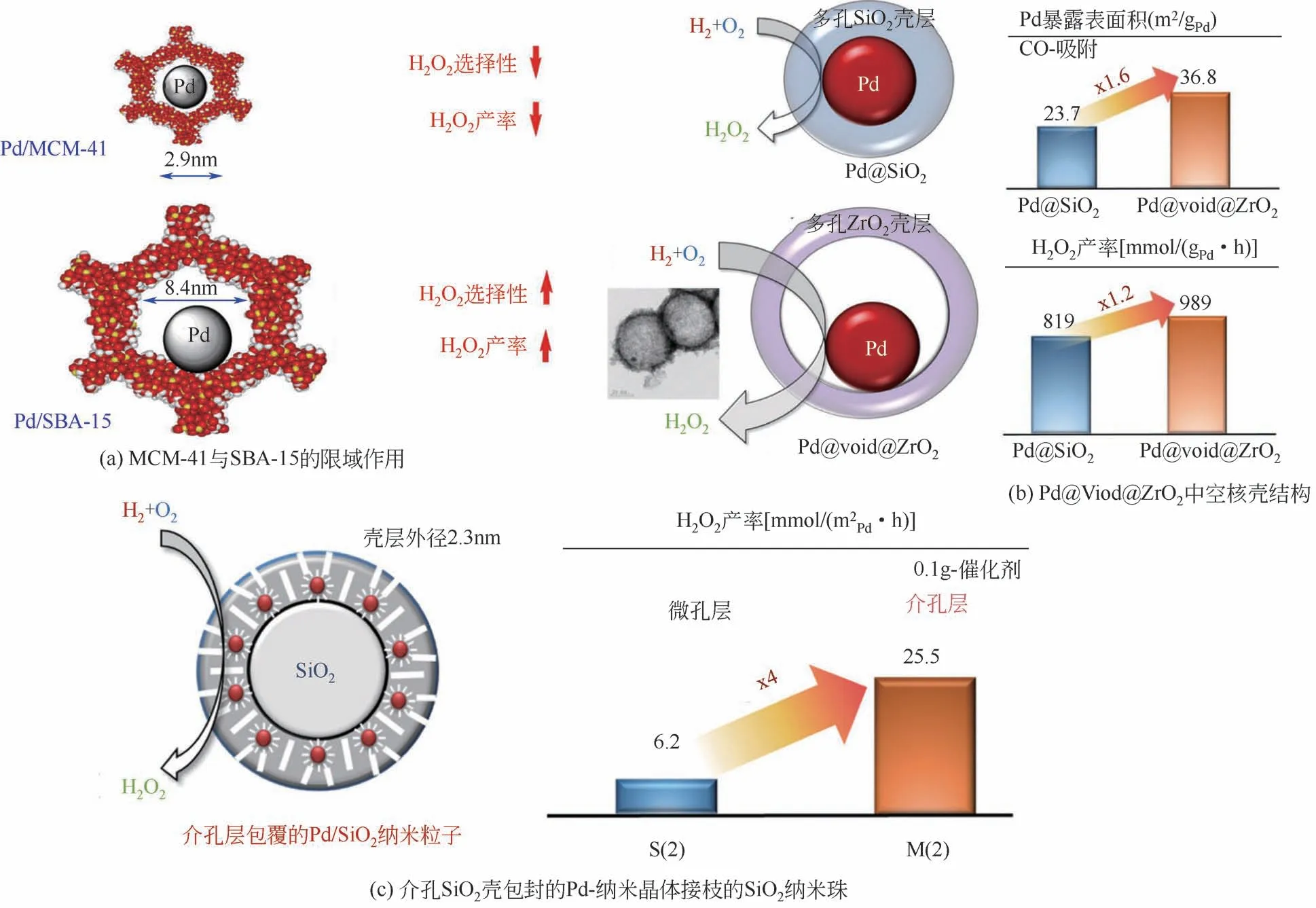
图10 不同载体形貌对反应的影响[40-41,43]
Torrente-Murciano 等[45]合成了嵌入钛酸盐纳米管中的Au-Pd 催化剂0.4% Au-1.5% Pd/Ti-NT,其H2O2产率达到了11600mmol/(gPd·h),而对应的负载型催化剂1.5% Au-1.5% Pd/TiO2的产率仅为430mmol/(gPd·h)。该作者认为纳米管表面的曲率和化学环境对于Au-Pd纳米颗粒的形态和稳定性起到了关键作用,纳米管中高分散的Au-Pd 颗粒(<2nm)与钛酸盐载体间存在着较强的载体和金属相互作用,使得反应活性与选择性均较高。
对于分子筛载体来说,载体酸性位(B 酸位)与金属颗粒在煅烧的过程中结合,形成Pd-O-Si/Al的结构,该结构可以有效的改变金属颗粒表面的电子结构。Liang等[5]通过制备不同硅铝比纳米片分子筛载体(nanosheet HZSM-5)的Pd 催化剂,分析了载体酸性对金属载体相互作用的影响,发现载体酸性位点使得Pd 的XPS 和CO-FTIR 表征特征峰发生了不同程度的偏移,表明载体酸性可以有效改变金属的电子结构,测试直接合成过氧化氢催化性能发现Pd 颗粒表面电荷密度越低,催化选择性越高(见图11)。
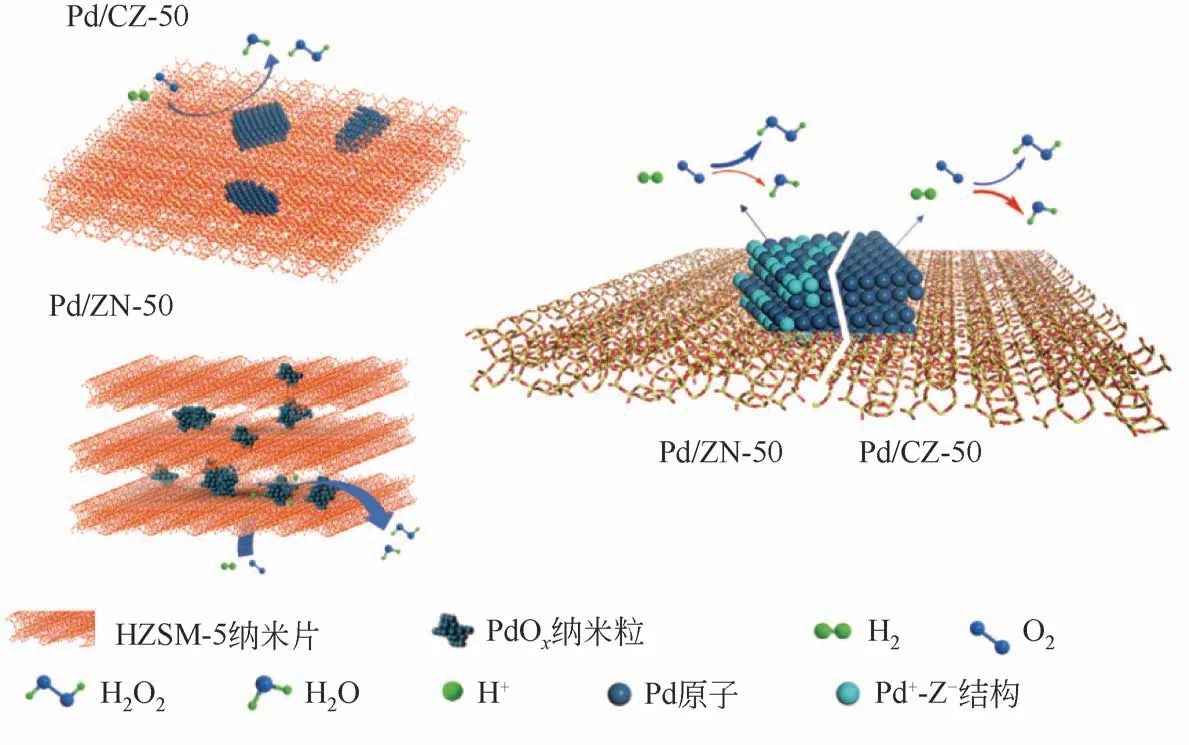
图11 纳米片分子筛催化剂的金属载体相互作用[10]
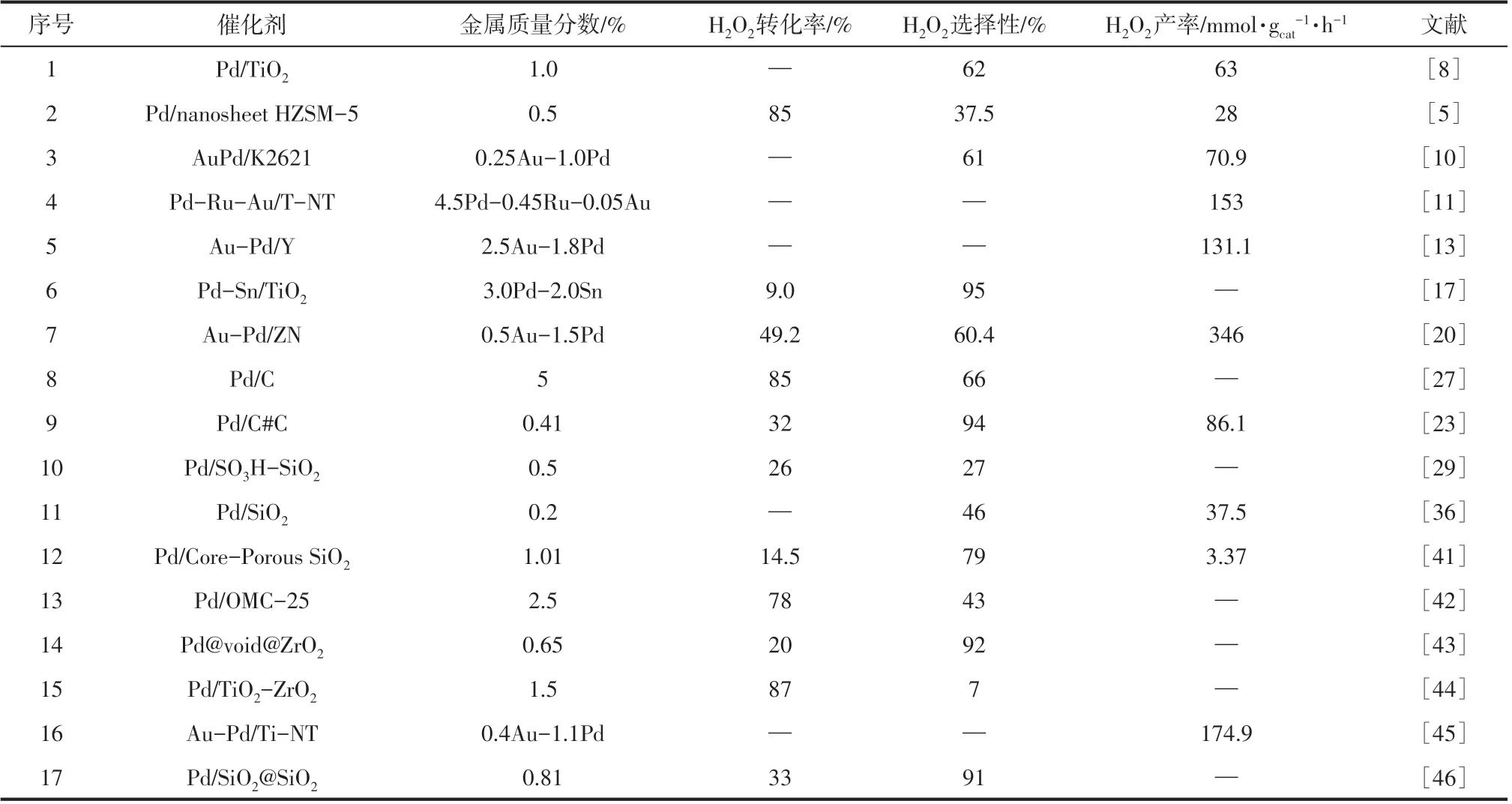
表2 近年来各催化剂直接合成过氧化氢催化性能
总结近年来的各催化剂催化性能(见表2)可看出,目前用于直接合成过氧化氢的催化剂产率普遍较低,仍难以满足工业化的要求。
4 结语
目前,氢氧催化直接合成过氧化氢研究取得了许多重大进展,主要集中在催化机理、催化活性中心、催化载体及改性等方面。过氧化氢合成过程中的活性和选择性与各反应物及反应产物的吸附/脱附能和生成/解离活化能相关,直接合成过氧化氢选择性提高的关键在于提高O2和H2O2的解离活化能,抑制O—O 键的断裂。通过改变金属颗粒尺寸、引入双金属、增强金属与载体相互作用等方式调变活性中心的解离活化能力,能够抑制O2和H2O2的解离活化,提高反应的选择性。氢氧直接合成过氧化氢作为一种绿色合成过氧化氢的方法,目前研究大多仍处于实验阶段,研究和设计高活性选择性的催化剂和适宜的反应体系提高反应产率,对于未来直接合成过氧化氢的工业化应用有着重要的意义。

