肝细胞癌影像诊断的“术”与“道”
——影像技术与病理特征
魏毅,叶铮,蒋涵羽,曲亚莉,张韵,陈婕,魏鸿,姚杉,宋彬
原发性肝癌是全球第六常见恶性肿瘤和排名第三的肿瘤致死病因,其中又以肝细胞癌(hepatocelluar carcinoma,HCC)多见,约占85%~90%[1]。HCC是目前唯一无需术前病理证实、仅依靠流行病史和典型影像征象即可确诊的实体肿瘤[2]。然而,对于部分极早期和早期HCC,往往因缺乏典型的影像征象而致病灶的漏诊;另一方面,对于部分进展期HCC,可出现与其它肝脏肿瘤易于混淆的影像表现,而致病灶的误诊。
时空异质性是不典型HCC影像学表现的微观病理学基础,其主要表现为同一病灶内的不同部位往往具有不同基因组和免疫微环境改变,从而表现出不同的病理学行为特征。基于病理特征的功能影像技术为全方位评估HCC的病理特征提供了可能,不仅可反映肿瘤新生血管生成、肿瘤细胞密度和结构改变,还可反映肿瘤细胞膜的功能、组织代谢和生理状态改变等,为聚焦微观病理特征改变的影像诊断打下基础。
微观病理特征改变是HCC不同影像征象的基础。HCC的诊断不应仅局限于典型的影像学征象,其诊断标准更应围绕反映肿瘤发生、发展过程中不同病理特征改变的影像征象,多维度、全方位地挖掘肝细胞癌异质性的“影像-病理”特征,从而真正实现HCC的个体化精准诊疗。基于此,本文拟结合肝硬化结节多步癌变的多层次病理特征,复习归纳相关功能影像技术进展和HCC诊断新标准,以期加深对影像成像的“术”和所反映的病理层面的“道”的认识和理解。
影像征象的组织病理改变基础
1.肝细胞癌的新生血管生成
肝硬化结节进展为HCC是一个多步骤癌变过程,由再生结节(regenerative nodule,RN)、低级不典型增生结节(low-grade dysplastic nodule,LGDN)、高级不典型增生结节(high-grade dysplastic nodule,HGDN)逐渐演变为HCC,在这一过程中其血供可发生显著改变(图1)[3]。随着肿瘤新生血管生成、血管内皮细胞通透性增加,门静脉供血逐渐减少,异常动脉供血逐步增加并成为主导[3]。多期动态增强扫描可反映肿瘤的新生血管生成和血供改变情况:由于病灶内新生肿瘤血管生成使得肿瘤动脉血流灌注增加,因此在增强扫描动脉期HCC相对于邻近肝实质常表现为明显强化;但在门脉期和延迟期,由于门静脉供血减少,相较于强化的正常肝脏实质,HCC病灶常表现为低强化,此为HCC典型征象“快进快出”的病理基础。
然而,在极早期及部分早期HCC病灶中,新生血管尚未完全形成;而在部分进展期HCC中,则可因无氧糖酵解致肿瘤新生血管的形成过程停止。因此,上述原因可导致部分HCC缺乏典型的强化特征。肿瘤新生血管的定量评估对此类缺乏典型征象HCC的诊断和生物学行为评估至关重要。CT和MRI多期灌注成像技术可通过血流动力学模型定量评估组织的血流灌注、血管通透性和血管外-细胞外间隙的情况,直接反映肿瘤的新生血管生成和新生肿瘤血管面积等。此外,多期灌注成像参数亦可反映如CD31、微血管密度(microvessel density,MVD)和血管包埋肿瘤簇(vessels encapsulating tumor clusters,VETC)等表达情况,有助于探明肿瘤新生血管生成的相关特征改变,并辅助HCC疗效评估及预后判定[4-6]。
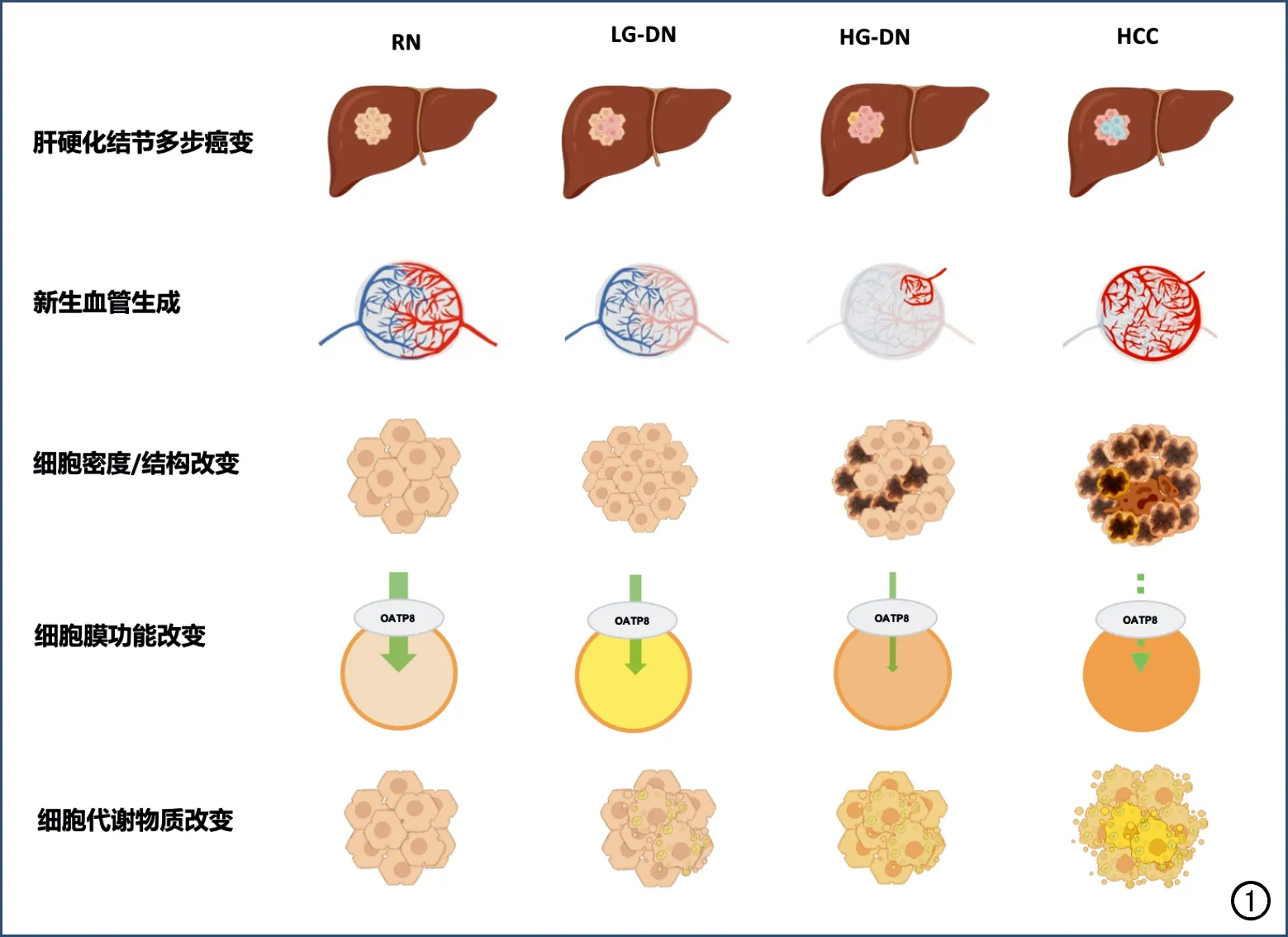
图1 肝硬化结节多步骤癌变过程中主要病理特征改变[3]。
2.肿瘤细胞结构和细胞密度改变
在肝硬化结节多步癌变过程中,肿瘤细胞在增殖过程中逐步发生异型分化和分裂,其细胞形态、结构和密度常随之发生显著改变。癌前结节中肿瘤细胞核可正常或轻度异型,细胞核/细胞浆比值正常或稍高;早期HCC分化良好,癌细胞体积小,排列成细梁状;晚期HCC分化差,细胞核浓染,细胞形状不规则,排列松散,细胞密度可达周围肝实质的两倍及以上。
扩散加权成像(diffusion weighted imaging,DWI)主要反映细胞外水分子的扩散受限程度,当细胞形态(细胞异型化)、结构(细胞核肿大、深染)和细胞密度(细胞分裂加快)发生改变时,细胞外水分子表现为扩散受限,即病灶在DWI图像上呈高信号。研究显示,DWI受限诊断HCC的敏感度为93.07%~98.93%,特异度为43.96%~64.93%[7]。此外,基于DWI不同模型可对肿瘤的细胞密度、细胞结构和细胞外间隙进行准确评估,从而间接反映肿瘤的病理分级、微血管侵犯、肿瘤内淋巴细胞浸润和肿瘤侵袭性等生物学行为。
3.肝脏细胞膜功能改变
肝脏细胞的种类多样、功能复杂,细胞膜上有多种信号通路和受体,这为特异性对比剂在肝脏成像方面的应用提供了基础。目前广泛应用的肝脏特异性对比剂钆塞酸二钠(gadoxetate disodium,Gd-EOB-DTPA),不仅具有如其它细胞外对比剂缩短T1弛豫时间的动态增强效果,更重要的是,对于正常功能的肝细胞,约有50%的对比剂可被细胞膜表面的有机阴离子转运多肽(orga-nic anion transporting polypeptide,OATP)摄取而进入肝细胞内,再以多耐药相关蛋白(multi-drug resistance protein,MRP)为载体由胆道系统排泄。但是,对于肿瘤细胞其细胞膜功能异常或缺失,无法通过细胞膜受体摄取造影剂,在肝胆期(hepatobiliary phase,HBP)相对背景肝实质而表现为低或稍低信号。有研究显示,HBP低信号诊断HCC的敏感度达94.65%~99.64%,特异度为54.36%~74.35%[7]。对于肝脏病灶的诊断,肝胆期扫描的真正价值在于对再生结节、高度不典型增生结节和早期HCC的鉴别,对于肝胆期呈低信号的高危结节,2年内进展为HCC的概率为85%,故此征象常可用于早期高危肝结节的筛查。此外,基于肝胆特异性对比剂的对比增强扫描还可对肿瘤的生物学行为、Wnt/β-catenin 通路及HCC早期复发和预后预测等进行评估,提高对HCC全程的管理水平。
4.肝脏代谢物质的改变
肝脏是人体最重要的物质代谢器官,在HCC的发生和发展过程中常伴随着代谢物质的改变,如脂肪代谢、铁代谢等,故可通过定量影像手段进行精准评估。肿瘤细胞内无氧糖酵解增加、肿瘤内乏氧,可进一步导致脂代谢异常、致脂肪变性和肿瘤内脂粒沉积。故高危结节内出现脂肪相关影像征象,可提高HCC诊断的特异度。质子密度脂肪分数(proton density fat fraction,PDFF)的定量测量是基于人体组织内脂肪质子比水质子进动频率慢3.5 ppm的化学位移现象,运用水脂分离技术,能够定量分析肝脏的脂肪含量,且具有无创、准确和可重复性高等优势,有望取代目前的金标准即病理活检[8-9]。另一方面,肝脏是人体最大且最重要的贮铁器官,多种病因可引起铁过载,致肝细胞损害和肝功能异常,进而促使肝纤维化、肝硬化及HCC的发生、发展[10-11]。铁具有顺磁性,可增加驰豫率,缩短驰豫时间、尤其是T2弛豫时间。可以利用T2*-mapping技术、磁敏感加权成像技术或定量磁化率图技术测得的T2*和R2*等定量参数值的变化来反映肝脏铁代谢情况。

图2 HCC患者,男,43岁。a)T1WI示肝右后上段内有一圆形结节呈低信号(箭);b)T2WI示结节呈高信号(箭);c)DWI示结节呈明显高信号(箭);d)ADC图示结节呈低信号(箭);e)增强后动脉晚期示结节无明显强化(箭);f)门脉期示结节信号低于周围肝实质(箭);g)延迟期示结节信号稍低于周围肝实质(箭);h)肝胆期示病灶呈低信号(箭)。基于传统“快进快出”的诊断标准,本例的MRI表现不足以诊断为HCC,而采用“HBP低信号+DWI高信号”的诊断标准可诊断为HCC,术后病理证实该结节为中~低分化HCC。
肝细胞癌诊断标准的探讨
1.各指南中的HCC诊断标准
目前常用的肝细胞癌诊断标准主要包括我国卫生健康委员会发布的原发性肝癌诊疗规范(2019年版)、美国放射学院提出的肝脏影像报告及数据系统(Liver Imaging Reporting and Data System,LI-RADS)、欧洲肝病研究学会提出的肝癌诊疗指南,其诊断流程中均将“快进快出”的强化方式作为诊断依据。相较于LI-RADS等西方指南更注重HCC诊断的特异度,亚太地区HCC的主要危险因素为病毒性肝炎,故诊断重点为提高HCC诊断的敏感度。2017版亚太肝脏研究学会指南中推荐Gd-EOB-DTP增强扫描作为HCC的一线检查方法,在非典型“快进快出”强化方式的病灶中,HBP低信号可作为诊断HCC的重要依据[12]。
2.HCC影像诊断新标准
现有的HCC诊疗指南中,推荐将“快进快出”作为HCC的诊断标准。但对于部分不具有典型征象HCC,采用基于微观病理改变的影像征象,对肿瘤的早期检出、诊断则至关重要。近年来,随着功能影像的不断发展,一些基于微观病理改变的功能影像诊断标准相继提出。Choi等[13]采用动脉期高强化+肝胆期低信号作为新的诊断标准,对直径小于2 cm HCC的诊断敏感度显著高于欧洲肝病研究学会(European Association for the Study of Liver,EASL)制订的诊断标准(83.0% vs. 74.5%,P=0.008),特异度与之相当(76.7% vs. 81.1%,P=0.125)。Kim等[14]将“廓清”征象延长至过渡期或肝胆期来诊断HCC,获得了较高的敏感度[移行期(transitional phase,TP):90.9%;HBP:95.2%;门脉期(portal venous phase,PVP):75.3%],且特异度并未显著降低(TP:82%;HBP:82%;PVP:94.1%)。Joo等[15]的研究中将“廓清”征象延长至肝胆期,诊断HCC的敏感度为93.8%,显著高于仅将“廓清”征象定义至移行期(86.6%)和门脉期(70.9%)。新的诊断标准将“廓清”征象延伸至“TP低信号”和“HBP低信号”,可提高诊断HCC的敏感度。但相较于门脉期或延迟期的“廓清”,“HBP低信号”所揭示的“放射-病理”有本质差异,前者主要基于肿瘤的异常引流血管生成,本质上仍然反映的肿瘤的血供,而后者是由于HCC细胞的细胞膜表面OATP表达下降或缺失导致对比剂摄取减少或不摄取,主要反映的是功能的改变。
仅依靠“HBP低信号”征象亦不足以实现对HCC的最优诊断,尤其是对部分早期高分化HCC,可导致假阴性结果。DWI可反映细胞密度和结构改变,HBP低信号+扩散受限两个征象的联合应用,在保证HCC诊断特异度的同时,显著提高了诊断的敏感度(图2)。Song等[7]在一项前瞻性研究中发现, 联合应用HBP低信号+DWI高信号作为新的诊断标准,诊断HCC的敏感度为92.57%~93.71%,特异度为74.44%~82.22%。Renzulli等[16]采用肝胆期低信号+动脉期高信号+扩散受限作为诊断标准,其诊断HCC的敏感度与美国肝病研究学会(American Association for the Study of Liver Diseases,AASLD)影像学标准(动脉期高强化+门脉期廓清)比较有显著提高(96.0% vs. 76.4%,P<0.001),特异度则与之相当(91.8% vs. 98.6%,P=0.063)。此外,该诊断标准能够准确鉴别早期HCC与HGDN,其诊断HGDN的敏感度和特异度分别高达94.7%和99.3%。
总结和展望
“术”是方法、“道”是准则。利用功能影像学成像技术对多种微观病理改变进行精准量化和可视化分析,此为HCC影像评价的“术”;基于肝硬化高危结节多步癌变其真实微观病理改变特征,为HCC高危人群筛查与监测、早期诊断、严重程度评价和临床决策提供准确、稳定和可靠的依据,此为HCC影像评价的 “道”。建立和健全HCC的全程管理需要“术”与“道”相结合,方法与准则的统一,才能最终推动临床实践,使患者获益。
展望未来,需持续聚焦于HCC发生、发展的关键病理过程,探索各种成像技术,尤其是基于肿瘤功能、代谢的影像新技术,多维度、全方位监测和反映HCC肿瘤异质性中的潜能和价值,建立基于“影像-病理”的HCC诊断体系。此外,应注重高阶影像学量化方法的应用和推广,更加积极地运用影像组学和人工智能等技术手段深入挖掘影像学信息,以构建稳定、高效和可靠的HCC智能分析影像平台,为提升对HCC诊断效能、辅助临床治疗决策、改善患者生存预后及推动肿瘤个性化精准治疗提供有力支撑。

