儿童系统性红斑狼疮合并巨噬细胞活化综合征1例及文献复习
张 曼 张甜甜 葛畅畅 马莹莹 王丙增▲
1.河南大学第一附属医院儿科,河南开封 475000;2.郑州大学第一附属医院儿科,河南郑州 450000
巨噬细胞活化综合征(macrophage activation syndrome,MAS)是自身免疫性疾病的特殊并发症,因与家族性和病毒相关性噬血细胞淋巴组织细胞增生症有十分相似的临床免疫学及病理生理现象,目前归类于继发性噬血细胞综合征范畴[1],临床上,MAS患者表现为持续高烧、全血细胞减少、肝脾肿大、肝功能损伤、神经系统损害、凝血功能异常和铁蛋白水平急剧升高等,骨髓穿刺可见分化良好的巨噬细胞噬血现象[2]。目前,儿童系统性红斑狼疮(systemic lupus erythematosus,SLE)并发巨噬细胞活化综合征(SLEMAS)的病例少见报道,现将1例SLE-MAS患儿诊治过程、随访及相关文献分析报道如下。
1 临床资料
患儿女,7岁,体重21 kg,因“间断发热1月”于2019年9月30日入郑州大学第一附属医院,体温38.2℃~39℃,伴面部红斑。外院查类风湿因子(RF)697 IU/mL,抗核抗体1:320,抗dsDNA 阳性,红细胞沉降率(ESR)、C-反应蛋白(CRP)、肝酶升高,给予丙种球蛋白1 g/(kg·d)×3 d、甲泼尼龙针×3 d(具体计量不详)及抗感染等药物治疗,体温控制不佳,患儿既往史、家族史无特殊。入院查体:双侧面颊部可见蝶形红斑,双侧颈部淋巴结肿大,最大约15 mm×10 mm,无压痛,肝脏肋下5 cm,脾脏肋下4 cm,无压痛,余查体未见明显异常。
入院后完善免疫学检查:RF-IgM型100.11 U/mL,RA33 抗体68.1 IU/mL,抗核抗体1∶320,抗MCV56.77 IU/mL,抗dsDNA 抗体767.0 IU/mL,抗核小体抗体及pANCA 阳性(+),CoombC3 抗体阳性(+);病原学:支原体滴度1∶320,EBV-IgG、CMV-IgG 阳性,T-SPOT 阴性;肾小管功能:NAG25 IU/L,尿RBP 2.8 mg/L;尿常规:蛋白弱阳性;凝血六项、肾功能、电解质等无明显异常(余检验结果见表1);骨髓及外周血涂片示:部分红细胞呈缗钱状排列;胸部CT 示:左肺下叶轻度炎症,双侧腋窝下多发肿大淋巴结;腹部彩超示:肝脾稍大;脑MRI、心脏、泌尿系彩超未见异常;肾脏穿刺示:轻度系膜增生性狼疮肾炎(Ⅱ型LN)。诊断:①系统性红斑狼疮;②Ⅱ型LN。
患儿入院后暂给予抗感染及对症治疗,排除禁忌症后于第3 天开始小剂量激素应用,患儿仍有持续发热,查体无特殊变化,于第9天(D9)复查相关指标(表1),据SLE 合并MAS的初步诊断指南(表2),考虑合并MAS,给予甲泼尼龙针[15 mg/(kg·d)]冲击3 d(D12),患儿仍有发热,给予丙球蛋白(10 g×3 d)及甲泼尼龙针[4 mg/(kg·d)×4 d](D16),患儿体温降至正常,激素逐渐减量至1.5 mg/(kg·d),期间动态监测患儿实验室指标变化(表1),共治疗20 d(D20),患儿未再发热、皮疹较前消退,实验室指标明显好转,给予办理出院。出院后规律复诊(1次/个月),共随访3个月,患儿SLE 无活动,SLEDAI评分2分,血尿常规、CRP、血沉、肝肾功能、免疫球蛋白等未见明显异常,激素逐渐减量至1 mg/(kg·d),规律应用羟氯喹、钙剂等药物。

表1 SLE 并发MAS患儿实验室检查结果
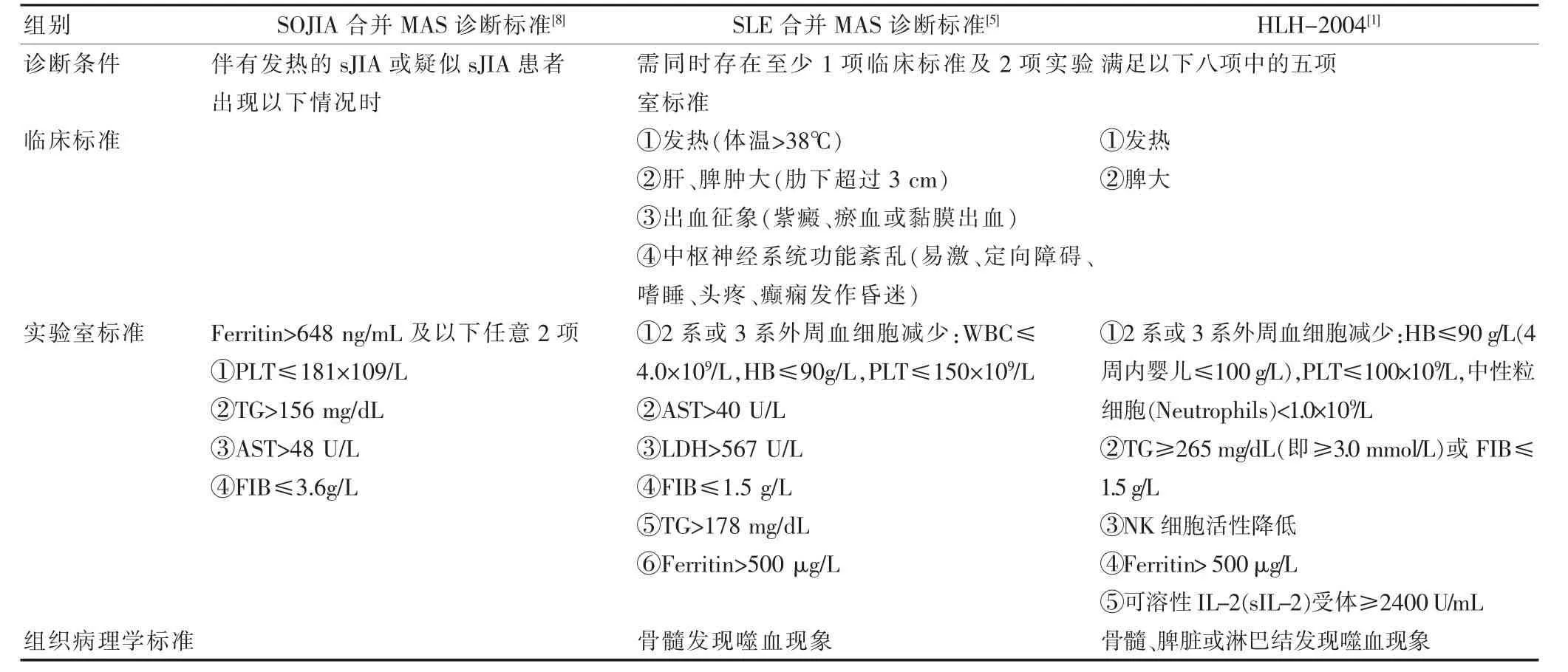
表2 MAS 相关诊断指南
2 讨论
目前MAS的确切发病机制尚不完全清楚,研究表明T淋巴细胞和分化完好的巨噬细胞的增生和过度活化是MAS的发病基础[3],可能机制有:①NK 细胞的活性降低,影响抗原的呈递和处理,抗原大量增生使CD8+T 细胞凋亡受抑,造成淋巴细胞大量增生;②穿孔素基因缺陷导致持续的淋巴细胞活化;③淋巴细胞的过度活化产生细胞因子刺激巨噬细胞的增生,从而释放大量炎症因子,造成MAS的临床表现[4]。
MAS 缺乏特异的病理及实验室特点,目前临床中大多沿用国际组织细胞协会2004年修订的HLH诊断指南(HLH-2004)[1]以确诊,但临床中发现其对MAS的敏感性差且存在许多局限性,据统计约有33.3%的MAS患者经骨髓穿刺证实存在巨噬细胞嗜血现象,但不符合HLH-2004诊断标准[5]。2009年Parodi 等[5]通过对SLE-MAS 实验室指标的统计分析,提出了儿童SLE-MAS的初步诊断指南(表2),相比HLH-2004 新增了神经系统功能异常、AST 及LDH 等指标,并放宽了诊断条件。本例患儿间断发热1个月入院,有光过敏史,双颊部可见蝶形红斑,颈部淋巴结肿大,脾大,入院查抗核抗体、RF-IgM、抗dsDNA 抗体滴度升高,pANCA 及溶血实验阳性,均符合1997-ACR[6]及2012-SLICC[7]的标准,诊断为SLE,并经肾穿证实为Ⅱ型LN。给予激素及免疫抑制剂等治疗过程中患儿临床症状无明显好转,考虑并发MAS可能并复查相关指标(表1),此时(D9),根据SLE-MAS 指南患儿已符合MAS 诊断,但并不满足HLH-2004 指南的诊断标准。此外,2016年Ravelli 等[8]提出了SOJIAMAS的诊断指南,为该疾病早期诊断提供了有效的初步证据并得到广泛的认可,但是该诊断标准是否适用于SLE-MAS 尚不明确。
临床中SOJIA-MAS 指南对MAS 似乎有更高的灵敏度,原因之一为FIB 临界值设定于正常范围内,这是由于活动性JIA患儿PLT及FIB水平通常较正常水平高[8]。然而SLE的病理过程中也存在凝血功能激活状态,研究发现其FIB、D-二聚体水平有明显增高现象[9],这可能与白介素-6(IL-6)等细胞因子水平增高及疾病活动度有关[10],因此猜想是否同样存在更适于SLE-MAS患者的FIB 临界值提高SLE-MAS 指南的灵敏度,但目前仍需大量实验数据验证。另一方面,实验表明MAS 中发热是敏感度最高的症状,FIB是灵敏度和特异性最高的实验室指标[11],在SOJIASLE 指南中发热就被作为先决条件,且为唯一的临床症状标准,FIB 水平被定为强制性指标,这也大大提高了其诊断的灵敏性。但是,Parodi 等[5]发现该指南对于SLE-MAS 诊断的特异性较低,在不伴有MAS的活动性SLE 中高达71%患者符合此指南中MAS 诊断。此外,由于骨髓嗜血现象滞后且并不见于所有患者,因此在三个指南中都不作为必须条件,对于诊断困难的疑似病例可能需行多次骨髓学检查。
目前儿童SLE-MAS的治疗尚未统一,多数临床医生首选甲泼尼龙冲击治疗,对激素反应不佳者联用环孢素(CSA),研究发现CSA 不仅能迅速控制症状且可减少激素的用量[12],此外,CSA 也是治疗SLE 和顽固性SOJIA的候选药物。由于人免疫球蛋白(IVIG)在病毒感染导致的HLH 有确切疗效,且为HLH-2004中推荐的支持治疗方案,故在SLE-MAS 中也可考虑应用,本病例患儿在SLE 治疗过程中并发MAS 并立即给予大剂量激素冲击治疗3 d,临床症状及实验室检查无明显好转,随后给予IVIG 静脉应用3 d,患儿体温正常,实验室指标逐步下降,也提示IVIG 在治疗SLE 合并MAS 中有益。对于危重症者,可参考HLH-2004 指南中免疫化学治疗方案,即实施免疫抑制(CSA)、控制炎症反应(DXM)和诱导细胞凋亡(VP-16)综合治疗[1],但VP-16 具有潜在的肝脏毒性,选用时需谨慎权衡利弊,此外,由于细胞因子风暴是包括MAS 在内的原发性和继发性HLH 共同的病理特征,因此,针对特定细胞因子的生物治疗可能成为未来的研究趋势[3,13-14]。研究表明SLE-MAS的预后与黄疸、严重贫血、血小板减少及血清Ferritin 水平、DIC 等因素相关[15],本例患儿虽疾病早期即并发MAS,血清Ferritin 水平显著升高,但无严重贫血、黄疸、DIC 等,目前小剂量激素联合羟氯喹应用,且随访中SLE 基本无活动性,提示预后可,但临床中不乏预后差及死亡病例报告[16-17],分析可见其均有较严重的多脏器损伤或凝血功能障碍,多需联合CSA 甚至VP-16 控制病情,由于SLE 本身即可引起的多系统功能障碍表现为上述实验室指标异常,且观察发现SLE-MAS患者往往对SLE的加强治疗反应良好[15],因此,加强SLE疾病的控制,对SLE-MAS的治疗也十分有益。
对于MAS,准确识别是给予对应治疗方法的前提,在临床诊断中其易与风湿性疾病本身的高活动性及感染性并发症相混淆[18],结合目前有关MAS的诊断指南来看,当SLE患者出现不明原因的发热和细胞减少时,应评估血清Ferritin指标,警惕MAS的发生,在出现典型的临床和实验室特征的情况下,可不通过骨髓嗜血现象进行诊断确认。早期明确诊断,给予大剂量糖皮质激素冲击联合免疫抑制剂、IVIG 等药物,可控制病情进展,但由于基础疾病的存在以及环境触发机制(感染、药物),因此,治疗方案必须个体化评估,并适时调整。

