姜黄素口服纳米晶胶囊的制备及体内外评价
彭一凡,王增明,王荣荣,2,杜祎萌,高 翔,郑爱萍*,张 慧**
(1军事科学院军事医学研究院毒物药物研究所,北京100850;2华北理工大学药学院,唐山063210)
姜黄素(curcumin)是从姜黄中提取的一种多酚化合物,具有抗炎、抗氧化、抗肿瘤和抗菌等多种药理活性,且迄今为止尚未发现明显的不良反应,在预防和治疗多种疾病方面具有很大的潜力[1-6]。然而,姜黄素属于BCSⅣ类药物,在pH 5.0的缓冲液中饱和溶解度仅为11 ng/mL,其难溶性为阻碍生物利用度提高的限速步骤,严重制约了姜黄素的临床应用[7]。为了解决药物难溶性问题,采取了各种策略来提高溶出度,包括使用增溶剂、助溶剂、络合剂、成盐和缩小粒径等[8-17],其中能减小药物颗粒尺寸的纳米晶技术由于其各种优势受到了制剂研究者的青睐[18]。
目前纳米晶的制备技术主要分为Top-down技术、Bottom-up技术和二者联用的组合技术,其中Top-down技术里的介质研磨法由于操作简单、易于扩大生产且制得的纳米晶粒径分布窄等优点,成为目前上市纳米晶药物最常用的制备方法[19-21]。本研究旨在利用介质研磨技术制备稳定的姜黄素纳米晶混悬液,并经过固化制成口服胶囊,以提高口服姜黄素的溶出度和生物利用度,充分发挥姜黄素在治疗多种疾病上的药理活性优势,为其临床应用提供理论支撑。
1材料
1.1 药品与试剂
姜黄素(陕西亿康龙生物技术有限公司);微晶纤维素(MCC)丸芯(日本旭化成株式会社);蔗糖(湖南九典宏阳制药有限公司);吐温80(太仓制药厂);聚维酮K30(PVPK30)、羟丙基甲基纤维素E5(HPMC E5)(北京凤礼精求医药股份有限公司);十二烷基硫酸钠(SDS,上海麦克林生化科技有限公司);羟丙基纤维素-SL(HPC-SL,日本曹达株式会社);β-葡萄糖醛酸苷酶(美国Sigma公司);多库酯钠(Doss,东莞市东岳葡萄糖厂有限公司);其他试剂均为市售分析纯。
1.2仪器
Nano-ZS90激光粒度仪、Mastersizer 2000粒度分析仪(英国Malvern公司);ECM-AP 05研磨机(华尔宝机械有限公司);RC806D溶出试验仪(天津市天大天发科技有限公司);UltiMate 3000高效液相色谱仪(美国Thermo公司);LCMS-8060液相质谱联用仪(日本岛津公司);D8 Advance X射线粉末衍射仪(德国布鲁克公司);DSC 200F3差示扫描量热仪(德国Netzsch公司);JSM-7900F场发射扫描电子显微镜(日本电子株式会社);WBF-IG多功能流化床(重庆英格造粒包衣技术有限公司);BT-25S电子分析天平(德国Sartorius公司)。
1.3动物
SD大鼠,雄性,体重200~230 g,购自北京科宇动物养殖中心,许可证号:SCXK(京)2018-0010。本文涉及的动物实验经军事医学研究院动物伦理委员会批准,审查编号IACUC-DWZX-2020-639。
2方法
2.1 姜黄素纳米晶胶囊的制备
采用介质研磨技术制备纳米晶混悬液中间体,并以蔗糖为固化保护剂,经流化床底喷包衣得到载药微丸后灌装胶囊,制备过程主要包括纳米晶混悬液的制备及固化两部分。
2.1.1 纳米晶混悬液的制备 参考上市纳米晶药物的处方,初步确定待筛选稳定剂PVP K30、SDS、吐温80、HPC-SL、HPMC-E5和Doss。称取处方量的稳定剂溶于水180 mL中获得稳定剂溶液,将姜黄素20 g均匀分散于稳定剂溶液中,将上述混悬液转移到研磨机中(填充0.3 mm氧化锆珠),开启研磨机将转速缓慢升至3 000 r/min,研磨得到所需粒径的纳米晶混悬液。设计制备了不同处方的姜黄素纳米晶混悬液,以得到的混悬液放置稳定性为考察指标筛选处方。
2.1.2 固化 姜黄素纳米晶混悬液中加入与姜黄素等质量的蔗糖,搅拌混合均匀,得到含蔗糖的纳米晶混悬液。采用流化床底喷工艺将混悬液中的纳米晶负载到MCC空白丸芯(0.5~0.7 mm)上,工艺参数如下:风量30 m³/h,进风温度80℃,物料温度40~45℃,雾化压力1.8×105Pa,混悬液泵速5 r/min。混悬液泵入结束后,流化床中继续风干20 min,收集纳米晶载药微丸并进行胶囊灌装。
2.2 纳米晶的粒度和Zeta电位
取适量制得的姜黄素纳米晶混悬液,以蒸馏水稀释至合适浓度,采用粒度分析仪测定姜黄素纳米晶的粒径、多分散系数(PDI)以及Zeta电位,每个样品进行3次测量,计算平均值,并监测混悬液在放置期间粒径和电位的变化。
2.3 姜黄素含量测定
采用HPLC法测定姜黄素含量。色谱条件:色谱柱为Phenomenex Luna C18柱(250 mm×4.6 mm,5µm);流动相为乙腈-4%冰醋酸溶液(55∶45);检测波长430 nm;柱温30℃;流速为1 mL/min;进样量10µL。姜黄素质量浓度在50.0~150.0µg/mL范围内与峰面积呈线性关系,回归方程为A=1.343 9c-2.289 5,r=1;进样精密度RSD为0.20%(n=6);加样回收率平均值(100.15±0.66)%(n=9),经验证该方法满足姜黄素含量测定要求。
2.4 纳米晶载药微丸的稳定性
定期取胶囊中的载药微丸于水中轻微振摇,观察再分散前后状态,并利用粒度分析仪考察固化前后纳米晶粒度变化及固化后室温放置稳定性;按照“2.3”项下方法对室温储存的纳米晶混悬液中间体和纳米晶载药微丸进行姜黄素含量测定,考察室温条件下的化学稳定性。
2.5 微观形态观察
通过扫描电镜(SEM)对纳米晶混悬液和载药微丸均进行了形态学表征,取1滴稀释后的不同粒径姜黄素混悬液滴到SEM样品台上,自然晾干后镀金进行观察;取少量载药微丸样本用碳导电胶带粘贴在铝样本台上,镀膜仪镀铂金导电膜,场发射扫描电镜下对表面形态及切面进行观察。
2.6 体外溶出试验
利用桨法考察不同粒径姜黄素混悬液、载药微丸及胶囊的溶出特性。取含姜黄素90 mg的不同粒径混悬液、微丸以及胶囊(置于沉降篮中),加入溶出介质(1%SDS水溶液)900 mL中,转速75 r/min,温度为37℃。分别于5,10,15,20,30,45,60,90,120,180 min取样10 mL,用0.22µm聚四氟乙烯(PTFE)滤膜过滤,取续滤液,HPLC法测定其中姜黄素浓度,计算累积溶出度并绘制溶出曲线。
2.7 X射线粉末衍射(XRPD)
取姜黄素原料药、空白辅料(PVPK30、SDS)、物理混合物(姜黄素原料药、PVPK30、SDS)、姜黄素纳米晶混悬液冻干粉末,姜黄素纳米晶混悬液真空干燥粉末各适量,进行XRPD测定。工作条件为管电压40 kV,管电流40 mA,扫描范围3°~40°,扫描速度每步停0.1 s,步长0.02°。所得结果绘制XRPD曲线图。
2.8 差示扫描量热(DSC)试验
取姜黄素原料药、空白辅料(PVPK30、SDS)、物理混合物(姜黄素原料药、PVPK30、SDS)、姜黄素纳米晶混悬液冻干粉末,姜黄素纳米晶混悬液真空干燥粉末各适量于铝坩埚中,盖上扎孔,进行测试。工作条件为氮气流速20 mL/min,以10℃/min的速度由28℃升至300℃,测得结果绘制DSC曲线图。
2.9 药代动力学研究
因大鼠无法吞服胶囊,故将姜黄素纳米晶胶囊于适量水中分散,短暂静置后收集上层混悬液,弃去丸芯,得到纳米晶胶囊分散液,并取样稀释,按“2.3”项下方法检测分散液中姜黄素的浓度。将12只健康的雄性SD大鼠随机分为两组,分别灌胃给予姜黄素原料药和姜黄素纳米晶胶囊再分散混悬液,给药前禁食12 h,自由饮水。按照剂量为200 mg/kg给药后,于5 min、15 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h大鼠眼眶采血0.5 mL,置于乙二胺四乙酸二钾(EDTA-K2)抗凝管中13 000 r/min离心5 min,取上清液转移至空白EP管中,于-20℃条件下保存。采用高效液相-质谱联用仪测定每个时间点的血药浓度。色谱质谱条件:流动相A相为水(含0.1%甲酸),B相为乙腈(含0.1%甲酸);梯度洗脱:0~0.3 min,10%B;0.3~2.5 min,10%B→95%B;2.5~3.0 min,95%B;3.0~4.0 min,10%B;流速为0.7 mL/min;柱温40℃;采用选择性正离子对监测模式(MRM)测定姜黄素(m/z369.3/177.1)的浓度,普萘洛尔作内标(m/z260.1/116.1),离子化方式为电喷雾离子源(ESI)。
取待测血浆样本25µL,加入β-葡萄糖醛酸苷酶2.5µL混匀后37℃孵育1 h,再加内标工作液(50 ng/mL)100µL,混匀后于4℃、4 000 r/min离心10 min;取上清液70µL,加入50%乙腈210µL混匀后,于4℃、4 000 r/min离心2 min,取上清液进样分析。
3 结果与讨论
3.1 姜黄素纳米混悬剂处方筛选
根据实验设计制备不同处方的姜黄素纳米晶混悬液,以粒度的变化评价筛选处方,结果见表1。
比较不同处方纳米晶混悬液的放置稳定性,其中处方2、3、5能够维持粒度稳定,平均粒径无显著增长,证明PVPK30、SDS及吐温80是良好的稳定剂。在确保纳米晶混悬液稳定性的基础上,进一步优选辅料用量少的处方,筛选出处方3和处方5,其在1个月时间内的稳定性见图1和图2。

Table1 Stabilizing effect of formulations with different types and dosages of stabilizers at the grinding speed of 3000 r/min

Figure 1 Stability of particle size(A),PDI(B)and Zeta potential(C)of formulation 3 nanocrystal suspension(xˉ±s,n=3)

Figure 2 Stability of particle size(A),PDI(B)and Zeta potential(C)of formulation 5 nanocrystal suspension(xˉ±s,n=3)
两处方纳米晶混悬液的粒径、PDI、Zeta电位在一个月时间内均无明显变化,因此,所制备的纳米晶混悬液符合中间体的稳定性要求。
3.2 纳米晶固化及稳定性研究
为了方便贮存、运输、服用以及携带,同时解决姜黄素纳米晶混悬液着色能力过强的问题,提高患者依从性,本研究对混悬液进行了固化。在不加固化保护剂的情况下,纳米晶上药后发生聚集,为此本研究以廉价易得的蔗糖为两种优选处方的固化保护剂,在流化床中进行底喷上药,二者均能顺利负载到微晶纤维素丸芯上。
将载药微丸分散到水中进行表征,结果表明,含有吐温80的纳米晶载药微丸在水中时,药物从丸芯上呈片状脱落,无法恢复为上药之前的纳米晶状态,这可能与吐温80干燥后将纳米晶结合成紧密的团块,不易被水复溶分散有关。含有PVP K30与SDS的纳米晶载药微丸在水中再分散效果良好,能迅速分散得到200 nm左右的姜黄素纳米晶,其在135 d内再分散稳定性见图3。可以看出,该处方纳米晶混悬液固化后粒径与PDI无显著变化,且长期保持稳定,利于储存,故最终确定以PVPK30为立体保护剂,SDS为电荷保护剂,蔗糖为固化保护剂制备姜黄素纳米晶载药微丸。所得载药微丸流动性良好,可直接进行胶囊灌装。

Figure 3 Redispersion stability of nanocrystalline drug-loaded pellets beforeand after curing(xˉ±s,n=3)
稳定性研究结果表明,纳米晶混悬液室温放置4个月时姜黄素含量为初始含量的(96.84±0.97)%(n=3);制成纳米晶载药微丸后,4个月时姜黄素含量为最初的(99.53±0.42)%(n=3),均在初始含量的95%~105%之间,含量无显著变化,说明将姜黄素纳米晶混悬液制成载药微丸后化学稳定性良好。
3.3 微观形态观察
两种优选处方载药微丸表面及切面形态见图4。可明显观察到,含有PVPK30与SDS的纳米晶载药微丸表面更为圆整致密,而吐温80作稳定剂的微丸粗糙不规则,散粉较多。这可能与PVPK30具有黏合剂的特性有关,能将姜黄素纳米晶较好地结合到一起,且易被水溶解而分散。而常温下为液体的吐温80干燥效果较差,上药率较低,部分姜黄素以散粉形式残留。故从上药效果、再分散效果、表面形态等方面考虑,均为前者更优。

Figure 4 SEM characterization of the appearance,surface and section(fromleft toright)of curcumin nanocrystallinedrug-loaded pelletsA:stabilizer:PVPK30 and SDS;B:stabilizer:Tween 80
按最优处方(稳定剂:PVPK30和SDS)制备了不同粒径的姜黄素纳米晶混悬液,粒度测定结果见表2,除未经研磨的姜黄素混悬液外,其他混悬液中值粒径分别约为2µm、750 nm、500 nm、200 nm,扫描电镜图像如图5所示,姜黄素实际尺寸与粒径仪测定结果基本相符,测定结果可靠,研磨所得颗粒呈不规则状。
3.4 体外溶出试验
姜黄素在水中几乎不溶,采用1%SDS溶液为溶出介质,不同粒径姜黄素颗粒、载药微丸及胶囊体外释放效果如图6所示。可以看到,未经研磨的姜黄素3 h累积释放只有(74.29±2.39)%,未完全溶出,证明姜黄素原料药溶出度低。随着粒径减小,姜黄素溶出速率显著增加,原料药、2µm、750 nm、500 nm的样品5 min时累积溶出分别达到(16.24±0.54)%、(47.06±1.93)%、(79.23±1.04)%和(84.91±1.19)%,200 nm的姜黄素纳米晶在5 min内即可完全溶出,其累积溶出率为(100.98±3.92)%,说明将姜黄素粒径减小到200 nm能极大地促进体外释放。载药微丸和胶囊5 min累积溶出分别达到(93.79±4.80)%和(89.09±3.34)%,均大于85%,为快速溶出,与200 nm混悬液的溶出结果无显著性差异。研究结果表明,与原料药相比,制备的姜黄素纳米晶胶囊能显著提高药物溶出度及溶出速率,促进体外释放,有利于体内进一步吸收。

Table 2 Results of particle size determination of curcumin granules with different particle sizes

Figure 5 SEM characterization of curcumin granules with different particle sizesA:API;B:2µm;C:750 nm;D:500 nm;E:200 nm

Figure 6 In vitro dissolution curves of capsules,drug-loaded pellets and suspensions with different particle sizes(xˉ±s,n=6)
3.5 XRPD与DSC分析
通过XRPD和DSC研究了姜黄素研磨前后的晶型,比较了两种干燥方式对晶型的影响,XRPD分析结果见图7,DSC分析结果见图8。与物理混合物特征峰相比,纳米晶干燥粉末的特征衍射峰位置基本没有发生改变,而峰强度明显减小,说明姜黄素一部分保持原晶型,另一部分转变为无定型。根据DSC曲线,姜黄素制备为纳米晶后吸热峰位置基本不变而强度变弱,分析结果与XRPD结果一致,且干燥方式对晶型影响不大。从XRPD和DSC的结果可以看出,用最优处方制备纳米晶的过程中,部分姜黄素转变为无定型,需要更少的能量来克服晶格力,这可能会是姜黄素纳米晶的溶出提高的原因之一。
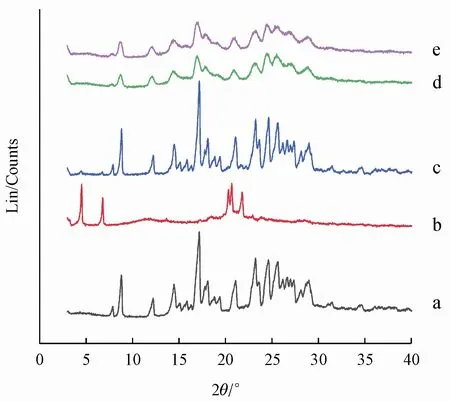
Figure 7 XRPD curves of API,stabilizer,physical mixture and nano⁃crystal samplesa:Curcumin;b:Stabilizer;c:Physical mixture;d:Nanocrystals(vacuum drying);e:Nanocrystals(freezedrying)

Figure 8 DSC curves of API,stabilizer,physical mixture and nano⁃crystal samplesa:Curcumin;b:Stabilizer;c:Physical mixture;d:Nanocrystals(vacuum drying);e:Nanocrystals(freezedrying)
3.6 药代动力学研究
姜黄素原料药和姜黄素纳米晶胶囊分散液药时曲线如图9所示。原料药与纳米晶制剂的AUC0-t分 别 为(1 115.02±398.38)µg/L•h和(10 359.41±3 396.04)µg/L•h,tmax分别为(9.35±11.42)h和(2.83±2.84)h,cmax分别为(134.61±126.57)µg/L和(1 168.57±533.64)µg/L,两组生物利用度有显著性差异(P<0.05)。研究结果表明,纳米晶制剂体内吸收迅速,这跟体外溶出速率的增加是相符的;纳米晶制剂AUC0-t和cmax分别是原料药的9.3倍和8.68倍,证明将原料药制成纳米晶制剂后显著提高了姜黄素的生物利用度。同时有研究表明,姜黄素通过胆汁进入肠道后,原型药物和代谢产物会经肠道菌群水解后被重吸收,形成肝肠循环,这可以解释纳米晶组曲线出现的双峰现象[22]。
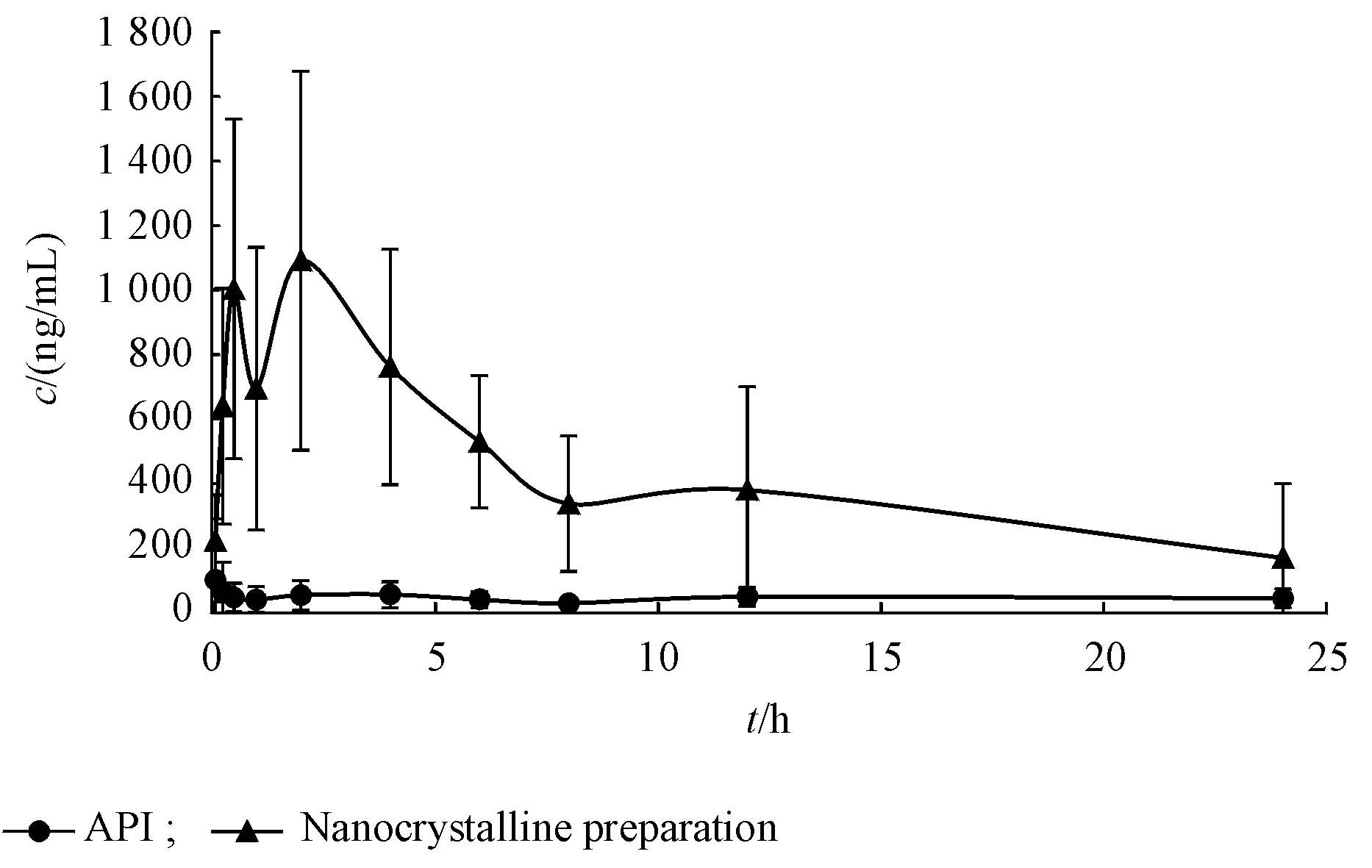
Figure 9 Plasma concentration-time curves of nanocrystalline prepa⁃ration and API(xˉ±s,n=6)
4结 论
本研究采用纳米晶技术提高溶出度,溶出速率以及体内生物利用度,利用介质研磨技术将姜黄素研磨至目标粒径,并固化为固体制剂便于口服,提高患者的依从性。
本研究制备了不同粒径的姜黄素纳米晶混悬液,比较其体外释放效果,确定了减小姜黄素粒径能有效改善姜黄素的溶出行为,研磨至200 nm的纳米晶增溶效果优异,定为目标粒径。为获得稳定的姜黄素纳米晶混悬液,本研究通过改变稳定剂的种类及用量,最终筛选得到了两种处方的纳米晶混悬液。通过流化床底喷技术进行微丸上药,比较两处方载药微丸的表面形态及再分散效果,发现以PVPK30和SDS为稳定剂的纳米晶混悬液,微丸上药后表面形态更为致密圆整,且固化前后粒径无显著变化,稳定性良好。制备的姜黄素纳米晶胶囊显著提高了体外溶出速率和溶出度。体内药代动力学研究结果证明,将姜黄素制成纳米晶制剂后,其在大鼠体内的生物利用度能够达到原料药的9.3倍,吸收速度和程度显著提高。
本研究成功获得了室温下长期放置稳定的姜黄素纳米晶胶囊,极大地改善了其溶出度并提高了生物利用度,在难溶性药物姜黄素的临床应用及产业化方面具有积极意义。该制剂相关药效学等方面研究还有待进一步深入开展。

