乳腺癌代谢重编程与微环境重塑的研究进展
钱思嘉,尹 骏,姚文兵,高向东*
(1中国药科大学江苏省生物药物成药性研究重点实验室,南京210009;2中国药科大学生命科学与技术学院,南京210009)
根据国际肿瘤研究机构发布的全球肿瘤统计数据显示,乳腺癌是2018年发病率最高的肿瘤,全球约有200万例病例登记,到2040年,这一数字预计将超过300万[1-2]。乳腺癌在患癌女性中具有次高的病死率。这种高病死率主要与晚期转移有关,局部病变的5年生存率为99%,而当发生转移时,该值降低为27%[3]。乳腺癌包含几种不同的亚型,在细胞和分子水平上均表现出高度的异质性。基于是否存在激素受体和表皮生长因子受体2(human epidermal growth factor receptor 2,HER2),乳腺癌可分为以下3种类型:雌激素和/或孕激素受 体(estrogen receptor/progesterone receptor,ER/PR)阳性,HER2阳性和三阴性乳腺癌(triple-nega⁃tive breast cancer,TNBC)。这些受体的存在与否决定了是否应该使用激素疗法和/或免疫疗法。在分子水平上,乳腺癌亚型根据其基因表达特征分为Luminal A,Luminal B,富含HER2和TNBC亚型(表1)。激素受体阳性的Luminal A亚型的发生率最高,预后最好,而TNBC亚型的预后最差[4]。

Table 1 Molecular subtypes of breast cancer and respective preva⁃lence
能量代谢的重新编程被认为是促进肿瘤发生发展的标志之一[5-7]。致癌基因驱动了代谢途径的失调,进而为肿瘤细胞提供了选择性的优势,使其能够在恶劣的微环境中高度增殖,提高其存活率。此外,能量代谢重编程产生的代谢物(例如2-羟基戊二酸)与信号传导途径相互作用,促进肿瘤的发生。肿瘤细胞代谢程序的改变也进一步影响了肿瘤微环境中的其他细胞,有助于调节与肿瘤发展密切相关的过程,例如血管生成、炎症和肿瘤免疫[8]。肿瘤代谢作用揭示了肿瘤发生和发展的关键因素,开辟了新的诊断和治疗视角。
本文探讨了乳腺肿瘤内的代谢重编程及其对乳腺癌生物学进程的重要性。从糖酵解、三羧酸循环(tricarboxylic acid cycle,TCA cycle)和氧化磷酸化、氨基酸代谢以及脂质代谢4个部分概述了乳腺癌组织和细胞中的能量代谢的重新编程,从而加深了对代谢调节乳腺癌进程的理解,有助于设计与开发乳腺肿瘤代谢的相关药物。
1 乳腺癌代谢重编程
诸多研究表明,乳腺癌和正常乳腺组织的代谢特征之间存在差异,各种代谢途径例如糖酵解、TCA循环、氨基酸、核苷酸和脂质代谢,均发生了不同程度的改变[9-11]。据报道,乳腺癌组织的代谢取决于多种因素,例如肿瘤大小和等级、种族和年龄[9]以及激素状态[12]等,这反映了乳腺癌的异质性和复杂性。研究者收集了来自200多个乳腺肿瘤患者的代谢物、蛋白质和基因表达数据,鉴定出3种与ER状态无关的不同代谢簇,从而为了解乳腺癌异质性提供了更多信息[13],这些簇主要在糖酵解/糖异生和甘油磷脂代谢方面有所差异。乳腺肿瘤细胞的代谢谱分析也显示了不同细胞系之间存在高代谢变异性[14-15]。例如,发现ER阳性细胞(BT-474)的糖酵解作用与ER阴性细胞(MDA-MB-231和MDA-MB-453)相比更弱[16],该发现与在组织中的观察结果一致[12]。另一方面,TNBC细胞的代谢变化表明能量需求增加,与这种肿瘤亚型更具侵略性的临床行为一致[17]。乳腺癌代谢重编程的主要内容见图1。
1.1 糖酵解
糖酵解包括一系列复杂反应,在氧气利用率低的情况下,葡萄糖会转化为丙酮酸,并同时产生NADH和ATP。生成的丙酮酸可以转化为乙酰辅酶A并进入TCA循环,也可以生成乳酸。研究表明,许多肿瘤即使在有氧条件下也可以进行糖酵解作用[17]。这种Warburg效应赋予了肿瘤细胞一定的生存优势,例如快速生产能量和生物合成途径的底物、氧化还原的平衡和肿瘤侵袭性的增强[17]。葡萄糖摄取和糖酵解活性的上调是非侵入性成像技术(18F-氟脱氧葡萄糖正电子发射断层显像技术)的基础,该技术在临床上已被广泛用于检测乳腺癌的骨骼转移和代谢变化[18]。与非癌组织相比,在人类乳腺癌组织中观察到增强的糖酵解作用[11],相应地,与正常乳腺上皮细胞相比,在肿瘤细胞系中也观察到类似的效应[16]。
在人类细胞中,葡萄糖转运膜蛋白家族(glu⁃cose transporter,GLUT)调控着葡萄糖的摄取。在人类基因组编码的14种亚型中,GLUT1在人体组织中分布最广泛,并在包括乳腺癌在内的各种肿瘤中过表达[19]。Choi等[21]使用组织芯片进行免疫组织化学分析,结果表明,GLUT1在TNBC(尤其是在基底样亚型中)过表达,并与增强的糖酵解途径相关[20]。在另一项研究中,与1级高分化肿瘤相比,GLUT1和GLUT3在2级和3级低分化肿瘤中mRNA和蛋白质水平表达更高。此外,在最近的荟萃分析中发现组织内GLUT1的过表达与乳腺癌的不良预后和较低的存活率显著相关[19]。
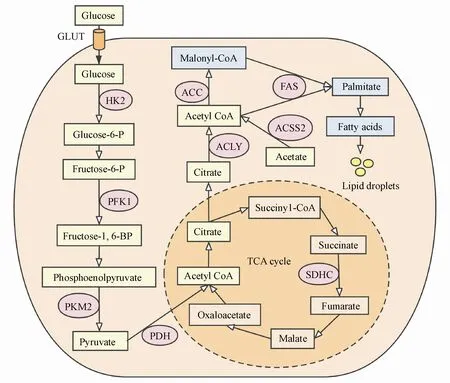
Figure1 Overview of metabolic reprogramming in breast cancer cells
己糖激酶(hexokinase,HK)催化糖酵解的第一步,即葡萄糖转化为6-磷酸葡萄糖。在哺乳动物组织发现的4种亚型中,HK2在肿瘤组织中过表达水平最高[22]。通过免疫组织化学分析,发现HK2在27例未经治疗的原发性乳腺癌中高表达[23]。在ErbB2/Her2驱动的乳腺癌小鼠模型中,HK2被证明是肿瘤发生所必需的,而HK2的敲低则抑制了体内和体外乳腺肿瘤细胞主要表型的表达[24]。
磷酸果糖激酶1(phosphofructokinase 1,PFK1)是糖酵解限速酶,可将6磷酸果糖转化为1,6-二磷酸果糖,与正常的乳腺组织或邻近的癌旁组织相比,肿瘤部位的PFK1蛋白质表达增加并伴随着酶活性的升高[25]。同时,研究者们也发现了不同类型的能够表征肿瘤和癌旁乳腺组织的同工酶[26]。
糖酵解的第3个关键步骤是丙酮酸激酶(pyru⁃vate kinase,PK)催化,将磷酸烯醇丙酮酸转化为丙酮酸。异构体PKM2在几种高度增殖的肿瘤类型中高表达。除了在糖酵解中起关键作用外,PKM2还通过充当辅助激活剂和蛋白激酶来促进肿瘤的发生[27]。最近的荟萃分析发现了PKM2在乳腺癌中升高具有一定的临床意义,PKM2的高表达表明乳腺癌患者生存率较差,并与淋巴结转移相关[28]。
对不同基因和转录因子对乳腺癌中糖酵解活性的调节作用进行了研究,乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1)是主要的抑癌基因,也是遗传性乳腺癌中最常见的突变基因[29]。在乳腺肿瘤细胞中,BRCA1被证明可下调糖酵解并上调与氧化磷酸化相关的TCA循环[30]。此外,Zhao等[31]证明了ERBB2/HER2癌基因的过表达与糖酵解增加有关。通过上调热休克因子1(heat shock factor 1,HSF1),过表达ERBB2的乳腺肿瘤细胞系(MCF7和MDA MB-231)表现出葡萄糖摄取和乳酸生成的增强,以及氧消耗的减少。大部分实体瘤的氧合区域都较小,缺氧诱导因子(hypoxia-inducible factor,HIF)1和2是肿瘤氧水平调节的重要介体。在缺氧条件下,两个HIF-α亚基(HIF-1α和HIF-2α)都逃脱了蛋白水解作用并发生二聚化,而HIF-1β亚基激活了靶基因的转录[32]。在人类乳腺肿瘤细胞系中发现了HIF-1α和HIF-2α的不同作用[33-34]。据报道,HIF-1α的激活可促进向有氧糖酵解的转变,增加乳腺肿瘤细胞的葡萄糖摄取和乳酸释放[34]。这些发现证实侵袭转移性乳腺肿瘤细胞较高的糖酵解活性主要是由HIF-1α驱动的[33]。另一方面,发现HIF-2α的激活可诱导与肿瘤生长和细胞增殖有关蛋白质的过表达,例如表皮生长因子受体(epidermal growth factor receptor,EGFR)、RAS和细胞周期蛋白D1[34]。转录因子TWIST也与乳腺肿瘤细胞中葡萄糖代谢的重新编程有关,它通过诱导β1-整合素/FAK/AKT/mTOR并抑制p53信号传导途径进而促进几种糖酵解基因的过表达[35]。
1.2 TCA循环和氧化磷酸化
TCA循环是在线粒体中发生的一系列反应,乙酰辅酶A进入TCA循环被氧化,生成二氧化碳和还原型辅酶NADH和FADH2,以及少量的ATP。这些还原型辅酶会将其电子传递到电子传递链中,通过氧化磷酸化(oxidative phosphorylation,OXPHOS)生成大量的ATP。正常细胞主要依靠线粒体代谢产生能量,而肿瘤细胞则表现出糖酵解的上调和线粒体失调[36]。实际上,在乳腺肿瘤和细胞系中均检测到了线粒体DNA的突变,这被认为可能调节了肿瘤的转移[37]。
此外,已有研究发现在乳腺癌中不同的TCA循环存在着相关酶的变化。丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDH)催化丙酮酸氧化脱羧生成乙酰辅酶A,因此控制了代谢物从糖酵解到TCA循环以及随后通过线粒体代谢生成ATP的通量。最近据报道,人乳腺肿瘤组织中PDHX(PDH复合物的结构成分)的表达降低,与患者低存活率相关[38]。另外,在乳腺肿瘤细胞系中,PDHX的抑制减少了线粒体氧化,促进细胞外酸化和细胞增殖[38]。
1.3 氨基酸代谢
除葡萄糖外,谷氨酰胺和丝氨酸等氨基酸也是细胞生长和增殖的重要底物。长期以来,研究表明谷氨酰胺的消耗量比其他氨基酸多十倍以上,谷氨酰胺不仅是生物合成途径(氨基酸和核酸合成)所必需的,而且能够转化为TCA循环中间体和乳酸,为肿瘤细胞提供额外的能源[39]。谷氨酰胺一旦被肿瘤细胞吸收,就会被谷氨酰胺酶(gluta⁃minase,GLS)转化为谷氨酸。已有研究发现该酶在乳腺肿瘤组织中差异表达,这取决于乳腺癌亚型[40]。TNBC中的GLS表达高于管腔和/或HER2亚型。此外,GLS的同工型,线粒体磷酸激活的GLSC和肾型GLS对TNBC细胞的存活和增殖都至关重要,同时也是TNBC异种移植物生长所必需的[41]。再者,由于谷氨酰胺合成酶的谱系特异性表达,Luminal型乳腺癌对谷氨酰胺的依赖性更差[42]。
丝氨酸是一种非必需氨基酸,其生物合成通常在肿瘤细胞中被上调[43]。丝氨酸生物合成途径的第一步是通过3-磷酸甘油酸脱氢酶(phospho⁃glycerate dehydrogenase,PHGDH)催化,该酶在包括乳腺癌在内的几种肿瘤类型中均被遗传扩增和/或过表达。在ER阴性[44]和人乳腺肿瘤以及几种乳腺肿瘤细胞系[45]中,PHGDH蛋白水平升高。PHGDH的过表达通过多种机制促进乳腺肿瘤生长,包括促进蛋白质合成和一碳代谢[46]以及代谢物D-2-羟基谷氨酸的过量合成[47]。
1.4 脂质代谢
哺乳动物细胞主要通过两种机制获得脂质,即内源的从头合成和外源的摄取[48-49]。体内多数细胞脂质需求都依赖于血脂,高度增殖的细胞对脂质和胆固醇的需求增加,因此肿瘤细胞需要吸收更多的外源脂质和脂蛋白,激活从头脂肪形成和胆固醇的生物合成[50]。在乳腺癌组织中观察到脂肪酸(fatty acid,FA)合成增加和膜脂质上调以及游离脂肪酸(free fatty acid,FFA)含量降低[11],表明新合成的FA可以快速用于生产膜磷脂。另外,FA可用来产生能量以及作为底物来合成脂质,例如三酰基甘油(triacylglycerol,TAG)、神经酰胺和炎症介质。有趣的是,在乳腺癌组织[12]和细胞[51]中发现了肿瘤亚型之间脂质代谢的差异。例如在TNBC细胞中,棕榈酸酯优先被储存在脂滴中,而Luminal细胞则优先利用棕榈酸酯进行FA氧化并释放能量[51]。
某些类型的肿瘤包括乳腺肿瘤,利用乙酸盐作为碳的补偿性来源,以支持从头脂肪形成[52-53]。乙酰辅酶A合成酶(acetyl-CoA synthase,ACSS)是乙酸盐利用的第一步。通过催化乙酸盐向乙酰辅酶A的转化,ACSS提供了FA的结构单元。在乳腺癌中,ACSS表达与乳腺癌的进展相关。从机制上,ACSS2在缺氧和脂质缺乏的情况下通过使用乙酸盐作为碳源来支持从头脂肪生成,敲低ACSS可以延迟肿瘤细胞的增殖[54]。此外,由ACSS产生的乙酰辅酶A可以用作乙酰基的供体,从而介导组蛋白乙酰化和表观遗传调控代谢基因的表达[55]。因此,乙酸盐既充当前体又是表观遗传代谢产物,以支持从头脂肪形成。
谷氨酰胺通过谷氨酸进入TCA循环,然后被谷氨酸脱氢酶转化为α-酮戊二酸。这种谷氨酰胺分解通量的增加使柠檬酸盐能够离开线粒体进入细胞质,并通过ATP柠檬酸裂解酶(ATP citrate lyase,ACLY)分解成草酰乙酸和乙酰辅酶A。另外,ACLY的核定位及Akt的磷酸化促进了BRCA1的募集,这对于通过同源重组介导的DNA双链断裂修复是必不可少的[56]。新生脂肪形成中的限速酶是脂肪酸合酶(fatty acid synthase,FASN),它催化FA生物合成的最终步骤,使丙二酸单酰辅酶A和乙酰辅酶A在NADPH的存在下生成棕榈酸酯。重要的是,编码FASN的基因被认为是乳腺癌的致癌基因[57]。在癌组织和细胞中,发现FASN在HER2阳性的乳腺癌亚型中更丰富表达[58]。此外,据报道HER2与FASN形成复合物,促进其磷酸化,从而增加酶的活性,促进肿瘤细胞的增殖[59]。
2 乳腺癌代谢与微环境重塑
乳腺肿瘤细胞内新陈代谢的失调影响了恶性组织中的多种细胞(如内皮细胞,炎性细胞和免疫细胞)的活性,从而重塑了肿瘤的微环境。通过肿瘤代谢对肿瘤微环境进行代谢重塑,进一步促进了肿瘤部位的血管生成并降低了肿瘤的免疫原性,从而促进肿瘤发展。
2.1 乳腺肿瘤细胞释放乳酸以促进肿瘤血管化
有氧糖酵解以及生成和分泌的乳酸导致肿瘤微环境酸化。乳酸向肿瘤微环境的释放进一步促进了肿瘤的进展[60]。乳酸盐被邻近的肿瘤/基质细胞吸收,并用作代谢中间体进行生物合成或通过OXPHOS满足其生物能需求。使用异种移植模型的研究表明,跨细胞膜转运单羧酸盐的单羧酸盐转运蛋白4(monocarboxylate transporter 4,MCT4)介导乳腺肿瘤细胞的乳酸分泌。如图2所示,分泌的乳酸进一步转运到表达MCT1的内皮细胞中转化为丙酮酸,从而触发HIF-1α/NF-κB/IL-8自分泌途径。之后,内皮细胞中的乳酸信号诱导细胞迁移和血管形成,促进肿瘤血管形态发生和灌注。有趣的是,乳酸信号可被2-氧戊二酸酯和活性氧抑制剂阻断[61],表明乳酸的促血管生成作用与细胞氧化还原稳态有关。总之,肿瘤细胞的代谢重编程在肿瘤微环境中重塑了内皮细胞的代谢和信号传导,从而促进了肿瘤的发展[61]。

Figure 2 Lactate shuttle between tumor cells and vascular endotheli⁃al cells
2.2 乳腺癌代谢和肿瘤免疫
肿瘤免疫是一个动态过程,其中最关键的就是肿瘤细胞与免疫细胞之间的相互作用[62]。乳腺肿瘤细胞和细胞毒性T淋巴细胞(cytotoxic T lym⁃phocyte,CTL)具有许多共同的代谢特征,包括上调的糖酵解和合成代谢活性[63]。乳腺肿瘤微环境中细胞间的代谢竞争会显著影响肿瘤的进展,而肿瘤代谢失调也可能调节炎症和免疫细胞的代谢和功能[64-65]。体外研究表明,乳酸抑制人类CTL的增殖和其细胞因子的产生,并导致其细胞毒性降低50%,而继续在不含乳酸的环境中培养24 h即可恢复CTL的功能[66]。乳腺肿瘤细胞向微环境释放的大量乳酸会导致肿瘤浸润淋巴细胞增殖的抑制、细胞因子合成的减少和其细胞溶解能力的降低[67]。此外,乳酸的增加和环境的酸化还影响了NK细胞的代谢,有利于肿瘤生长和免疫逃逸[68]。
除乳酸以外,肿瘤细胞与肿瘤浸润淋巴细胞之间的谷氨酰胺竞争也会阻碍淋巴细胞对乳腺肿瘤细胞的免疫作用。乳腺肿瘤细胞与淋巴细胞竞争谷氨酰胺,从而限制了淋巴细胞的增殖[69]。另外,细胞外微环境中谷氨酰胺水平的降低能够使CD4+T细胞向Treg表型转移,从而有助于人体内的免疫抑制[70]。
乳腺肿瘤细胞内的葡萄糖调节蛋白78(glu⁃cose-regulated protein 78,GRP78)是一种内质网应激蛋白,已有研究发现,敲低GRP78可抑制FA的线粒体运输,进一步抑制了FA氧化,导致多不饱和FA在细胞内积累[71]。细胞内FA含量的升高进一步上调了血清内单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP1)的水平,并降低了肿瘤识别标识符CD47的表达。此外,抑制GRP78可增强巨噬细胞的炎症浸润能力[71],表明乳腺癌的脂质代谢调节了肿瘤免疫。
3 总结和展望
综上,代谢重编程在乳腺癌发生和发展进程中起着关键的作用。各种不同代谢通路内酶类表达水平和活性的变化,直接导致了糖酵解作用、TCA循环、谷氨酰胺分解和脂质生物合成途径的改变,且根据乳腺癌亚型和等级的不同,这些变化之间也有所差异。在乳腺肿瘤中,无论是代谢物利用还是代谢途径的调节,都存在着不同的竞争和共生关系。这种复杂的变化也导致了肿瘤逃脱机体的免疫防御机制,进一步促进了肿瘤的进展。因此,靶向肿瘤代谢途径也能够抑制肿瘤血管生成作用以及增强肿瘤本身的免疫原性。
目前,乳腺癌多数代谢特征仍然是未知的,高通量基因组学、蛋白质组学和代谢组学等研究技术的进一步发展将有助发现乳腺癌的新代谢特性,对其代谢作用的深入研究将能够帮助发现抗肿瘤治疗的新靶标,从而研制出新型有效的抗乳腺癌药物。

