荆州地区玉米鞘腐病病原菌鉴定及生物学特性分析
周双针 王康 杜何为 黄敏


摘 要2019年6月,在湖北荆州长江大学试验地自然感玉米鞘腐病的玉米植株中分离出致病原菌,采用植物病理学及分子生物学方法,鉴定了该致病原菌的种类;采用控制变量法测试分析病原菌的生物学特性。结果表明,从感病植株叶鞘中分离得到的致病菌株(Fg-1),在形态学水平上与禾谷镰孢菌(Fusarium graminearum)一致;分子水平上,rDNA-ITS序列分析发现,Fg-1与禾谷镰孢菌的相似度达99.42 %;Fg-1的最适生长温度为25 ℃,致死温度为40 ℃,最适pH值为7.0,培养基培养最适碳源为牛肉膏,最适氮源为酵母膏。
关键词 玉米;玉米鞘腐病;病原菌鉴定;禾谷镰孢菌(Fusarium graminearum);生物学特性
中图分类号:S435.131 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2021.07.001
玉米(Zea mays L.)是我国重要的粮食作物,据国家统计局数据显示,2019年我国玉米的年产量为2.61亿吨,播种面积为4 128万公顷,是我国第一大粮食作物[1]。随着秸秆还田、免耕直播、地膜覆盖等耕作栽培方式的广泛运用,玉米品种更新换代及全球气候变暖,导致玉米病虫害持续加重,给玉米产量造成严重损失[2]。玉米鞘腐病是玉米生长发育过程中的主要病害之一,该病主要在玉米开花期至乳熟期发生,为害玉米叶鞘部位,发病时往往出现不规则形状的糜烂状病斑,颜色以褐色为主,严重时可蔓延至整个叶鞘,致使叶鞘干腐死亡,严重影响玉米的产量[3-4]。分离玉米鞘腐病的致病原菌,探明其生物学特性,对玉米鞘腐病的防治具有重要意义。
玉米鞘腐病最早在美国报道,该病在玉米抽丝期发生,侵染叶鞘[5]。2008年,徐秀德等通过采集辽宁省、吉林省和黑龙江省的自然病株,采用常规的植物病理学和分子生物学相结合的方法,将该病的病原菌鉴定为层出镰孢菌(Fusarium proliferatum)[6]。随后,胡兰等对该病原菌的生物学特性进行了研究,发现其生长的最适温度为28 ℃,最适pH值为5~6,分生孢子萌发适温为25~30 ℃[7]。玉米不同种群对玉米鞘腐病的抗性不同,2019年,渠清等从玉米16个自交系所在的种群中发现,兰卡斯特群和唐四平头群对玉米鞘腐病表现为抗病[8]。
近年来,湖北地区玉米鞘腐病的发病程度越来越严重。本研究通过采集湖北荆州长江大学试验地(东经112°14′,北纬30°35′)中的玉米鞘腐病病株,采用基本的植物病理学方法鉴定病原菌种类,探究荆州玉米鞘腐病病原的生物学特性,为该地区玉米鞘腐病的综合防治和深入研究提供依据。
1 材料与方法
1.1 样本采集
2019年6月,从湖北省荆州市长江大学玉米试验地采集表现出典型玉米鞘腐病症状的玉米病株,用于病原菌分离。
1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA)[9],查氏培养基(Czapek)[9],绿豆煎汁培养基(LD,用于诱导大型分生孢子的产出)[10]。
1.3 病原菌分离与纯化
参考曹兴等的方法[11],将采集的玉米叶鞘沿病健交界处剪成2~3 mm2大小,表面消毒后置于PDA平板上,25 ℃恒温倒置培养3~5 d。挑取组织周围菌丝,转接于另一新的PDA平板上。培养一周后,用无菌水制成孢子悬浮液,进行单孢分离并纯化。将纯化好的真菌分离物用直径为5 mm的打孔器打成菌饼,转入装有1 mL 25%甘油的1.5 mL离心管中,置于-70 ℃超低温冰箱保存备用。
1.4 病原菌鉴定
1.4.1 形态学鉴定
参考卢维宏等的方法[12],将分离的菌株接种在9 mm的PDA平板上,25 ℃下培养5 d,观察菌落形态;在显微镜下观察分生孢子形状及大小,并拍照记录。参照孙华等的方法[13],确定菌株的属和种。
1.4.2 分子生物学鉴定
参考张颖慧等改良的丝状真菌DNA提取方法[14],挑取在PDA平板上生长6 d的病原菌菌丝,采用CTAB法提取真菌DNA。对rDNA-ITS序列进行扩增,选择的引物为:ITS1(5′-TTCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[15]。PCR产物经纯化后送至生工生物工程(上海)股份有限公司测序。测序结果在NCBI数据库(http://www.ncbi.nlm.gov)中进行同源性检索,采用MEGA7.0软件的Neighbor-Joining法构建系统进化树[16]。
1.5 致病性测定
将普通牙签高温灭菌并去除有毒物质后接种,转入Fg-1的PDA平板上,25 ℃培养至真菌长满整个牙签备用。根据柯赫氏法则,在玉米试验田中,采用牙签接种法[17],以开花期的玉米植株作为接种对象,用无菌穿刺器在其叶鞘部位穿刺后,将长满菌丝的牙签直接插入孔中,保湿培养,以沾满无菌水的牙签做空白对照,每处理5次重复。3 d后观察接种部位的发病情况并拍照记录。将接种真菌和接无菌水(对照)的叶鞘均按照“1.3”节的步骤获得再分离菌株,并观察再分离菌株和原接种病菌的形态差异。
1.6 病原菌生物学特性测试分析
1.6.1 温度对菌丝体生长和大型分生孢子萌发的影响
参考李俊香等的方法[18],将保存在-70 ℃冰箱中的病原菌转接于PDA平板上,置于25 ℃恒温暗培养5 d,沿着菌落的边缘打取直径5 mm的菌餅,接种在9 mm的PDA平板中央,依次放入温度为5、10、15、20、25、28、30、35、40 ℃的恒温培养箱中,每个处理设3个重复,从第1天开始,每天同一时间观察菌丝的生长情况及菌落的颜色、形态等,第5天用十字交叉法测量菌落直径。
将活化后的病原菌用直径为5 mm的无菌打孔器沿着菌落边缘打取菌饼,取5片菌饼置于100 mL绿豆煎汁液体培养基中,25 ℃,150 r·min-1暗培养3 d,然后用4层无菌纱布过滤菌丝,滤液即为分生孢子液[19]。血细胞计数板测定孢子悬浮液的浓度,用无菌水将孢子悬浮液的浓度调至106个/mL。参考李俊香等的方法[18],将孢子悬浮液充满血细胞计数板的计数区,用显微镜观察并计算计数区的大型分生孢子总数,然后将其放置在温度为5、10、15、20、25、28、30、35、40 ℃的恒温培养箱中,保湿培养。每处理3次重复。暗培养8 h 后,用显微镜观察并计算计数区的已萌发的大型分生孢子数目。计算大型分生孢子萌发率,公式如下:
孢子萌发率(%)=(萌发的分生孢子数/分生孢子总数)×100
1.6.2 pH对菌丝体生长的影响
参考李俊香等的方法[18],用1 mol·L-1 NaOH溶液和1 mol·L-1 HCl溶液将PDA培养基的pH值依次调节为4.0、6.0、7.0、8.0、9.0、11.0。将病原菌菌饼依次接种至不同pH值的PDA平板中央,每处理3次重复。第5天用十字交叉法测量菌落的直径,计算菌丝的日生长量,观察菌丝的生长情况及菌落的颜色、形态等。
1.6.3 碳源对病原菌的影响
参考李俊香等的方法[18],以察氏培养基(Czapek)为基本培养基,分别用等量的可溶性淀粉、麦芽糖、木糖、葡萄糖、乳糖、蔗糖和牛肉膏作为7种不同的碳源进行碳源替换。将活化的病原菌菌饼依次接种至不同碳源的察氏培养基中央,每处理3次重复。从第1天开始,每天同一时间观察菌丝的生长情况及菌落的颜色、形态等,第5天用十字交叉法测量菌落直径。
1.6.4 氮源对病原菌的影响
方法同“1.6.3”节所述,分别用等量的硝酸钾、硫酸铵、氯化铵、尿素、蛋白胨、酵母膏作为6种不同的氮源对察式培养基中的氮源进行替换。将活化的病原菌菌饼依次接种至不同碳源的察氏培养基中央,每个处理设3个重复。从第1天开始,每天同一时间观察菌丝的生长情况以及菌落的颜色、形态等,第5天用十字交叉法测量菌落直径。
2 结果与分析
2.1 病害症状
自然条件下,玉米在大喇叭口期开始发病,发病初期,叶鞘出现零星褐色小点,后逐渐扩展,多个病斑汇合形成不规则形斑块,蔓延至整个叶鞘(见图1a),叶鞘内侧褐变重于叶鞘外侧,伴随着叶片上有零星斑点,主叶脉出现褐色病斑,并不断延伸,最终布满整个主叶脉(见图1b)。在玉米感病植株中,病斑由下至上,发病后期可蔓延至雄穗,导致植株干腐死亡(见图1c)。
2.2 病原菌分离鉴定
2.2.1 病原菌分離及形态学鉴定
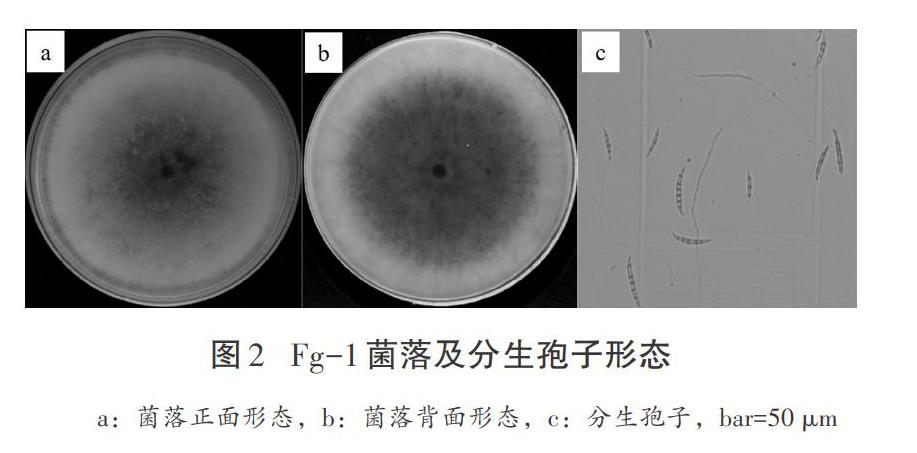
通过10个发病叶鞘样品的病菌分离,共得到8个菌株,菌落形态完全一致,经单孢纯化后得到1株镰孢菌菌株(Fg-1)。Fg-1在PDA平板上25 ℃培养5 d,菌落呈圆形,菌丝生长旺盛,分泌粉红色色素,后期中央菌丝体由白色转为淡黄色(见图2a、2b);分生孢子无色,呈镰刀状,有2~5个隔膜,中间宽两头尖,大型分生孢子大小为(3~6)μm×(14~35)μm,平均4.3 μm×24 μm;没有观察到小型分生孢子的出现;无厚垣孢子(见图2c)。
2.2.2 分子生物学鉴定
采用真菌通用引物ITS1和ITS4对Fg-1的16S rDNA-ITS区域进行PCR扩增,1.0%凝胶电泳后,在500 bp处得到一条清晰的条带(见图3)。经测序,菌株Fg-1的ITS片段长度为521 bp,GenBank中的登录号为MW133760。将菌株Fg-1的ITS序列与GenBank中的已知序列进行比对,发现与Fusarium graminearum(KY272768.1)相似度为99.42 %。用MEGA 7.0中的Neighbor-Joining法构建系统发育树(见图4),Fg-1与F. graminearum FUS89(MK630106.1)、F. graminearum HS42(KY426428.1)聚在同一个分支上。综上所述,明确将菌株Fg-1鉴定为禾谷镰孢菌(Fusarium graminearum)。
2.3 致病性测定
将分离得到的Fg-1菌株经田间活体植株回接至玉米叶鞘上,接种5 d后,在接种部位均出现发病症状,病斑呈褐色不规则形,中央腐烂变干,与田间症状类似,对照不发病(见图5)。从发病组织中均能再次分离得到与初分离菌株相同的分离物,符合柯赫氏法则,证明Fg-1菌株是引起玉米鞘腐病的致病原菌。
2.4 Fg-1生物学特性测定
2.4.1 温度对菌丝生长及分生孢子萌发的影响
温度试验结果表明,在10~35 ℃范围内,菌株Fg-1均能生长,在20~30 ℃范围内生长较快,第5天菌落直径大于6.0 cm,其中25 ℃菌落直径为8.5 cm,说明25 ℃时Fg-1生长速度最快(见图6)。5~10 ℃菌丝体生长缓慢,35~40 ℃基本停止生长。将5 ℃培养5 d的菌株Fg-1恢复至25 ℃培养,发现菌丝能继续生长;而40 ℃下培养5 d的菌株移至25 ℃培养,发现菌丝停止生长,说明低温只是延缓菌丝生长,而高温则容易导致菌株死亡。
在5~35 ℃,菌株Fg-1的分生孢子均能萌发,在20~28 ℃,萌发率较高(>25%),最适萌发温度为25 ℃,萌发率达32%;而高于40 ℃时,分生孢子无法萌发。在一定温度范围内,升高温度对Fg-1的孢子萌发有促进作用,但是温度超过35 ℃,分生孢子的萌发将会受到严重抑制(见图6)。
2.4.2 pH对菌丝生长的影响
试验结果显示,病菌在pH值4.0~11.0范围均能生长,在pH值为6.0~9.0菌丝的生长情况较好,其中最适生长pH值为7.0,菌落在第5天直径为8.37 cm,菌丝日生长量1.67 cm,菌落饱满,菌丝密度最大;过酸(pH=4.0)与过碱(pH=11.0)时,菌丝生长较CK极显著减缓,菌落厚度较薄(见表1)。说明菌株Fg-1生长的最适pH值为7.0。
[pH值 菌落直径/cm 菌丝日生长量/cm·d-1 菌落厚度 CK 8.50±0.00 1.70±0.00 较厚 4.0 6.37±0.13** 1.27±0.02** 较薄 6.0 8.00±0.16* 1.60±0.03* 中等 7.0 8.37±0.12 1.67±0.02 中等 8.0 8.23±0.21 1.65±0.04 中等 9.0 8.03±0.05** 1.61±0.01** 中等 11.0 7.03±0.05** 1.41±0.01** 较薄 ][表1 不同pH条件下Fg-1的生长情况][**表示与CK差异极显著(P<0.01),*表示与CK差异显著(P<0.01)]
2.4.3 碳源对Fg-1菌丝体生长的影响
由图7可以看出,菌株Fg-1在供试的7种碳源培养基上均可生长,但生长速度存在显著差异。以牛肉膏为碳源时,菌丝生长速度最快,菌丝生长最旺盛,第5天菌落直径达8.5 cm。以木糖为碳源时,菌丝生长最慢,菌落直径只有3.75 cm,菌落厚度偏薄。以蔗糖、可溶性淀粉为碳源时,菌丝生长速度较慢,菌落直径为7 cm左右,菌落厚度较厚,颜色为白色,色素积累较少。即Fg-1菌株对牛肉膏的吸收效率最高,对木糖的吸收效率最低。
2.4.4 氮源对Fg-1菌丝体生长的影响
由图8可以看出,菌株Fg-1在供试的6种氮源培养基上均能生长,其生长速度和菌落形态均存在显著差異。其中,以酵母膏为氮源的培养基更有利于Fg-1的生长,第5天菌落直径达7.9 cm,菌丝生长速度达1.56 cm·d-1,菌丝浓密,菌落较厚,分泌色素为淡粉色;其次是以硝酸钾为氮源的培养基,其菌落直径为6.5 cm,菌丝生长速度1.3 cm·d-1,菌丝稀疏,菌落较薄,无色素分泌;以氯化铵为氮源的培养基,菌丝生长速度最慢,只有0.9 cm·d-1,菌落出现水渍状的形态,且菌丝稀疏,菌落较薄。
3 结论与讨论
3.1 湖北荆州玉米鞘腐病病原菌的分离与鉴定
本课题组从湖北荆州地区采集到的玉米鞘腐病组织中分离得到1株真菌Fg-1,经致病性验证、形态学鉴定及分子生物学鉴定,确定为禾谷镰孢菌(Fusarium graminearum)。2008年,徐秀德等从辽宁、吉林和黑龙江等地采集到玉米鞘腐病的病株,首次将玉米鞘腐病的病原菌鉴定为层出镰孢菌(Fusarium proliferatum),该真菌的气生菌丝为绒毛状至粉末状,培养基背面为橙黄色,有大小型分生孢子[6]。从玉米鞘腐病组织中分离得到禾谷镰孢菌,本文属首例报道。据文献报道,禾谷镰孢菌分布广泛,可为害多种植物,在小麦中,禾谷镰孢菌主要引起赤霉病的发生,在开花期侵染穗部小花,在籽粒灌浆成熟过程中不断繁殖[20];在玉米中,该菌还可侵染根部[21]、茎部[22]、穗部[13],造成侵染部位的腐烂,影响植株的正常生长,导致产量降低。
3.2 病原菌Fg-1的生物学特性
据报道,引起茭白采后腐烂的禾谷镰孢菌最适生长温度为25 ℃,致死温度为55 ℃,最适产孢pH值为6.0[23];百合鳞茎禾谷镰孢菌的最适生长温度为30 ℃,最适生长pH值为8.0[24];四川雅安玉米青枯病致病菌禾谷镰孢菌的最适生长温度为25~30 ℃,35 ℃生长受到抑制,最适pH值为7.0,察氏培养基最适碳源为葡萄糖,最适氮源为蛋白胨,其次是以硝酸钾和尿素为氮源[25]。本研究发现,玉米鞘腐病致病菌禾谷镰刀菌(Fg-1)的最适生长温度为25 ℃,致死温度为40 ℃,最适pH值为7.0,察氏培养基最适碳源、氮源分别为牛肉膏、酵母膏。由此可见,相同培养条件下的禾谷镰孢菌,在不同寄主和不同地区,其生物学特性有所不同,可能与该菌的寄主及其地区不同有关。
3.3 病害防治
湖北荆州地区的菌株Fg-1在5~35 ℃均能存活并且在pH值为4.0~11.0的条件下均能生长,说明荆州的禾谷镰孢菌在玉米鞘腐病病残体上可以安全越过冬夏,成为下一季植物的侵染源,并且荆州气候潮湿,在夏季梅雨期更有利于禾谷镰孢菌的萌发和生长。随着秸秆还田、免耕直播等技术的广泛推广及应用,更会加重病菌在田间的繁殖。建议在发生病害的田间,不要采用秸秆还田、免耕直播等耕作方法。据报道,氰烯菌酯、氟唑菌酰羟胺、丙硫菌唑及氟环唑等杀菌剂均可以对禾谷镰孢菌产生毒性,但是为了延缓抗药性的产生,延长杀菌剂的使用年限,高效防治禾谷镰孢菌病害,建议在防治过程中轮换使用药剂,或者将不同作用靶标的药剂混配使用[26]。
参考文献:
[1] 国家统计局关于2019年粮食产量数据的公告[EB/OL].http://www.stats.gov.cn/tjsj/zxfb/201912/t20191206_1715827.html, 2019-12-06.
[2] 王振营,王晓鸣.我国玉米病虫害发生现状、趋势与防控对策[J].植物保护,2019,45(01):1-11.
[3] 刘俊,许苗苗,王平安,等.玉米品种对鞘腐病的抗性评价及产量损失研究[J].玉米科学,2018,26(01):29-36.
[4] 王宽,曹志艳,李朋朋,等.鞘腐病发生程度与玉米倒伏及产量损失间的相关性分析[J].植物保护学报,2015,42(06):949-956.
[5] White D G. Compendium of Corn Diseases[M]. St. Paul: The American Phytopathology Society Press, 1999.
[6] 徐秀德,姜钰,王丽娟,等.玉米新病害——鞘腐病研究初报[J].中国农业科学,2008,41(10):3083-3087.
[7] 胡兰,徐秀德,姜钰,等.玉米鞘腐病原菌生物学特性研究[J].玉米科学,2008,16(05):131-134.
[8] 渠清,李丽娜,刘俊,等.我国部分常用玉米种质资源对镰孢菌病害的抗性评价[J].中国农业科学,2019,52(17):2962-2971.
[9] 李平兰,贺稚非.食品微生物学实验原理与技术[M].北京:中国农业出版社,2005.
[10] 陈雨,陈长军,王建新,等.抗氰烯菌酯的禾谷镰刀菌nit突变体的诱导及其生物学特性[J].中国农业科学,2007,40(04):735-740.
[11] 曹兴,刘南南,胡燕佩,等.百合鳞茎腐烂病病原菌的鉴定及生物学特性研究[J].河南农业科学,2018,47(12):96-101.
[12] 卢维宏,黄思良,陶爱丽,等.玉米穗腐病样品中层出镰刀菌的分离与鉴定[J].植物保护学报,2011,38(03):233-239.
[13] 孙华,张海剑,郭宁,等.黄淮海夏玉米主产区穗腐病病原菌的分离鉴定[J].植物保护学报,2017,44(05):796-802.
[14] 张颖慧,魏东盛,邢来君,等.一种改进的丝状真菌DNA提取方法[J].微生物学通报,2008(03):466-469.
[15] 赵杰.ITS序列分析及其在植物真菌病害分子检测中的应用[J].陕西农业科学,2004(04):35-37.
[16] 刘静,孙翠翠,薛德胜,等.核桃枝枯病病原菌鉴定及其生物学特性[J].植物病理学报,2020,50(06):136-140.
[17] 张艺铭.山东省玉米青枯病病原鉴定及生防菌株和化学药剂的筛选[D].泰安:山东农业大学,2016.
[18] 李俊香,洪霓,古勤生.甜瓜靶斑病病原菌的生物学特性[J].中国瓜菜,2019,32(10):11-17.
[19] Marie Dufresne, Theo van der Lee, Sarrah Ben MBarek, et al. Transposon-tagging identifies novel pathogenicity genes in Fusarium graminearum[J]. Fungal Genetics and Biology, 2008, 45(12): 1552-1561.
[20] 胡文静,张春梅,吴迪,等.长江中下游小麦抗赤霉病品种的筛选与部分农艺性状分析[J].中国农业科学,2020,53(21):4313-4321.
[21] 贾娇,张伟,孟玲敏,等.吉林省玉米根腐镰孢菌种类鉴定和防治药剂筛选[J].玉米科学,2019,27(05):176-180.
[22] Ye Jianrong, Zhong Tao, Zhang Dongfeng, et al. The Auxin-Regulated Protein ZmAuxRP1 Coordinates the Balance between Root Growth and Stalk Rot Disease Resistance in Maize[J]. Molecular plant, 2019, 12(03): 360-373.
[23] 赵璐藐,刘瑞玲,郜海燕,等.茭白采后主要致腐真菌鉴定及生物学特性研究[J].核农学报,2019,33(12):2354-2361.
[24] 边小荣.兰州百合枯萎病病原鉴定及病原菌生物學特性研究[D].兰州:甘肃农业大学,2016.
[25] 吴小龙.玉米青枯病菌的鉴定、生物学特性及生物防治研究[D].雅安:四川农业大学,2010.
[26] 谷春艳,潘锐,白杨,等.7种杀菌剂对小麦赤霉病菌的室内毒力及田间防效比较[J].现代农药,2020,19(05):39-42.
(责任编辑:丁志祥)

