贵州火龙果溃疡病病原菌鉴定及生物学特性
赵晓珍, 柏自琴, 王 荔, 李兴忠, 郑 伟, 王 彬
(贵州省农业科学院 果树科学研究所, 贵州 贵阳 550006)
0 引言
【研究意义】火龙果溃疡病是一种真菌性病害,危害大,对贵州火龙果溃疡病病原菌进行鉴定,并开展生物学特性研究,对该病害的防治及提高贵州火龙果品质具有重要的实际意义。【前人研究进展】火龙果溃疡病在火龙果上发生最为普遍和严重,在我国广西、广东、台湾、贵州等地普遍发生[1-5],在马来西亚、以色列、美国等国家均有发生[6-8]。火龙果溃疡病主要危害火龙果枝条及果实,发病初期在茎及果实上形成褪绿色小点,严重时病斑连成片,后期病斑突起,湿度大时,病斑边缘形成水浸状,不断扩大,腐烂,溃疡病的发生严重影响火龙果的产量和品质。近年来,火龙果溃疡病病原菌研究受到关注,有研究表明,在马来西亚以及我国台湾、广东、海南等地引起火龙果溃疡病的病原菌为Neoscytalidiumdimidiatum[9-10]。【研究切入点】贵州省火龙果种植面积约6 500 hm2,规模位居全国第5位,种植主要分布在罗甸、镇宁、关岭、贞丰、望谟等低热河谷地区。随着贵州火龙果种植面积的不断扩大,火龙果病害发生日趋严重,主要病害有炭疽病、黑斑病、枯斑病等[11-13]。近几年,贵州火龙果主产区大面积发生火龙果溃疡病,严重影响了贵州火龙果的品质和产量[1],而目前未见贵州火龙果溃疡病的相关研究报道。【拟解决的关键问题】采用常规组织分离法、形态学与分子生物学鉴定相结合,对火龙果病原菌进行分离、鉴定,并开展病原菌生物学特性研究,明确引起贵州省火龙果溃疡病的病原,为该病的防治及病原菌的碳氮源代谢研究奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 感病植株样品 火龙果品种为黔蜜龙,病样于2018年采于贵州省镇宁县。
1.1.2 试剂与仪器 Ezup柱式真菌基因组DNA抽提试剂盒为上海生工生物工程股份有限公司生产,Takara Ex Taq Hot Start Version为宝生物工程有限公司生产,D-葡萄糖、硫酸钠、磷酸二氢钾均为Sigma公司生产。Biolog PM系统,PMl、PM2和PM3微孔板,FF-IF接种液。
1.2 方法
1.2.1 病原菌的分离与纯化 采集病样植株,用自来水和无菌水冲洗干净后,采用常规组织分离法[14]取病健交界处3 mm×3 mm的组织,于75%的酒精中浸泡3 s,5%次氯酸钠溶液浸泡4~5 min,再用灭菌水洗4~5次,于灭菌滤纸上干燥后置于马铃薯葡萄糖琼脂(PDA)培养基平面上,于26℃培养箱中进行培养。待组织周围长出菌落后,挑取菌落边缘菌丝进行纯化。
1.2.2 病原菌的致病性测定 将分离出的H1菌株于28℃培养箱中培养5 d,在菌落边缘取5 mm的菌饼,采用针刺接种法将菌饼接种于刺伤的火龙果茎上,以接种无菌PDA培养基块的火龙果茎作对照,置于保鲜盒中,于28℃培养箱中恒温保湿培养,每处理3次重复,观察发病情况,对回接试验中发病的火龙果茎进行再次分离、鉴定,根据柯赫氏法则确定H1菌株是否为致病菌株。
1.2.3 病原菌的鉴定
1) 形态学鉴定。将纯化后的致病菌株H1接种于PDA培养基上,于28℃培养箱中恒温培养,观察菌落形态,显微镜观察分生孢子形态,并记录拍照。
2) 分子生物学鉴定。采用PDA培养基培养菌株H1,收集菌丝,采用Ezup柱式真菌基因组DNA试剂盒,按说明书提取菌株H1的基因组DNA;采用真菌ITS序列通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[15]对H1菌株基因组DNA进行rDNA-ITS基因扩增。PCR产物经琼脂糖凝胶电泳检测后送上海生工生物工程有限公司纯化后进行测序。测序结果通过NCBI进行比对分析,获得高相似性菌株,采用MAGA 6.0软件比对校正后,采用Neighbor-Joining法构建系统进化树。
1.2.4 病原菌生物学特性鉴定
1) 温度。将在PDA培养基上培养3 d的病原菌,用直径为5 mm的灭菌打孔器打取菌饼,将菌饼接种于备用PDA培养基中,分别置于5℃、10℃、15℃、20℃、25℃、28℃、30℃、35℃、40℃、45℃的恒温培养箱中黑暗培养3 d,每处理重复3次,用“十字交叉法”测量菌落直径。
2) pH值。将直径为5 mm的病原菌菌饼分别接种于pH为4.0、5.0、6.0、7.0、8.0、9.0、10.0的PDA培养基上,28℃恒温培养箱中黑暗培养3 d,每处理重复3次,用“十字交叉法”测量菌落直径。
3) 光照。设置5种光照条件,分别为24 h黑暗、24 h光照、12 h黑暗/12 h光照、紫外光5 min+24 h光照、紫外光+12 h黑暗/12 h光照。将直径为5 mm的病原菌菌饼接种于PDA培养基上,再分别置于不同光照条件下培养3 d,每个处理重复3次,用“十字交叉法”测量菌落直径。
4) 碳氮源的利用。采用Biolog表型芯片技术,参考WANG等[16-17]的方法测定火龙果溃疡病菌对PM碳氮源代谢。将致病菌株H1于PDA培养基上28℃黑暗培养3 d,用少量无菌蒸馏水洗下分生孢子,配制1×105个/mL的孢子悬浮液。用FF-IF接种液调整孢子悬浮液浓度,使其透光度为62%T(T为Biolog标准浓度单位),将孢子悬浮液分别接种至PMl、PM2微孔板中,每孔100 μL;往62%T孢子悬浮液中加入葡萄糖,磷酸二氢钾和硫酸钠,使其在孢子悬浮液中的终浓度分别为100 mmol/L、5 mmol/L和2 mmol/L,再将此孢子悬浮液接种至PM3微孔板中,每孔100 μL。将PMl、PM2和PM3板置Biolog系统培养箱中28℃培养5 d,由OmniLog 2.4系统每15 min读数1次。
1.3 数据分析
采用MAGA 6.0对火龙果溃疡病病菌的rDNA-ITS序列数据进行处理和构建进化树,通过SPSS 24进行单因素方差分析,采用邓肯氏新复极差(DMRT)法进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 火龙果溃疡病症状
从图1看出,火龙果溃疡病主要危害火龙果茎及果实,发病初期在茎及果实上形成褪绿色小点,逐步扩大形成褪绿斑,严重时病斑连成片,褪绿斑逐渐变成黄色和红色,后期病斑突起,湿度大时易受其他病原侵入,病斑边缘不断扩大,黄化腐烂。
2.2 病原菌分离及致病性
采用组织分离法分离得到优势菌株H1,采用刺伤接种法将分离纯化后的菌株H1接种至健康火龙果枝条上,接种5 d后症状明显,接种菌饼部位均有明显病斑,且周围产生褪绿小点;8 d后接种部位逐渐扩大,病斑凸起明显;18 d后病斑周围逐步扩大黄化腐烂,与田间症状相似,而对照未见明显病斑。从接种后发病的部位重新分离,观察菌落、孢子形态等结果与菌株H1一致,说明分离出的H1菌株为火龙果溃疡病病原菌。
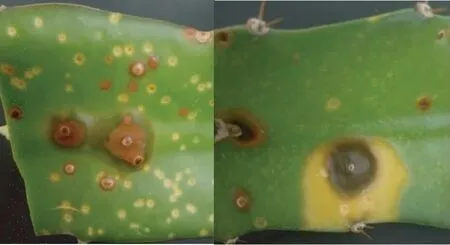
图1 火龙果溃疡田间症状
2.3 病原菌鉴定
2.3.1 形态特征鉴定 H1菌株在PDA培养基上菌落呈圆形,边缘较整齐,在28℃条件下生长迅速,气生菌丝发达,细绒毛状,菌落初期灰白色(图2A-B);3 d以后培养基逐渐变黑,7 d时培养基完全变为黑绿色(图2C-D)。病原菌在培养过程中,菌丝会断裂形成节孢子链,节孢子无隔膜或有隔膜(图3A);分生孢子形态多样,有圆形、椭圆形、杆状等,有隔膜或无隔膜(图3B)。根据H1菌株的菌落形态和显微形态,与报道的火龙果溃疡病原菌新暗色柱节孢(Neoscytalidiumdimidiatum)相似[3,10],初步确定致病菌株H1为新暗色柱节孢菌。
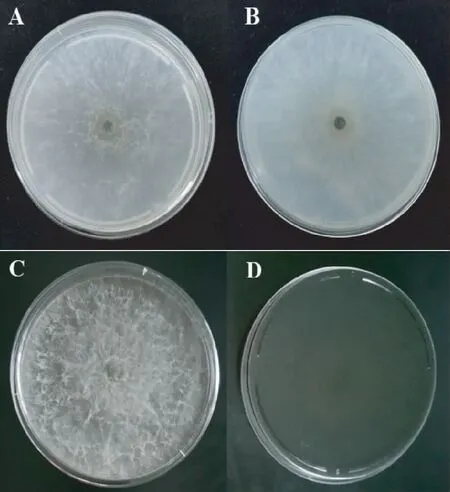
注:A、B分别为培养3 d菌落的正、反面,C、D分别为培养7 d菌落的正、反面。
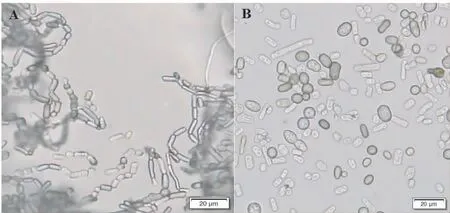
注:A为节孢子链,B为分生孢子。
2.3.2 分子生物学鉴定 将致病菌株H1的rDNA-ITS序列在NCBI数据库中进行BLAST比对分析,结果(图4)显示,菌株H1与Neoscytalidiumdimidiatum(登录号:HQ439174.1,JX473739)的相似性达99%以上。选取已报道的火龙果溃疡病菌(Neoscytalidiumdimidiatum)(登录号:JX524168.1、KF812550)[10, 18]以及在李和杏上发现的Neoscytalidiumdimidiatum[19-20](登录号分别为MH676062、MK788362),采用MAGA 6.0软件经过比对校正后,用Neighbor-Joining法构建系统发育树,结果(图4)表明,致病菌株H1与Neoscytalidium dimidiatum处于同一分支,与Neoscytalidiumdimidiatum的异名属Scytalidium的不同种处于不同分支。结合形态学分析,确定引起贵州火龙果溃疡病的病原为新暗色柱节孢(Neoscytalidiumdimidiatum)。
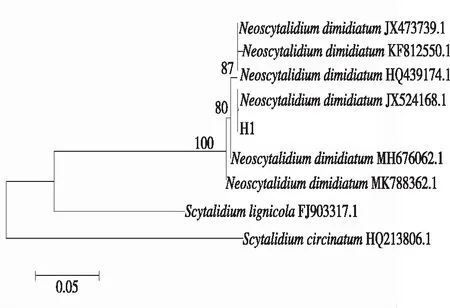
图4 菌株H1基于rDNA-ITS基因的系统发育树
2.4 病原菌生物学特性
2.4.1 不同温度下病原菌的生长情况 从表1看出,病原菌在PDA平板上生长3 d时,不同温度下菌落直径差异明显,病原菌菌丝在20~40℃下均能生长,最适温度为28℃,菌落直径达71.50 mm,显著大于其他温度条件。温度高于35℃和低于20℃时生长受到明显抑制;45℃和15℃时菌丝停止生长。说明病原菌相对耐高温。
2.4.2 不同pH下病原菌的生长情况 从表2看出,培养3 d时火龙果溃疡病病原菌在培养基pH 4~10中均可生长,最适pH为6~7,菌落平均直径分别为73.6 mm和72.5 mm,无显著性差异。pH为10时菌落平均直径为27.3 mm, pH为4时为59.5 mm。
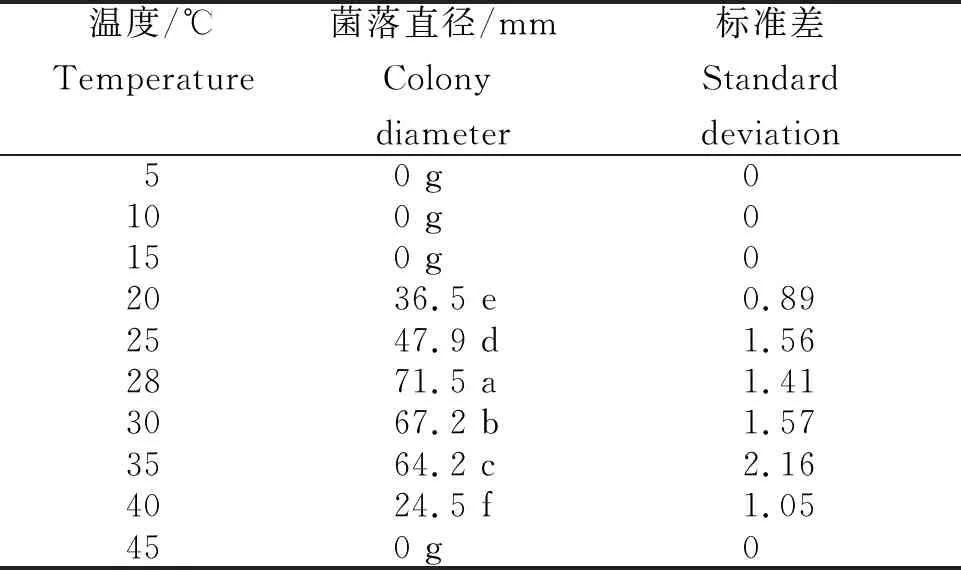
表1 病原菌在不同温度下生长的菌落直径
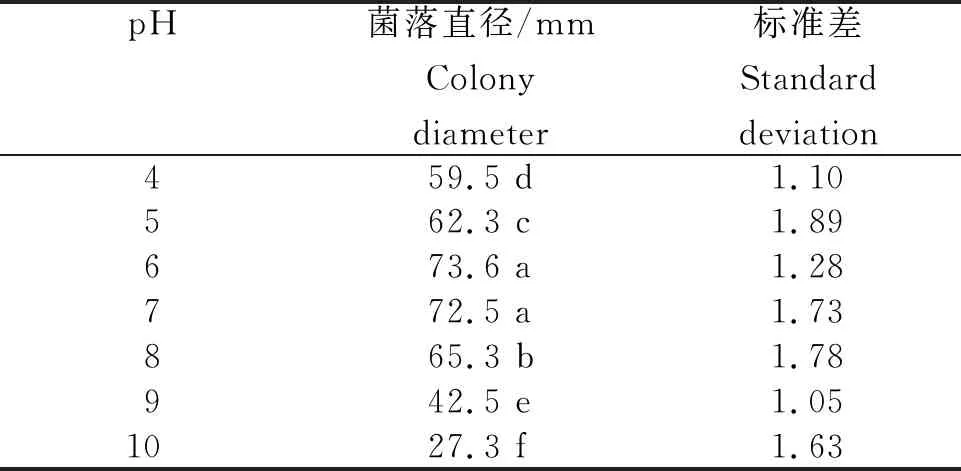
表2 火龙果溃疡病病原菌在不同pH下生长的菌落直径
2.4.3 不同光照条件病原菌的生长情况 从表3看出,火龙果溃疡病病原菌在不同光照条件下均能生长,而在连续光照、连续黑暗、光暗交替条件下病原菌菌落大小有显著差异。连续黑暗条件下菌落直径显著大于光照和光暗交替条件。说明光照对菌丝生长有一定的抑制作用,但短时间的紫外光照射对菌丝生长有促进作用。
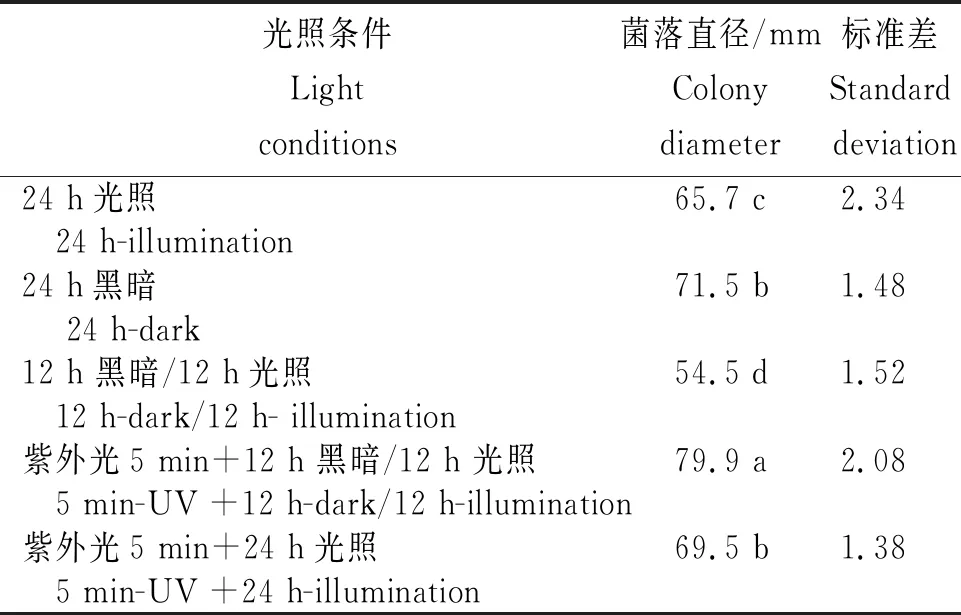
表3 火龙果溃疡病病原菌在不同光照条件下生长的菌落直径
2.4.4 碳氮源种类利用 通过代谢表型组学分析(图5),火龙果溃疡病病原菌对PMl、PM2微孔板中190种碳源物质的平均利用率为18.42%,利用较好的碳源为b-甲基-D-葡萄糖苷、L-半乳糖酸-g-内酯、D-半乳糖醛酸、丙二酸等32种。PM3微孔板中95种氮源物质的平均利用率为52.63%,利用较好的为L-色氨酸、丙氨酸-天冬氨酸、丙氨酸-谷氨酰胺、丙氨酸-苏氨酸、甘氨酸-天冬酰胺等32种。对PMl、PM2微孔板中利用较多的碳源物质分别为12种和20种,对PM3微孔板中氮源物质利用较多的有32种(表4)。
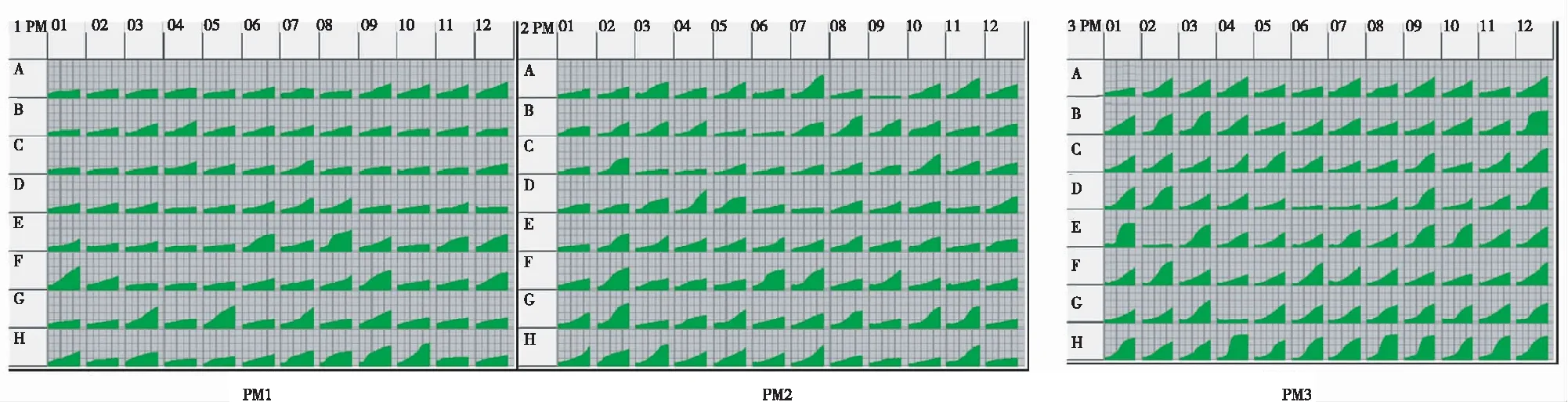
图5 火龙果溃疡病菌对PM1、PM2微孔板中碳源及PM3微孔板中氮源的代谢图谱
3 讨论
火龙果溃疡病是火龙果上发生最为严重的病害之一,在马来西亚、以色列、弗洛里达州等地及我国台湾、广东、广西、海南均有报道[4-10],病原主要为新暗色柱节孢(Neoscytalidiumdimidiatum)。本研究通过分离、致病性测定、形态学观察以及ITS序列分析,明确引起贵州火龙果溃疡病的病原为新暗色柱节孢(Neoscytalidiumdimidiatum),与已报道的火龙果溃疡病病原一致。张荣等[21]研究表明,火龙果溃疡病在病原菌温度为32~34℃,pH为3~4的酸性环境下生长最快。易润华等[10]研究表明,火龙果溃疡病病原菌在25~35℃为适宜生长温度,30℃为最佳生长温度,pH为8时菌丝生长速度最快,光照促进菌丝生长,黑暗条件利于产孢。戴俊等[22]研究表明,火龙果溃疡病病原菌最佳生长温度为28℃,生长环境偏酸性。本研究结果表明,贵州火龙果溃疡病病原菌在20~40℃均能生长,最佳生长温度为28℃,温度在35℃时病原菌落明显大于20℃,即病原菌较耐高温;病原菌在pH 4~10均可生长,最适宜生长的pH为6~7,生长环境偏酸性;黑暗条件利于病原菌的生长,与以上报道的病原菌适宜高温、偏酸性环境的整体趋势一致,但仍然存在差异,这可能与各地生产环境差异有一定关系。
4 结论
贵州火龙果溃疡病病原为新暗色柱节孢(Neoscytalidiumdimidiatum);病原菌较耐高温,最佳生长温度为28℃,最适宜生长的pH为6~7,生长环境偏酸性;黑暗条件利于病原菌的生长。火龙果溃疡病原菌对PMl、PM2微孔板中190种碳源物质的平均利用率为18.42%,利用较好的碳源为b-甲基-D-葡萄糖苷、L-半乳糖酸-g-内酯、D-半乳糖醛酸、丙二酸等32种;对PM3微孔板中95种氮源物质的利用率为52.63%,利用较好的为L-色氨酸、丙氨酸-天冬氨酸、丙氨酸-谷氨酰胺、丙氨酸-苏氨酸、甘氨酸-天冬酰胺等32种。研究结果对贵州火龙果溃疡病的防治及溃疡病菌与火龙果植株互作过程中病原菌的碳氮源代谢研究奠定了理论依据。

