小蓬竹内生真菌培养分离条件的优化
颜 强, 柳嘉佳, 刘济明
(1.贵州省社会科学院, 贵州 贵阳 550002; 2.贵州省农业科学院 草业研究所, 贵州 贵阳 550006; 3.贵州大学 林学院, 贵州 贵阳 550025)
0 引言
【研究意义】小蓬竹[Drepanostachyumluodianense(Yi et R. S. Wang) Keng f.]系竹亚科镰序竹属,其地下茎属合轴型,杆柄短缩,竹杆在地面密集丛生。小蓬竹是我国特产竹种,在《中国物种红色名录》和《IUCN红色名录》中小蓬竹均被列为极危种[1]。目前小蓬竹主要分布在贵州省罗甸县、贞丰县、紫云苗族布依族自治县、长顺县、平塘县、望谟县、册亨县、安龙县及惠水县等喀斯特山地,且大多生长于海拔300~1 200 m的坡地上。植物内生真菌能促进植物对土壤养分和水分的吸收,提高植物生物量,维持植物生长和群体结构,对于被列为极危种的小蓬竹生长繁殖具有重大意义。【前人研究进展】植物内生真菌(endophytic fungi)是指在其生活史的一定阶段,或全部阶段生活于健康植物各组织和器官内的真菌[2-5]。21世纪,有关植物内生真菌功能活性的研究主要集中在抗菌活性、抗肿瘤以及增强宿主抗逆性等方面[6-8],而随着其研究的发展,不断向植物病理学、植物微生态学、生物防治、植物保护、药物开发等领域扩展[9]。研究表明,香柱菌属真菌Epichloegansuensis可以抑制醉马草上白粉病菌Blumeriagraminis的定殖;短叶紫杉的内生真菌可以合成抗癌活性物质;紫杉醇木霉是可用于植物病害生物防治重要的内生真菌。因此,植物内生真菌在宿主植物生态和生理作用及其作为潜在生防资源和外源基因载体[10],在农业、生态恢复、医药领域[11]中的应用前景十分广阔。小蓬竹是喀斯特地区可用于固土保水、改变土壤理化性质的极濒危适生竹种,目前研究多是小蓬竹种群、群落及不同处理下的生理特征响应,关于小蓬竹内生真菌的分离方法尚未见报道。【研究切入点】适当的分离方法是获取菌种用于多样性研究的关键。在植物内生真菌分离过程中,必须设计合适的表面灭菌方法、表面灭菌效果检测方法和分离培养方法,保证植物内生真菌的分离效果[12]。【拟解决的关键问题】通过对比不同表面消毒方法、效果检测方法,并优化培养分离条件,以期为小蓬竹内生真菌多样性的研究提供支撑。
1 材料与方法
1.1 材料
1.1.1 小蓬竹 采自贵州省罗甸县。
1.1.2 培养基
1) 水琼脂双抗固体培养基。琼脂1.5%、定容1 000 mL,灭菌后加入庆大霉素150 μg/mL和青霉素100 μg/mL。
2) 双抗PDA培养基。马铃薯200 g,琼脂16 g,葡萄糖15 g,定容至1 000 mL, pH自然,灭菌后加入庆大霉素150 μg/mL和青霉素100 μg/mL。
3) 孟加拉红培养基(马丁氏培养基)。成品,直接称量后用蒸馏水溶解。
4) 麦芽汁葡萄糖琼脂培养基(MGA)。麦芽膏20 g,蛋白陈1 g,葡萄糖20 g,琼脂16 g,蒸馏水1 000 mL。
5) 察氏培养基(czapek agar)。硝酸钠3 g,磷酸氢二钾1 g,硫酸镁(MgSO4·7H2O)0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,琼脂15 g,蒸馏水1 000 mL。
1.2 方法
1.2.1样品采集小蓬竹采样地位于贵州省罗甸县周边,地理位置为东经 106°45′17″、北纬 25°30′39″,试验地位于坡下位,分别设置5个样地(5 m×5 m),每个样地间隔30 m。选取3点进行土壤因子调查,根据立竹径级与年龄分布规律,从中随机抽取生长良好、无病虫害的10株[13]作为标准竹丛,整丛挖出,筛选出色泽鲜艳、健康的植株,将植株分为根、茎、叶,茎分为上中下3部分,分别取样分装并编号,用装有冰袋的取样箱带回。
1.2.2 试验预处理 取小蓬竹1年生和多年生(3年以上)竹杆用保鲜袋带回实验室,自来水彻底冲洗竹各部位表面土壤,无菌滤纸吸干,用剪刀和无菌刀将根、茎分别剪成10 mm×10 mm×(8~10 mm)方块,叶采用刀片横截面法截取成10 mm×10 mm×2 mm的方块,转移到无菌操作台后,用75%酒精浸泡1 min,无菌水冲洗3次,然后用不同活性氯浓度的NaClO浸泡不同时间,75%酒精浸泡30 s,无菌水漂洗5次,无菌滤纸吸干。消毒后,无菌刀片削去组织块两端,切成4 mm×4 mm×(2~3)mm的组织块, 然后分别接种于双抗PDA培养基,每个培养基平板接种6个组织块,每处理5个重复,根、茎、叶各30个组织块,转到真菌培养箱,28℃恒温培养。
1.2.3 表面消毒 试验选用NaClO作为分离小蓬竹内生真菌的主要表面消毒剂,75%酒精作为辅助表面消毒剂。先用75%乙醇消毒1 min,用无菌水洗涤3次,分别用不同浓度NaClO溶液浸泡不同时间(处理A~D:含有效氯5%NaClO溶液消毒0.5 min、1 min、2 min和3 min;处理E~H:含有效氯2.5%NaClO溶液消毒1 min、2 min、3 min和5 min),再用75%乙醇消毒0.5 min,无菌水洗涤5次。对不同表面消毒的组织进行无菌检测,根据定殖率确定最佳分离植物内生真菌的表面灭菌强度,根、茎、叶视组织幼嫩程度适当增减时间。
定殖率=出现内生真菌的组织块数/总分离组织块数×100%
1.2.4 分离培养基的选择 选择双抗PDA培养基、麦芽汁葡萄糖琼脂培养基(MGA)、孟加拉红培养基和察氏培养基分别作为小蓬竹根部内生真菌的分离培养基,观察和比较各培养基内生真菌的分离效果后,选择最佳培养基进行其他部位内生真菌的分离和纯化。将上述的根组织块,按小蓬竹根部表面消毒的最佳方式消毒后,分别接种到4种培养基中,每个培养基接种6块,每种培养基10次重复,置培养箱暗室26℃培养,观察记录并计算小蓬竹内生真菌的分离情况。
1.2.5 优化分离培养条件 在分离培养基的预试验中,由于培养基中均出现了快生真菌疯长的情况,培养3~4 d就可以铺满覆盖整个平板, 8 d左右所有平板全部被覆盖,导致慢生型内生真菌没有生长空间,无法分离。为了获得更多种类和数量的内生真菌,应该加强观察,除及时将长出的菌分离转移外,还应对分离培养条件进行优化。
1) 培养基营养物质浓度的优化。在双抗PDA培养基的基础上,将其分别稀释为100%、50%、25%、10%浓度的培养基,以水琼脂双抗固体培养基作对照,分别接种表面消毒后的根部组织块,每个培养基接种6块,每种培养基5次重复,置培养箱暗室25℃培养,观察记录各浓度双抗PDA菌株种类数[12,14]。
2) 培养基琼脂块的优化。借鉴参考文献[15]的单丝菌团分离法中的处理,将平板中的圆形琼脂块,切割成6个长约为20 mm的方形琼脂块,并均匀分布在平板中(图1)。

图1 琼脂块的优化
2 结果与分析
2.1 不同消毒方法处理小蓬竹不同部位的定殖率
从表1可知,不同消毒方法处理小蓬竹根、茎和叶的定殖率。
2.1.1 根 在含2.5% 的NaCIO 5 min、5%的NaCIO溶液3 min的条件下,都不长菌,表明处理D和H都可以使根的表面消毒彻底,但高浓度的长时间处理相比低浓度长时间处理,NaCIO溶液浓度虽较高但定殖率较低。可能是由于随着植物样品在消毒剂中浸泡时间越长,高浓度次氯酸钠浸入植物材料内部,杀死分布在表皮以下甚至分布更深的内生真菌,因此,内生真菌消毒的NaCIO溶液浓度越高,内生真菌定殖率越低[12]。故处理H(2.5%NaCIO溶液浸泡3 min)为小蓬竹根部表面消毒的最佳方式。
2.1.2 茎 处理C、D、F、G、H均可消毒彻底,处理F(2.5%NaClO 3 min)的内生真菌萌动时间较短,且内生真菌的定殖率最高,为70.0%,是最佳表面消毒方式。处理F、G和H,在相同NaClO浓度,随消毒时间延长内生真菌出菌时间延长、定殖率降低,表明长时间消毒会杀死组织内部的真菌。因此,应在消毒彻底的基础上尽量减少消毒时间,以获取更多的内生真菌数量与种类。
2.1.3 叶 处理E和F均可消毒彻底,且定殖率均达100%。但考虑到小蓬竹叶片组织纤薄幼嫩,为减少对内生真菌数量的影响,故选取处理E(2.5% NaClO 1 min)为叶的最佳表面消毒方式。处理C、D和G,由于消毒时间过长,导致内生真菌萌动时间大大延长,定殖率极低;而处理H在培养周期10 d内没有长出内生真菌,定殖率为0,推测可能由于消毒时间过长,NaClO溶液浸入到组织内部,杀死了绝大多数甚至全部内生真菌。
2.2 小蓬竹根部内生真菌在不同分离培养基上的菌落数及种类
由表2可知,不同分离培养基上的菌落数和种类存在一定的差异。在双抗PDA培养基中分离得到的菌落数和种类最多,分别为42个和7种;孟加拉红培养基虽然分离得到的种类也是7种,但菌落数量是4种培养基中最少的,仅31种。MGA培养基与察氏培养基分离得到的菌落数及种类都相对较少。因此,试验选用双抗PDA培养基为小蓬竹内生真菌的分离培养基。
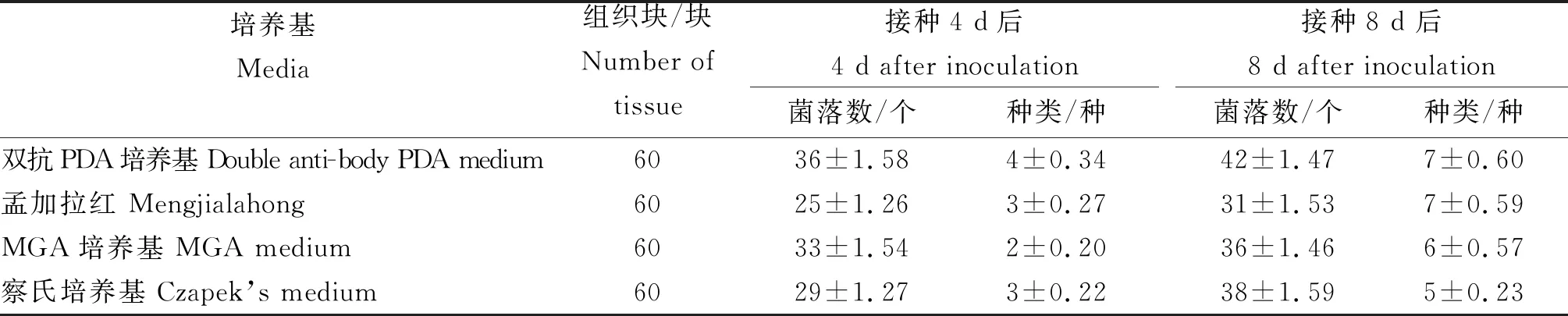
表2 小蓬竹根部内生真菌在不同培养基上的菌落数及种类
2.3 小蓬竹根部内生真菌的最佳分离培养条件
由表3可知,培养14 d后,不同分离培养基上的真菌覆盖平板时间与可分离菌株种类存在较大差异。水琼脂双抗固体培养基,由于培养基中营养物质贫乏,可分离菌株种类数较少。快生型内生真菌的菌丝生长也极为缓慢,且大都完全贴着平板壁生长,气生菌丝稀疏如雾状,使得不同菌株之间菌落形态差异不明显,很难准确辨认挑取不同菌株进行纯化;慢生型真菌受营养物质限制,短时间内难以出菌。10%双抗PDA培养基,与水琼脂双抗固体培养基情况类似,稍有不同的是有个别培养基上存在快生型内生真菌,稀疏的菌丝铺满平板。双抗PDA培养基随着浓度由100%依次稀释为50%、25%,快生型内生真菌覆盖平板的时间逐渐延长,而可分离菌株种类数却逐渐增加。表明适宜浓度的营养物质可以使内生真菌正常生长而不致于营养过剩而疯长,快生型内生真菌的生长受到抑制,从而为慢生型真菌的生长留出相对的空间和资源,以致可以分离更多种类的内生真菌。综上所述,25%双抗PDA培养基、培养温度26℃为小蓬竹内生真菌的最佳分离培养基。

表3 不同浓度双抗培养基处理小蓬竹根部内生真菌的生长
3 讨论
植物组织表面消毒应最大限度杀死附着在植物表面的任何微生物,但对植物组织中内生真菌的影响降至最小,还要尽量不损伤或少损伤样品材料。选用具有毒性小、易挥发、不易残留等特性的NaClO溶液作为主要消毒剂,75%的酒精作为辅助消毒剂,无菌水漂洗数次,此法是物理和化学相结合的应用最广泛的三步消毒法。试验表明,低浓度长时间处理所分离的内生真菌种类相对较少,而高浓度短时间处理分离的内生真菌种类相对较多,与陈静等[12]的研究结果一致。小蓬竹叶表面消毒的最佳方式为2.5% NaClO溶液1 min;小蓬竹茎表面消毒的最佳方式为2.5% NaClO溶液2 min;小蓬竹根表面消毒的最佳方式为5% NaClO溶液3 min,消毒彻底,并且对内生真菌的分离影响最小。
在内生真菌分离过程中,分离培养条件对内生菌的数量和种类至关重要。如果分离培养条件不当,可能会使某些内生真菌生长缓慢甚至不生长,或多种内生真菌生长到一起,造成难以辨认,不易挑取和分离等。试验对双抗PDA培养基、MGA、孟加拉红培养基和察氏培养基进行比较后,筛选得到双抗PDA培养基为最佳,而后又通过培养基营养物质浓度及琼脂块切割解决快生型内生真菌将平板全部覆盖,导致慢生型内生真菌没有生长空间无法分离的问题。前者主要是通过适度降低培养液的浓度抑制快生型真菌,给慢生型菌株留下生长空间;后者主要是通过切割增大不同琼脂块的间隔以阻隔快生型真菌占据整个平板。试验表明,25%双抗PDA培养基、培养温度26℃作为小蓬竹分离内生真菌的最佳条件,可最大限度分离小蓬竹的内生真菌。试验仅对根部内生真菌的最佳分离条件进行研究,其茎叶内生真菌的最佳分离条件可参考根部进行。
菌株的分离是进行内生真菌多样性研究的基础。但是,关于内生真菌的分离仍存在许多问题需要解决,主要表现在以下方面:1) 由于植物不同组织致密性与所富含营养物质的不同,以及单一培养基、pH、温度的影响,部分根、茎、叶中的部分内生真菌没有分离出来。研究对小蓬竹表面消毒、分离培养基的筛选与优化进行了较为系统的研究,但只用根组织为代表从4种培养基中筛选最佳培养基,适宜在其他培养基上生长的菌株可能被漏筛。故今后应同时采用多种培养基,改良培养基成分(如采用不同组织部位煎汁培养基),有效提高内生真菌的分离率。2) 有研究表明,部分寄生性很强的内生真菌不能在人工培养基上生长,即使综合使用多种培养基培养植物组织,也难以保证全部分离植物组织中的内生真菌。对于此类不可分离培养内生真菌的鉴定可采用非分离培养方式如提取总DNA法鉴定组织内生真菌[16]。
4 结论
小蓬竹根、茎、叶在最佳表面消毒处理后的定殖率分别为83.3%、70%、100%,在25%双抗PDA培养基、培养温度26℃最佳分离条件下,根部内生真菌分离到菌株10~12种。

