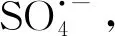过硫酸盐氧化Fe(Ⅱ)生成Fe(Ⅳ)降解二甲基异莰醇和土臭素的效能和机理
韦 洁,段杰斌,张 茜,王永广,杨兢欣,董紫君,*
(1.扬州大学环境科学与工程学院,江苏扬州 225127;2.深圳职业技术学院城市水良性循环工程研发中心,广东深圳 518055;3.广州大学大湾区环境研究院,广东广州 510006)
饮用水嗅味问题频繁发生给人们的生活造成了巨大的影响, 2-MIB和GSM是目前饮用水源中检测出的嗅味物质[1-2]。研究发现,当水体发生水华时,水体中的2-MIB和GSM浓度高达1 000 ng/L[3]。《生活饮用水卫生标准》(GB 5749—2006)中规定了2-MIB和GSM的阈值均不能高于10 ng/L[4],目前的常规水处理工艺对这2种物质的去除效果有限[5]。因此,选择合适的工艺来尽可能地去除水中的2-MIB和GSM,对提高饮用水品质至关重要。近年来,Fe2+/PDS体系作为一种新兴的高级氧化方法,在水体中污染物去除方面表现优异。用Fe2+/PDS体系去除水中的砷,去除效果良好,去除率可达到90%[6];用Fe2+/PDS体系降解三氯苯甲醚,降解率较高,可达到82%[7]。基于Fe2+/PDS体系对污染物的降解效果,预测该体系能有效降解水中的2-MIB和GSM,因此,本试验采用Fe2+/PDS体系降解2-MIB和GSM。
本试验研究了2-MIB和GSM在Fe2+/PDS体系中的降解效果,以及Fe2+/PDS体系降解2-MIB和GSM的活性物质;考察了Fe2+浓度、PDS浓度、pH对反应体系的影响,以及Fe2+/PDS体系对实际水体中2-MIB和GSM的降解效果。
1 试验部分
1.1 试验试剂和仪器设备
试剂:过硫酸钠(Na2S2O8、PDS)、七水合硫酸亚铁(FeSO4·7H2O)、硫代硫酸钠(Na2S2O3)、氯化钠(NaCl)、四亚甲基亚砜(TMSO)、四亚甲基砜(TMSO2)、浓硫酸(H2SO4)、氢氧化钠(NaOH)、2-MIB和GSM的混标液、2-甲氧基-3-异丁基吡嗪(2-isobutyl-3-methoxy pyrazine,IBMP)的标准溶液等均为分析纯试剂,购置于上海国药集团;甲醇、乙腈为高效液相色谱纯,购置于阿拉丁网站;试验用水均为Mill-Q超纯水。
仪器:气质联用仪(7890BGC-5977BMS);Waters7980高效液相色谱(美国Waters公司);SHZ-B型水浴恒温振荡器(上海跃进医疗器械有限公司);ME204E电子天平[梅特勒-托利多仪器(上海)有限公司]; pH7310型pH计(厦门陇力德环境技术开发有限公司)。
1.2 试验方法
取已知浓度的2-MIB和GSM的混标液于1 L的锥形瓶中稀释至500 mL,确保反应体系中的2-MIB和GSM的浓度为1 000 ng/L,用5 mmol/L H2SO4和5 mmol/L NaOH调节至需要的pH,依次加入计算浓度的过硫酸钠(PDS)和硫酸亚铁(FeSO4)开始反应,反应在水浴恒温振荡器中进行。反应时间为2 h,于0、5、15、30、60、90、120 min时取样,加入到含有6 g NaCl和200 ng/L的内标液IBMP的棕色样品萃取瓶中,再加入适量浓度的Na2S2O3作为终止剂,终止反应。
1.3 检测方法
1.3.1 固相微萃取(solid phase microextration,SPME)操作方法
2-MIB和GSM采用固相微萃取的方法进行测定。在萃取前先将固相微萃取膜在GC/MS进样口250 ℃进行老化,第一次使用老化30 min,非第一次使用老化5 min。向40 mL棕色顶空瓶中加入25 mL水样,内标IBMP浓度为200 ng/L,然后加入6 g在200 ℃烘干2 h的NaCl,将顶空瓶放置在磁力搅拌器上进行搅拌和加热,温度维持在(60±1) ℃,转速为200 r/min。萃取30 min后,使用GC/MS进行检测分析。
1.3.2 GC/MS检测条件
GC条件:载气为高纯氦气(99.999%),柱中流速为1 mL/min,不分流进样;初始柱温为60 ℃,保持3 min,以6 ℃/min升温至150 ℃,再以15 ℃/min升温至250 ℃,保持3 min;进样口温度为250 ℃。
MS条件:离子源温度为200 ℃;接口温度为250 ℃。
1.3.3 TMSO和TMSO2的HPLC检测方法
C18色谱柱(4.6 mm×250 mm;5 μm),流动相为V(乙腈)∶V(水)=60∶40,紫外检测波长为212 nm,流速为1 mL/min,进样量为100 μL。
1.3.4 甲醛的检测方法
甲醛浓度的测定采用乙酰丙酮法[8]。
2 结果与讨论
2.1 Fe2+/PDS体系降解2-MIB与GSM的效果
为了考察Fe2+/PDS体系对2-MIB和GSM的降解效果,开展了单独的Fe2+、单独的PDS及Fe2+/PDS降解2-MIB和GSM的试验。由于2-MIB和GSM为易挥发的嗅味物质,设置了空白试验,2-MIB和GSM的转化率分别为7.41%和5.52%,结果如图1和图2所示。在pH值为3、Fe2+和PDS的浓度均为1.0 mmol/L、温度为25 ℃的条件下,反应体系中单独投加PDS及单独投加Fe2+对2-MIB和GSM的降解效果不佳,2-MIB的降解率为7.41%、7.93%和6.88%,GSM的降解率为5.52%、5.97%和5.06%。利用Fe2+活化PDS的高级氧化体系中2-MIB的降解率可以达到99.10%,GSM的降解率达到83.08%。相比于空白及单独投加Fe2+或者PDS,降解率明显大幅度提高,因此,Fe2+/PDS体系具有应用于实际水体处理的潜力。
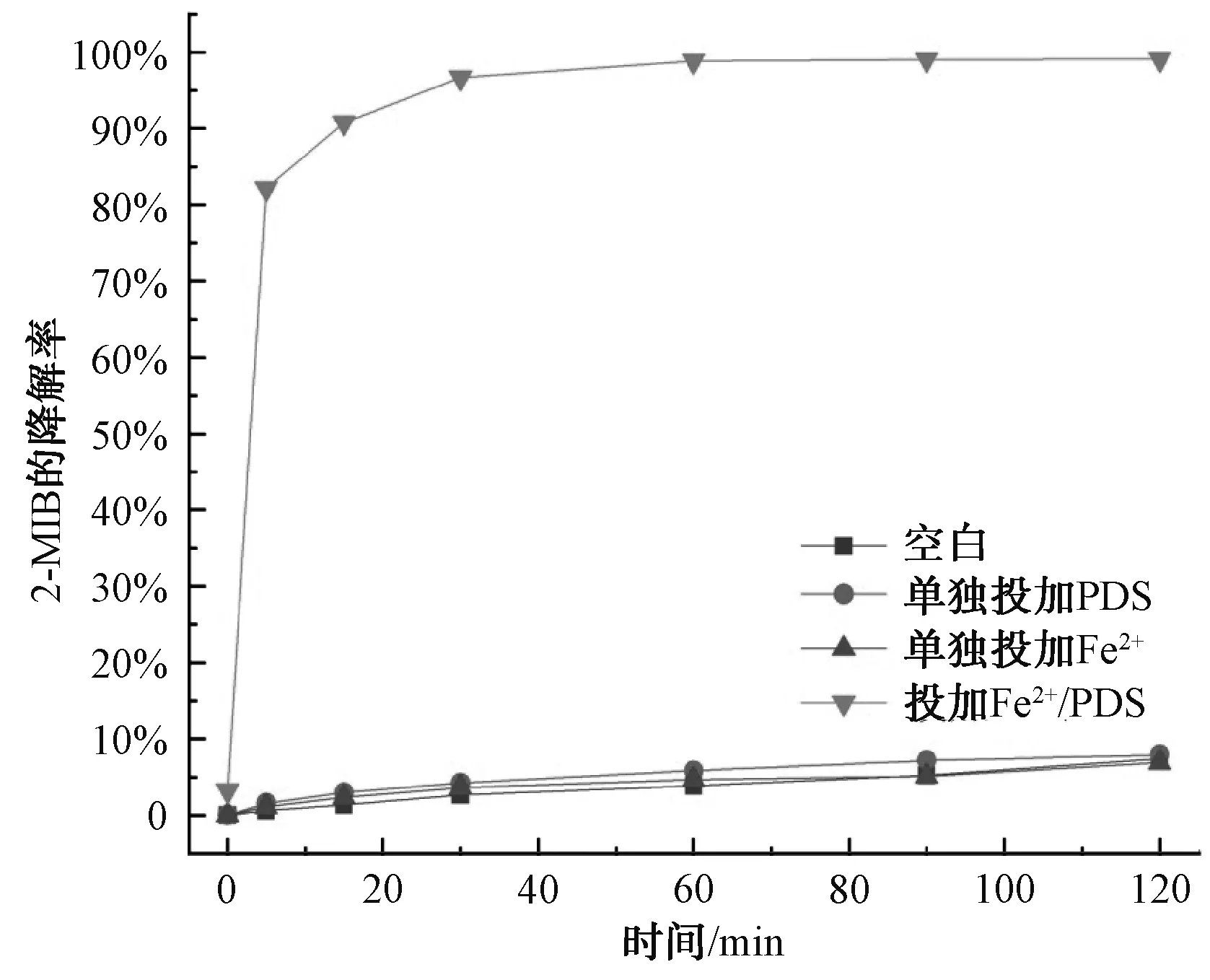
图1 2-MIB的降解效果对比Fig.1 Comparison of Effects of 2-MIB Degradation
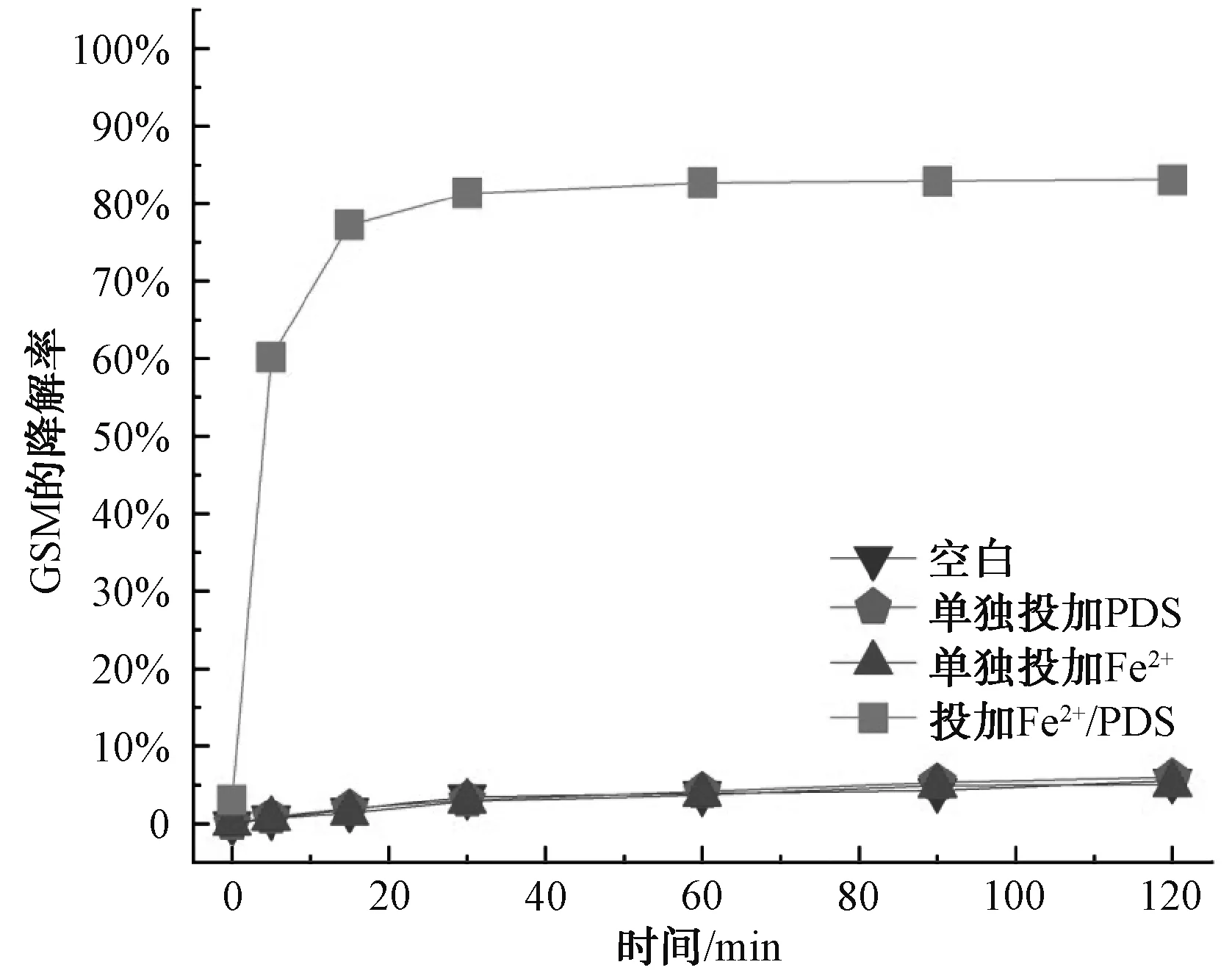
图2 GSM的降解效果对比Fig.2 Comparison of Effects of GSM Degradation
2.2 Fe2+/PDS体系反应机理
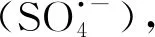
(1)
(2)
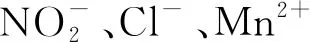
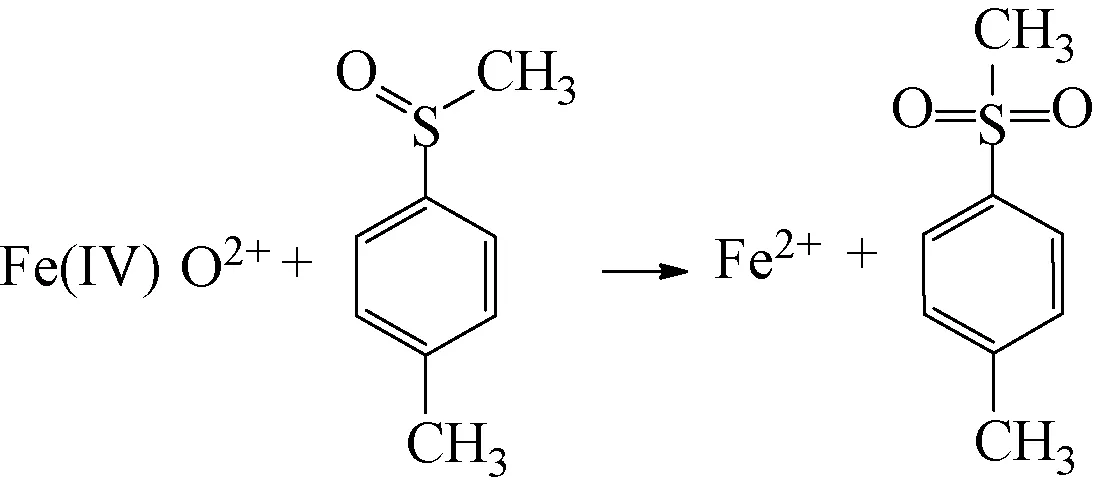
(3)
(4)
(5)
为了确定Fe2+/PDS体系降解2-MIB和GSM中产生的活性物质,采用如下试验方法:在pH值为3.0、Fe2+和PDS的浓度均为1.0 mmol/L、温度为25 ℃的条件下,向体系中加入TMSO作为目标物,利用超高效液相色谱检测其体系中的TMSO和TMSO2的含量,结果如图3所示。由图3可知,反应过程中减少的TMSO的数量与产生的TMSO2的数量几乎完全相等,且在整个反应过程中甲醛的浓度始终为零,检测结果与Wang等[9]观点一致。因此,在Fe2+/PDS体系降解2-MIB和GSM中产生的活性物质是Fe(Ⅳ)。
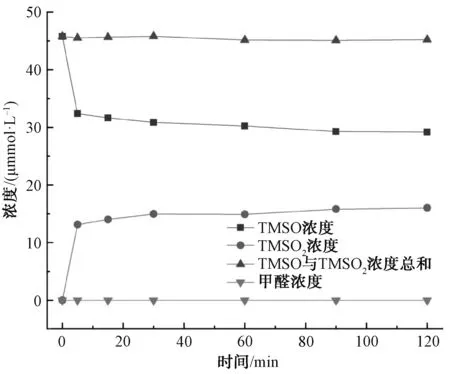
图3 Fe2+/PDS反应过程中TMSO与TMSO2浓度的变化Fig.3 Effects of Concentrations Change on TMSO and TMSO2 in Fe2+/PDS System
2.3 Fe2+浓度对试验的影响
在2-MIB和GSM浓度为1 000 ng/L、PDS为1.0 mmol/L、pH值为3.0、温度为25 ℃的条件下,考察投入体系中的不同浓度Fe2+(0.0、0.125、0.25、0.50、1.0、1.5、2.0 mmol/L)时,对2-MIB和GSM降解率的影响。由图4可知,单独的PDS在本研究的时间范围内无法降解2-MIB和GSM。随着Fe2+浓度从0.125 mmol/L增加到1.0 mmol/L,2-MIB的降解率从75.23%增加至99.10%,GSM的降解率从52.31%增加至83.08%,此时2-MIB和GSM的降解效果最好。而随着Fe2+浓度的继续增加,2-MIB和GSM的降解率呈现逐步下降的趋势,2-MIB和GSM的降解率分别下降至75.7%和67.9%,其原因是过量的Fe2+与2-MIB和GSM竞争体系中的活性物质四价铁[Fe(Ⅳ)],过量的的Fe2+与Fe(Ⅳ)发生反应产生Fe3+,如式(6)[9]。
Fe(Ⅳ)O2++Fe2+(+2H+)→2Fe3++2H2O
(6)
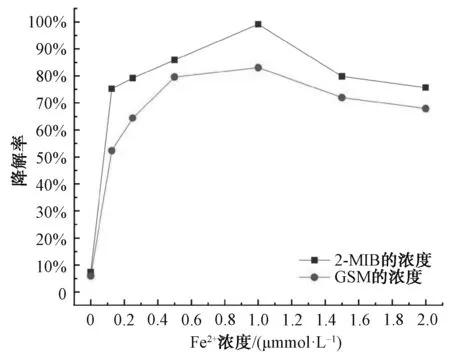
图4 Fe2+浓度对2-MIB和GSM降解率的影响Fig.4 Effect of Fe2+ Concentration on Degradation Rate of 2-MIB and GSM
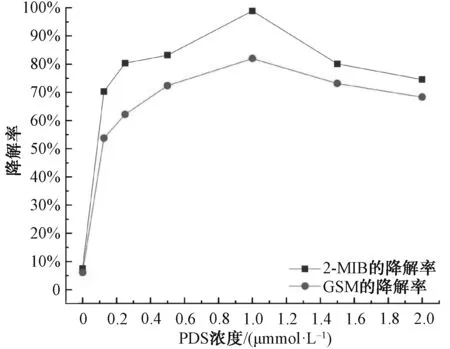
图5 PDS浓度对2-MIB和GSM降解率的影响Fig.5 Effects of PDS Concentration on Degradation Rates of 2-MIB and GSM
2.4 PDS浓度对试验的影响
在2-MIB和GSM初始浓度为1 000 ng/L、Fe2+浓度为1.0 mmol/L、不同浓度PDS (0.0、0.125、0.25、0.50、1.0、1.5、2.0 mmol/L),pH值为3、温度为25 ℃的条件下,考察投入体系的PDS浓度对2-MIB和GSM的降解率的影响情况。由图5可知,单独的Fe2+在本研究的时间范围内无法降解2-MIB和GSM。随着PDS浓度从0.125 mmol/L增加到1.0 mmol/L,2-MIB的降解率从70.29%增加至99.10%,GSM的降解率从70.29%增加至83.08%,此时2-MIB和GSM的降解效果最好。随着PDS浓度的增加,2-MIB和GSM的降解率呈现出先增加后降低的趋势,其原因是过量的PDS也会与2-MIB和GSM竞争体系中的活性物质高价铁Fe(Ⅳ)[9]。因此,2-MIB和GSM的降解率随着PDS浓度的增加而降低。
2.5 pH对试验的影响
Fe2+/PDS体系的初始pH对降解2-MIB和GSM有重要影响。在2-MIB和GSM的初始浓度为1 000 ng/L、PDS和Fe2+的浓度均为1.0 mmol/L、温度为25 ℃的条件下,研究pH值为2.0、3.0、5.0、7.0、10.0条件下2-MIB和GSM的降解率变化情况。由图6可知,随着pH的增大,降解率呈现出先上升后下降的趋势,在pH值=3.0时,2-MIB和GSM的降解率最高,2-MIB和GSM降解率分别为99.10%和83.08%。因此,2-MIB和GSM的降解效果在pH值=3.0的条件下,试验效果最优,中性条件次之,碱性条件效果最差。这是因为在中性和碱性的条件下,Fe2+易发生水解沉淀,参与Fe2+/PDS的有效Fe2+浓度降低,2-MIB和GSM的降解率受影响而降低。
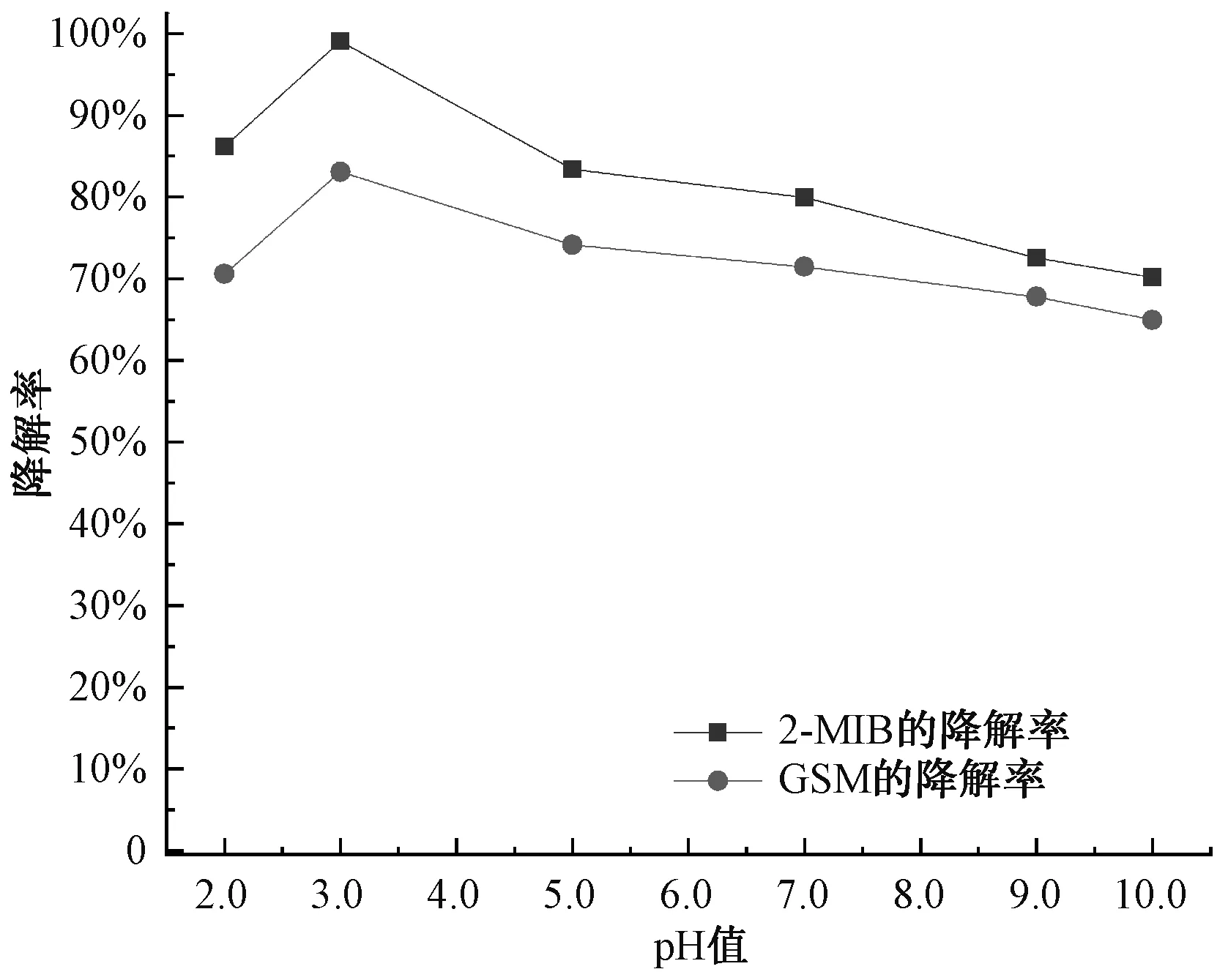
图6 pH对2-MIB和GSM降解率的影响Fig.6 Effect of pH Values on Degradation Rates of 2-MIB and GSM
综上,在pH值=3、Fe2+和PDS浓度均为1.0 mmol/L、温度为25 ℃的条件下,2-MIB和GSM的降解效果最佳。如图7所示,前15 min反应速率较快,2-MIB和GSM在15 min时降解率分别为90.75%和77.22%,15 min后反应趋于平缓,速率较慢。同时,在反应过程中监测Fe2+的浓度变化情况,结果如图8所示。Fe2+在前10 min反应速率较快且浓度变化较大,10 min后体系中Fe2+浓度较低且逐渐趋于0。体系中的95%的Fe2+在前10 min被转化为Fe(Ⅳ)。因此,2-MIB和GSM在前15 min降解速率较快。
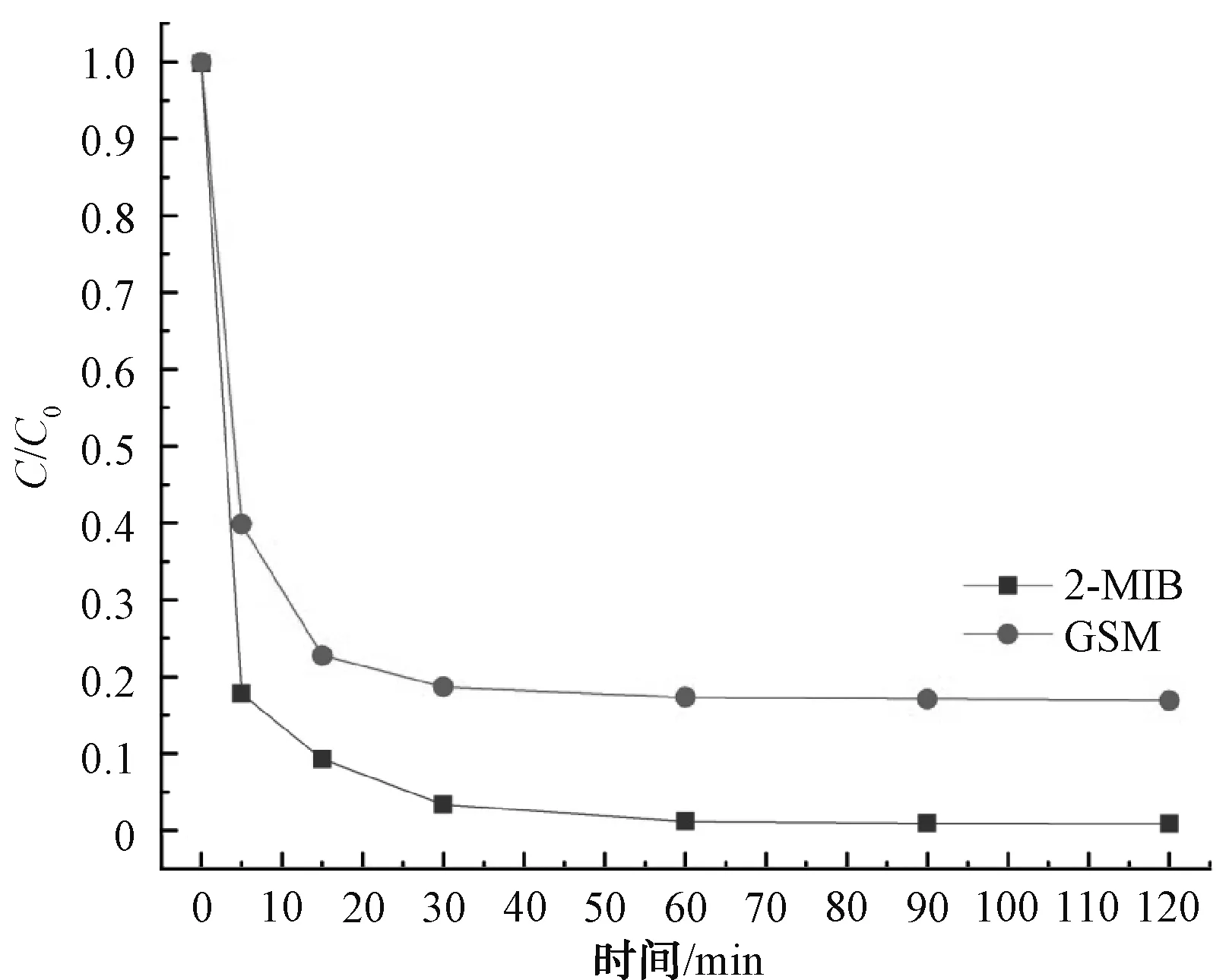
图7 最佳条件下2-MIB和GSM的降解率随时间变化趋势Fig.7 Trends of Degradation Rates of 2-MIB and GSM over Time under Optimal Conditions
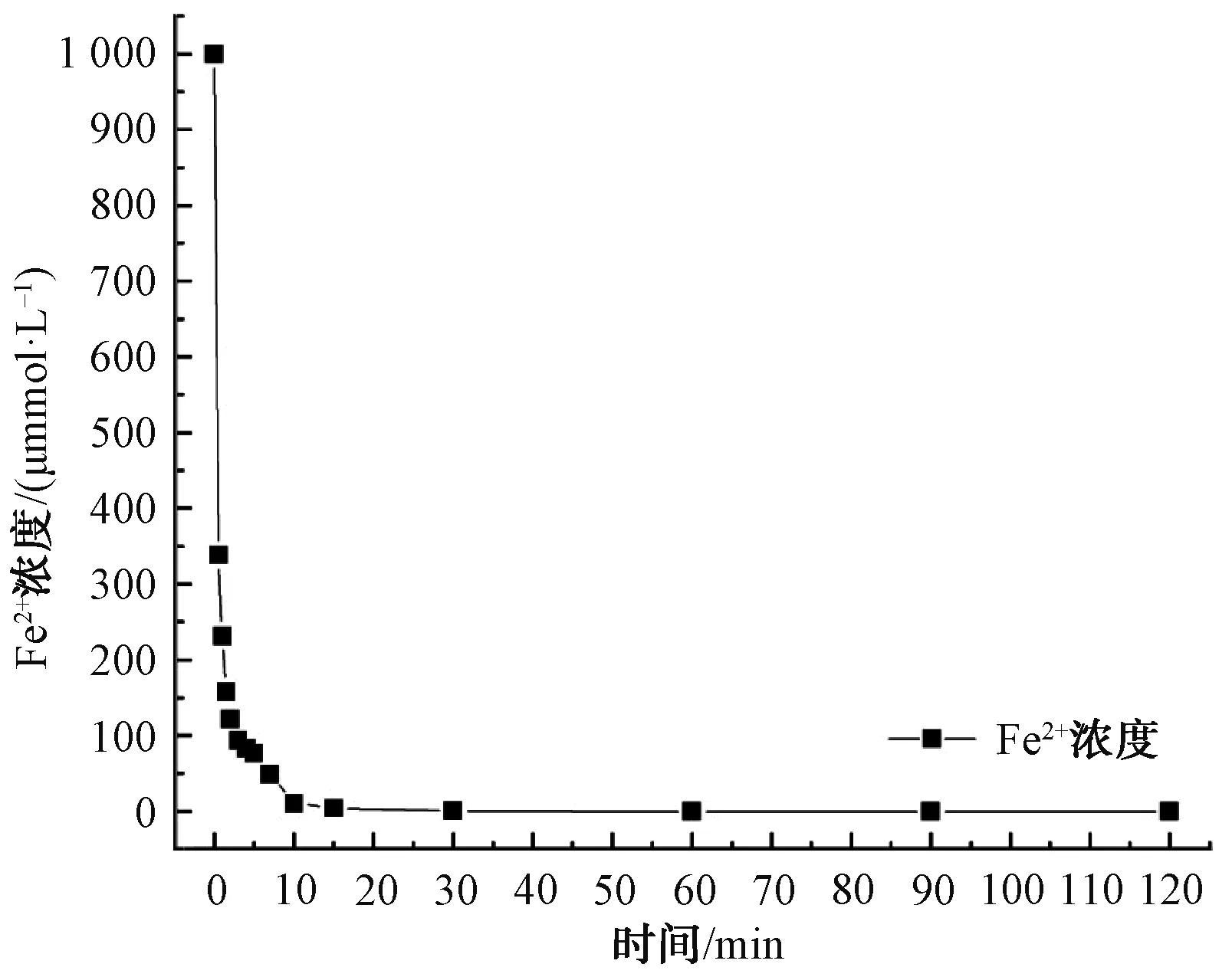
图8 Fe2+的浓度随时间的变化曲线Fig.8 Curve of Fe2+ Concentration Versus Time
2.6 Fe2+/PDS体系对实际水体中2-MIB和GSM的去除
经过上述研究,Fe2+/PDS体系去除水中的2-MIB和GSM的效果良好,因此,采用该体系降解实际水体中的2-MIB和GSM。水样取自深圳某水库,其中2-MIB和GSM浓度分别为13.68 ng/L和3.61 ng/L,pH值为7.8。Fe2+/PDS体系在原pH的条件下处理水库水,2-MIB和GSM的降解率分别为75.64%和69.47%,浓度分别为3.33 ng/L和0.80 ng/L。而在pH值为3.0,PDS和Fe2+的浓度均为1.0 mmol/L、温度为25 ℃的条件下,研究Fe2+/PDS体系对该水库水中2-MIB和GSM的降解效果。如图9所示,15 min前降解速率较快,2-MIB和GSM的降解率分别为95.4%和70.51%,反应结束时2-MIB的浓度为0.135 ng/L,降解率为99.01%,GSM的浓度为0.721 ng/L,降解率为80.03%。因此,pH值=3.0时Fe2+/PDS体系对该水库水中2-MIB和GSM的降解效果更好。
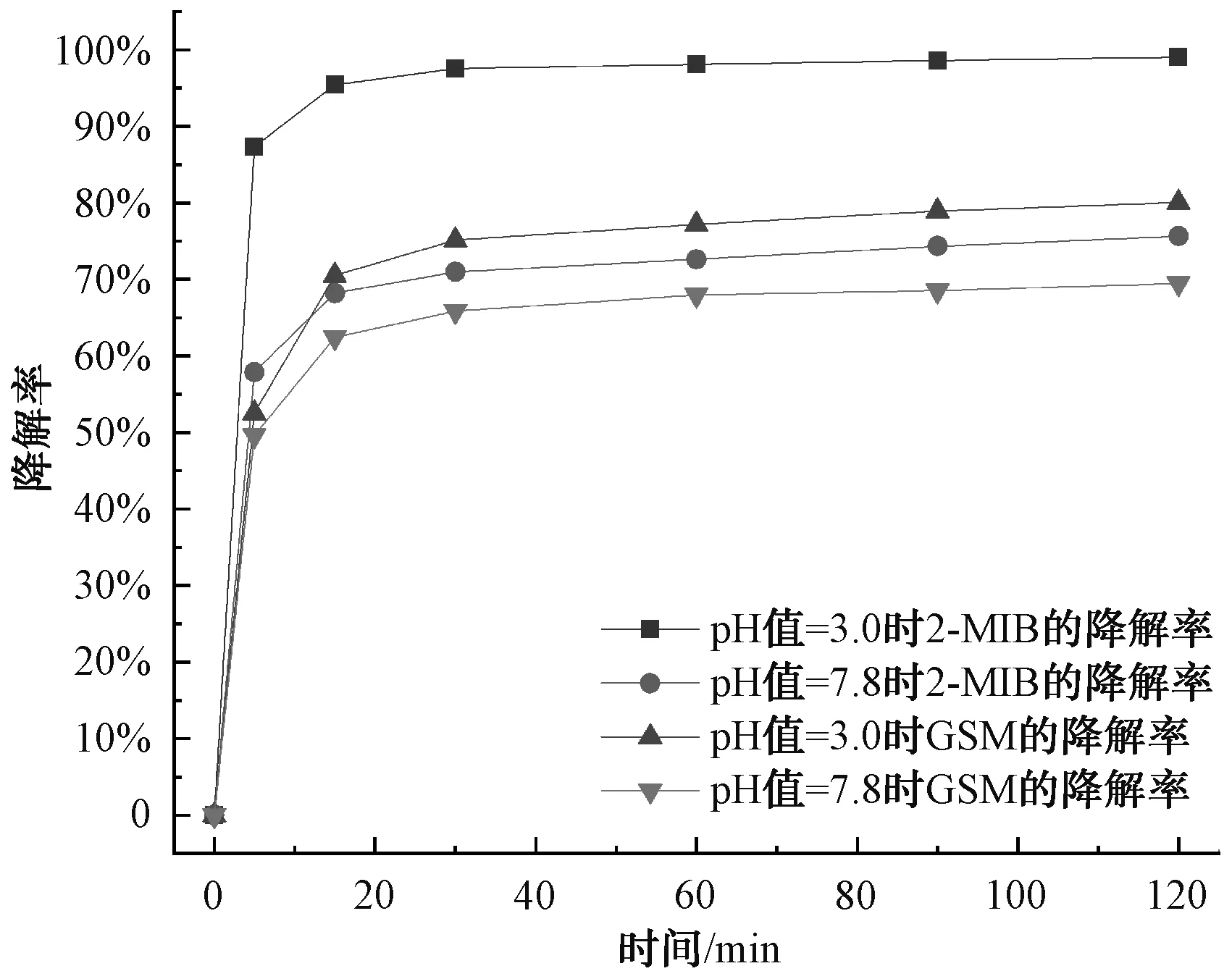
图9 Fe2+/PDS对水库水中2-MIB和GSM的降解效果Fig.9 Degradation of 2-MIB and GSM in Reservoir Water by Fe2+/PDS
3 结论
(1)Fe2+/PDS体系在pH值=3.0、Fe2+和PDS浓度均为1.0 mmol/L、温度为25 ℃的最优条件下, 2-MIB和GSM的降解率可达到99.10%和83.08%。且该体系能应用于实际水体,pH值=3.0条件下降解效果良好,2-MIB和GSM的降解率分别为99.01%和80.03%,因此,该体系具有较好的应用前景。
(2)Fe2+/PDS体系在pH值=3.0条件下,2-MIB和GSM的处理效果最佳。因此,pH值=3.0的条件下,2-MIB和GSM的降解率最高。
(3)随着Fe2+和PDS浓度的增加,2-MIB和GSM的降解率呈现出先增加后降低的趋势,两者最佳浓度比为Fe2+∶PDS=1∶1,最佳浓度均为1.0 mmol/L。